新生儿败血症死亡病例的临床分析
2021-09-26颜慧恒何倩敏王艳丽陈运彬
颜慧恒 李 晖 何倩敏 王艳丽 陈运彬
1.广东省妇幼保健院新生儿科,广东广州 510000;2.广东省妇幼保健院信息管理科,广东广州 510000
新生儿败血症是威胁新生儿生命的重大疾病,在存活新生儿中发病率为4.5‰~9.7‰[1],是新生儿死亡的第三大常见病因[2]。根据发病时间,新生儿败血症被分为早发败血症(early-onset sepsis,EOS)及晚发败血症(late-onset sepsis,LOS)。EOS 一般指发病时间≤3 日龄,LOS 发病时间一般>3 日龄[3]。EOS 与LOS 在高危因素、致病菌、治疗上都存在差别。EOS的发生一般有一个或者多个与妊娠和分娩有关的危险因素,如早产胎膜早破、母亲绒毛膜羊膜炎等,国内常见的病原体为肠杆菌属为主,B 族链球菌(group B streptococcus,GBS)有增多趋势;而LOS 主要见于早产儿,尤其是长期动静脉置管者,国内常见病原体除凝固酶阴性葡萄球菌外,金黄色葡萄球菌也占有相当的比例[4]。本研究通过比较EOS 及LOS 死亡病例的临床特点,以指导临床早期诊断及治疗,降低新生儿败血症的死亡率。
1 资料与方法
1.1 一般资料
回顾性分析2016 年1 月1 日至2020 年12 月31 日广东省妇幼保健院新生儿科住院且死亡原因为新生儿败血症的死亡病例,排除临床病例资料严重不完善者。
新生儿败血症的诊断根据《新生儿败血症诊断及治疗专家共识(2019 年版)》[3],即临床诊断为有临床异常表现,同时满足下列条件中任何一项:①血液非特异性检查大于或等于两项阳性;②脑脊液检查为化脓性脑膜炎改变;③血中检出致病菌DNA。新生儿败血症死亡原因的判定依据世界卫生组织ICD-PM 围生期死亡原因分类标准[5]。确定诊断者有临床异常表现,且血培养或脑脊液(或其他无菌腔液)培养阳性。将发病时间≤3 日龄分为EOS 组,>3 日龄分为LOS 组。
1.2 研究方法
收集患儿临床资料,提取并整理原始数据,包括①母亲围生期资料:胎儿窘迫史、胎膜早破≥18 h、羊水Ⅲ度污染、母亲年龄、母亲绒毛膜羊膜炎、母亲孕后期感染等;②新生儿出生情况:性别、出生胎龄、出生体重、分娩方式;③新生儿住院情况:发病至死亡时间;血培养细菌分类;起病后白细胞计数(white blood cell count,WBC)最高值、最低值,血小板计数(platelet count,PLT)最低值,C 反应蛋白(C-reaction protein,CRP)最高值、降钙素原(procalcitonin,PCT)最高值;住院期间的并发症,包括新生儿坏死性小肠结肠炎(neonatal necrotizing enterocolitis,NEC)、细菌性脑膜炎、感染性肺炎、新生儿高血糖症、新生儿低血糖症、新生儿肺出血、围生期窒息的发生情况。所有诊断均根据《实用新生儿学》[4]第5 版的疾病诊断标准。
1.3 统计学方法
采用SPSS 23.0 统计学软件进行数据分析,符合正态分布计量资料用均数±标准差()表示,两组间比较采用t 检验;不符合正态分布的改用中位数(M),四分位数(P25,P75)表示,两组间比较采用Mann-Whitney U 检验。计数资料用例数或百分率表示,组间比较采用χ2检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 两组一般情况比较
研究期间共收集到新生儿败血症死亡病例84例,其中EOS 组38例,LOS 组46例。EOS 组出生胎龄为25.0~41.1 周,出生体重为0.61~4.10 kg;LOS 组出生胎龄为25.0~39.0 周,出生体重为0.67~4.00 kg。
两组性别、出生胎龄、早产、出生体重、超低出生体重儿、小于胎龄儿、剖宫产比较,差异无统计学意义(P >0.05)。EOS 组发病至死亡时间短于LOS 组,差异有统计学意义(P <0.05)。见表1。
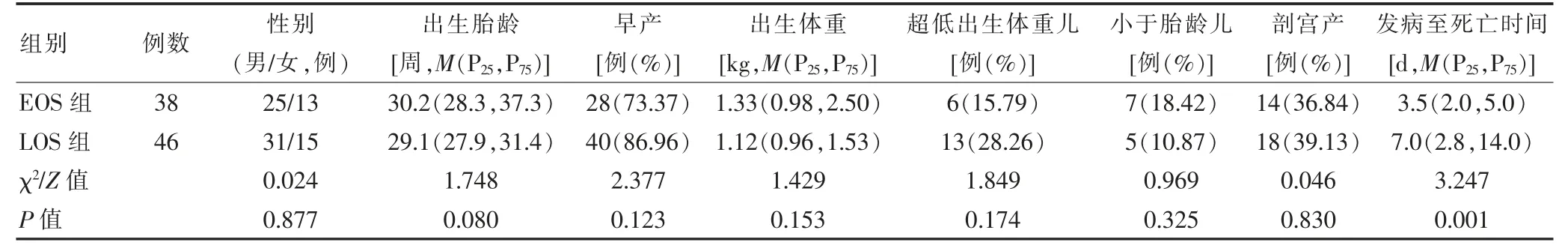
表1 两组一般情况比较
2.2 两组围生期情况比较
EOS 组3例母亲孕后期感染,分别为李斯特菌感染、肺炎支原体感染及孕后期发热;LOS 组1例母亲孕后期感染,为孕后期发热。两组胎膜早破≥18 h、羊水Ⅲ度污染、胎儿窘迫、母亲年龄>35岁、母亲绒毛膜羊膜炎、母亲孕后期感染发生率比较,差异无统计学意义(P >0.05)。见表2。
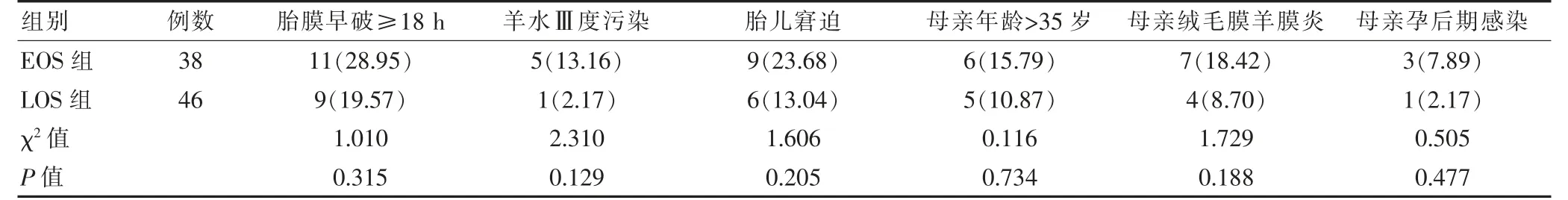
表2 两组围生期情况比较[例(%)]
2.3 两组相关检验值比较
EOS 组肺炎克雷伯菌检出率低于LOS 组;EOS组WBC<5×109/L、WBC 升高发生率低于LOS 组,差异有统计学意义(P <0.05)。两组PLT<100×109/L、PLT≤30×109/L、CRP≥100 mg/L、PCT≥30 ng/ml。GBS发生率及GBS 大肠埃希菌检出率比较,差异无统计学意义(P >0.05)。见表3。
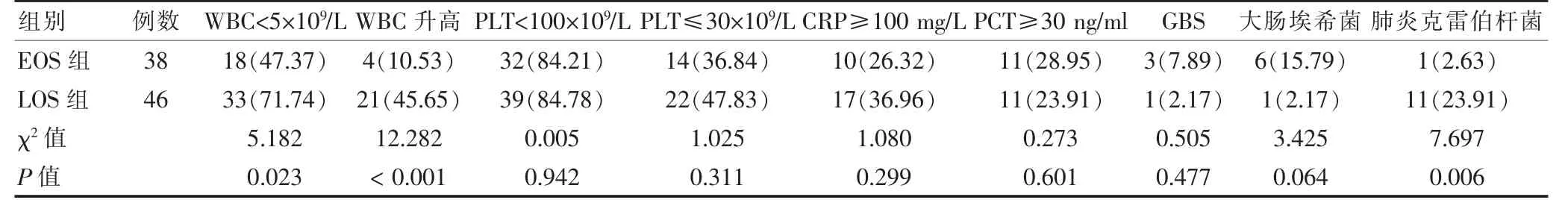
表3 两组相关检验值比较[例(%)]
2.4 两组住院期间并发症的发生情况
EOS 组NEC 发生率低于LOS 组,围生期窒息发生率高于LOS 组,差异有统计学意义(P <0.05)。两组细菌性脑膜炎、感染性肺炎、新生儿高血糖症、新生儿低血糖症、新生儿肺出血发生率比较,差异无统计学意义(P >0.05)。见表4。
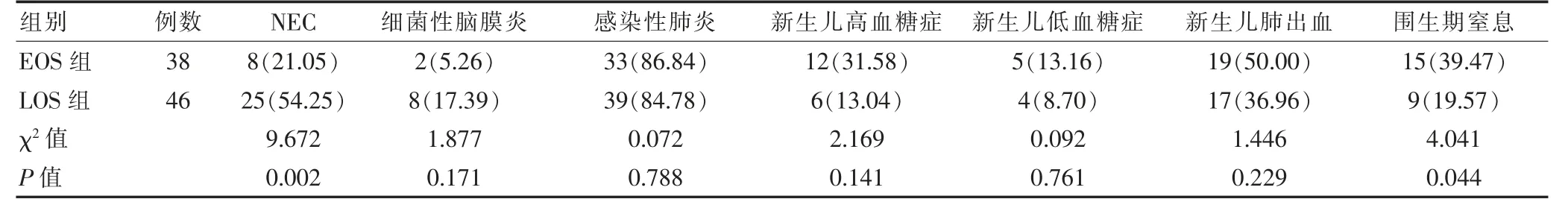
表4 两组住院期间并发症的发生情况[例(%)]
3 讨论
新生儿败血症的死亡率高,新生儿败血症死亡人数占全球每年新生儿死亡人数的1/4[6],不同胎龄死亡率差异大,为2%~20%[7-8],不同地区差异也存在很大差异[9-13]。在我国,感染性疾病仍为新生儿死亡的主要原因之一,且沿海地区感染性疾病死亡的比例仍有上升[14]。EOS 与LOS的发病率存在差异,美国疾病预防控制中心的主动细菌核心监测报告显示[15-16],早发型GBS 感染率已有所下降,由2000 年的0.6/1000活产婴下降至2015 年的0.21/1000 活产婴。在同样的时间跨度内,晚发型GBS 感染率仍保持相对稳定,2000 年为0.4/1000 活产婴,2015 年为0.32/1000 活产婴。多中心回顾性分析显示[17],386 423 名活产婴儿中,有454例婴儿患EOS,GBS(37%)和大肠埃希菌(25%)是最常见的致病菌,大肠埃希菌感染的死亡率(25%)高于GBS(11%)。
EOS 与LOS 在高危因素、致病菌及治疗上有着明显的差别。在病原体方面,基于美国2005—2014 年的流行病学调查显示[8],EOS 最常见的感染菌为GBS及大肠埃希菌,其中165例败血症死亡病例中,病原体检出为大肠埃希菌感染者占51.5%。而在2011—2017 年,苏州大学儿童医院患有EOS的住院新生儿(出生体重>800 g)中,最常见的EOS 病原体是GBS(28.1%),其次是大肠埃希菌(21.6%),85.6%的EOS患儿可以存活直到出院,而有44例死亡,病死率达14.4%[18]。
在国内,LOS 主要致病菌除凝固酶阴性葡萄球菌外,气管插管机械通气患儿以革兰氏阴性菌如铜绿假单胞菌、肺炎克雷伯菌、沙雷菌等多见。程琳等[19]研究显示,肺炎克雷伯菌感染在晚发型组中占比更高。Gao等[20]对中国南方地区新生儿败血症的研究显示,肺炎克雷伯菌是早产儿LOS 中最常见的病原体,与本研究结果一致。本研究结果显示,EOS 组发病至死亡时间短于LOS 组,白细胞计数异常的发生率低,可能与EOS 死亡病例发病急,而血液非特异性指标仍未达高峰有关[21-23]。EOS 组围生期窒息发生率高于LOS 组,Jatsho 等[24]研究显示,1 min Apgar 评分<6 分时显著增加了EOS的发生风险,其他作者[25-26]也有类似的结果。NEC 一般在出生7 d 后发病,发病日龄与出生体重和胎龄相关,由于EOS 发病时间一般在出生后3 日龄,所以EOS 合并NEC的比例较LOS 合并NEC 比例低。本研究结果显示,LOS 组NEC的发生率为54.25%,与Rafi 等[26]的研究结果相似,并且该研究指出,LOS并发脑膜炎、呼吸机相关肺炎或NEC 时,可增加败血症的归因死亡率。
新生儿败血症作为新生儿期的危重症,死亡率高,本研究分析了EOS 与LOS 死亡病例的临床特点,发现EOS 发病至死亡时间更短,但WBC 计数变化不明显,血培养检出菌及合并症的发生情况与LOS 有差异。新生儿期EOS 和LOS 导致死亡的高危因素不同、病原体不同、合并症也有差异,在临床工作中应引起重视。
