肝脏三维可视化重建技术在儿童复杂肝母细胞瘤肝切除术中的应用价值
2021-09-25叶进冬李华丽李潇然段留新刘军桂段伟宏刘全达
赵 頔, 叶进冬, 李华丽, 金 奎, 刘 翔, 李潇然, 段留新, 刘军桂, 吕 伟, 段伟宏, 刘全达
火箭军特色医学中心全军肝胆胃肠病中心 肝胆外科, 北京 100088
肝母细胞瘤是儿童最常见的肝恶性肿瘤,目前肝母细胞瘤的治疗主要是根治性手术切除联合术前(新辅助)或术后化疗,根治切除术后5年生存率达70%~80%[1-5]。肝肿瘤手术,既要彻底切除肿瘤,又要保留足够剩余肝体积和肝功能,才能保证手术安全性和远期疗效。肝内胆道和血管系统结构复杂,而复杂肝母细胞瘤往往合并重要肝内脉管结构受累,因此术前精准评估,设计最优化的手术方案极为重要[6]。基于薄层CT/MRI影像重建的肝脏三维可视化重建技术,已被证实有助于提高肝脏手术的安全性[7-9],逐渐应用于儿童肝良恶性肿瘤的手术规划[10-13]。本中心已常规将肝脏三维可视化重建技术应用于复杂儿童肝母细胞瘤的术前评估,本研究通过回顾性分析评价其临床应用价值。
1 资料和方法
1.1 研究对象 收集2018年1月—2020年10月本中心收治的肝母细胞瘤患儿的临床资料。纳入标准:(1)经病理学诊断确诊,接受过规范的术前和/或术后化疗;(2)实施了以根治性切除为目的的肝肿瘤切除术;(3)临床资料和随访信息完整。排除标准:(1)存在明确的手术禁忌证,如合并心肺功能不全、凝血功能障碍、骨髓抑制明显等;(2)配合度和依从性差。将术前行三维可视化重建评估的患儿纳入三维重建组,未行者纳入对照组。
1.2 三维可视化重建方案 采用64排螺旋CT(美国GE公司)和IQQA-Liver系统(EDDA Technology,医软信息科技上海有限公司)进行三维可视化重建。将CT数据导入到IQQA-Liver系统,显示肝脏、肝内脉管系统与肿瘤的关系,构建肝脏及病灶的三维可视化重建模型,通过IQQA-Liver系统操作,更清晰呈现肝内血管、胆道系统的相关走形和变异,肿瘤与肝内脉管系统的关系,显示肝脏分段、肿瘤位置和计算肝体积情况,评估手术切除范围,保证尽可能切除病灶又保留更加多的肝体积。同时,在三维模拟软件上行虚拟肝切除术,测算预留肝体积,制订个性化手术方案。
1.3 手术方案 所有患儿术前均完善心肺功能、血常规、肝肾功能、胸腹部CT等检查。所有手术均由同一个手术团队完成。患者采用全身麻醉,先解剖第一、二肝门,预置阻断带,阻断出入肝血流用。常规配备术中超声,监测肿瘤边界和重要脉管。尽可能在距离肿瘤边缘>1.0 cm范围切除肝实质。行解剖性肝切除术时,采用Glisson蒂横断式肝切除法,先阻断肿瘤侧肝段的肝蒂,观察肝段缺血范围,对照术前三维可视化影像,采用超声刀和CUSA刀逐步离碎肝实质,显露脉管系统,其中<3 mm脉管使用电刀凝结,>3 mm则使用丝线结扎后离断,较大脉管用Prolene线缝扎。阻断入肝血流采用选择性半肝或全肝Pringle法,一次阻断为10~15 min,间隔至少5 min。术后给予保肝补液预防感染等治疗,补液量按体质量测算。术后第1天即进食流食。定期复查血常规、生化、凝血和AFP等指标。所有患者术后均通过门诊和电话定期随访,随访内容包括是否化疗及方案、周期,实验室检查及超声、增强CT等影像学检查,有无复发、转移等病情变化。
1.4 伦理学审查 本研究方案经由火箭军特色医学中心伦理委员会审批,所有患儿家属均签署知情同意书。
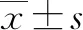
2 结果
2.1 一般资料 共纳入肝母细胞瘤患儿30例,其中男18例,女12例,平均42(8~152)个月。三维重建组15例,对照组15例。2组患儿在性别、化疗次数、ALT、AFP、血红蛋白、血小板计数、多发病灶、门静脉受累、尾状叶受累、肿瘤破裂/出血、肿瘤大小、远处转移等方面差异均无统计学意义(P值均>0.05)。而三维重建组较对照组平均年龄更大、POSTTEXT Ⅲ/Ⅵ期和肝静脉或下腔静脉受累者更多,差异均有统计学意义(P值均<0.05)(表1)。

表1 2组患儿术前一般资料比较
2.2 术中情况比较 所有患儿均按照术前规划方案完成手术,具体手术方式见表2。三维重建组相较于对照组术中处理肝内脉管系统情况更多,对照组更多行规则肝段切除。三维重建组与对照组在出血量、手术时间、肝门阻断次数/时间、行肝段及部分肝切除例数方面,差异均无统计学意义(P值均>0.05)(表2)。

表2 2组患儿手术方式及术中指标比较
2.3 术后指标及随访结果比较 2组患儿术后均恢复顺利,未见急性肝衰竭及死亡等事件。术后早期2组肝功能指标、术后输血量及住院时间等均无统计学差异(P值均>0.05),术后并发症方面亦无统计学差异(P>0.05)(表3)。三维重建组有1例术后门静脉血栓形成,经抗凝治疗后消失。所有患儿术后病理学检查均证实为肝母细胞瘤,2组病理分型无统计学差异(P>0.05)(表4)。
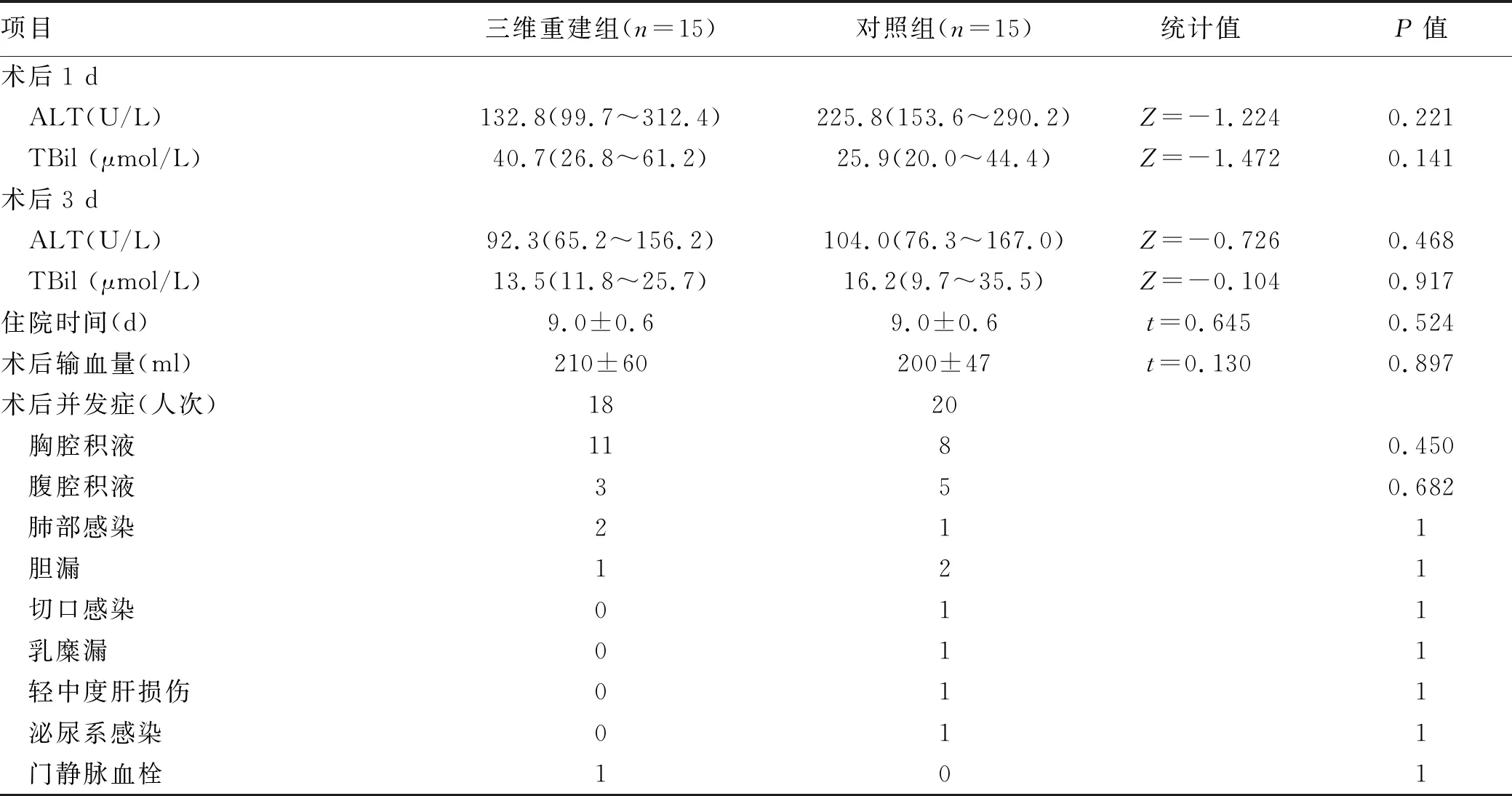
表3 2组患儿术后情况比较

表4 2组患儿肝母细胞瘤病理分型
2组患儿术后中位随访时间9.5(1.0~24.0)个月。随访期间,三维重建组2例复发,分别于术后10个月和12个月确诊,目前继续化疗中;对照组4例复发,高于三维重建组(P=0.651),其中2例在术后7个月复发接受肝移植存活至今,另有2例复发后短期内死亡。
2.4 典型病例分析 患儿男性,26个月龄,6个月前因腹部膨隆就诊,血AFP 730 000 ng/ml,CT检查示肝脏多发病灶伴肺转移,肝穿刺活检确诊“胎儿型上皮性肝母细胞瘤”。第2周期化疗前因肿瘤破裂伴出血性休克,急诊全麻下行经超选择性右肝动脉化疗栓塞(TACE)、微钢圈右肝动脉栓塞术,介入止血和TACE效果好。后给予5个周期化疗,第4周期前AFP水平开始反弹;后实施第2次TACE。术前行增强CT检查和三维可视化重建(图1),总体评估手术切除肝脏病灶可行,保留足够残余肝体积是手术成败的决定性因素。

注:a~b,全肝多发肿瘤,仅大部分左肝内叶和部分左肝外叶存在正常肝实质,肿瘤侵犯右肝蒂、右肝静脉,中肝静脉和左肝静脉的部分2级分支受累; c~d,三维可视化重建正面和反面观,证实CT影像所示,右肝蒂受累(箭头),中肝静脉主干完整;供应左肝内叶矢状部肝蒂3级以上分支和肿瘤关系密切。
术前诊断为肝母细胞瘤(POST-TEXT Ⅳ期,F1H1M1P1V1,高危),初步预设手术方案为解剖性右半肝切除联合左肝外叶肿瘤切除术;此方案肝体积测算:全肝总体积709.88 cm3,右半肝462.09 cm3,左肝病灶79.30 cm3, 残肝体积168.49 cm3(23.7%); 但鉴于右肝肿瘤下缘突过半肝Cantline线,考虑到至少0.5~1.0 cm阴性切缘,则实际需要实施的手术方案为:扩大右半肝切除联合左肝外叶肿瘤切除术。手术过程见图2。患儿术后恢复顺利,第7天出院,出院前CT检查证实未见肿瘤残留,残肝体积明显增大(图3)。术后继续化疗,肝脏手术5个月后接受肺转移灶切除术。目前全身状态良好,复查无肿瘤复发迹象。

注:a, 充分游离肝周韧带; b, 术中超声协助下在距离肿瘤1 cm处勾勒预切除术线;第二肝门处肿瘤左侧缘先行微波消融,从而可以降低肿瘤扩散风险,也缩小阴性切缘范围,以保留更多肝实质; c, 扩大右半肝切除后的右肝断面(可见右肝静脉断端和显露的中肝静脉); d, 超声定位下勾勒左肝外叶病灶预切除线,因为介入后肿瘤坏死彻底,预切除线紧邻肿瘤边界; e, 切除肿瘤后残余肝脏大体观; f, 切除标本。
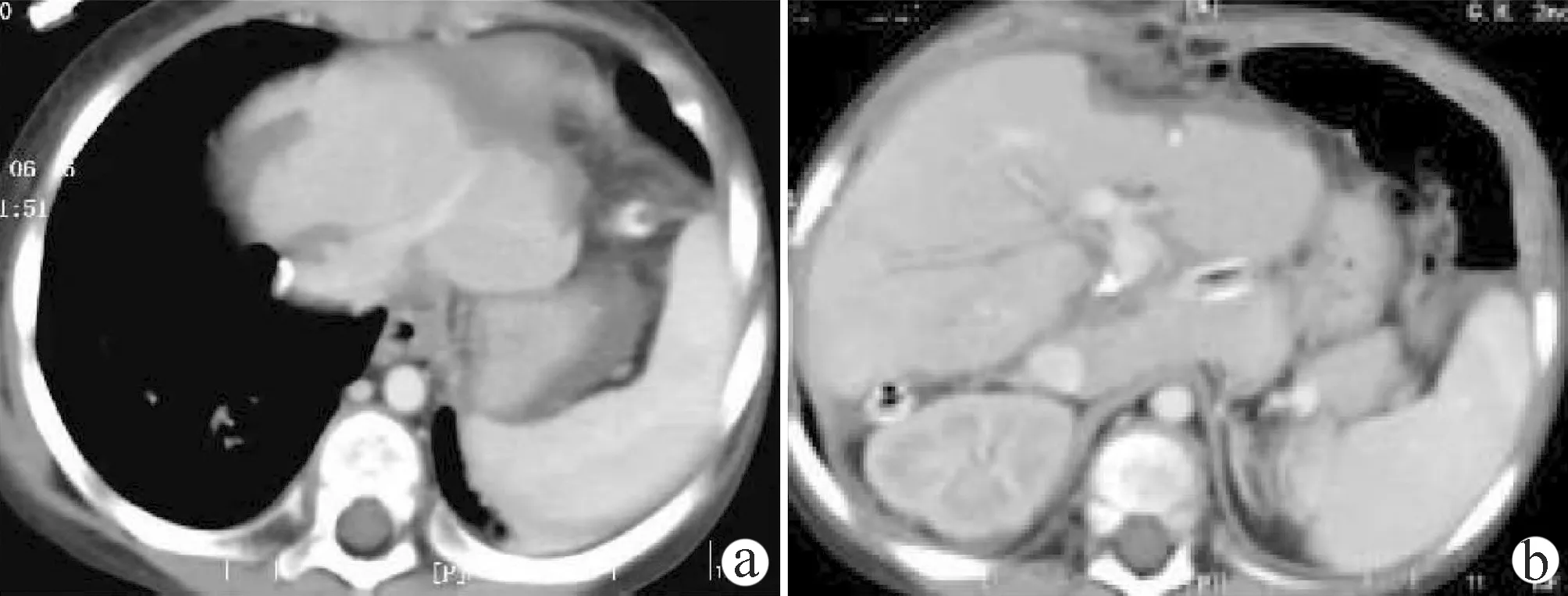
注:a,未见明显胸腔积液,肝静脉未见异常; b,未见明显腹腔积液、肝肿瘤残留及其他并发症,肝内血管无血栓形成,残肝体积明显增大。
3 讨论
手术彻底切除肝肿瘤是儿童肝母细胞瘤术后长期生存的主要预后因素。新辅助化疗联合肝切除术,术后辅助化疗,是当前主流的肝母细胞瘤治疗策略。当只能由全肝切除才有机会获得肿瘤根治切除效果时,则需要选择肝移植术。研究[1-6,14]表明,新辅助化疗可以使相当一部分无法切除的肝母细胞瘤患者获得根治性切除的机会。但对于经过新辅助化疗后仍处于POSTTEXT Ⅲ/Ⅵ期的局部晚期肝母细胞瘤,切除手术具有极大的挑战性。原因在于肿瘤往往已侵犯重要血管或胆管系统,需要大范围肝切除,容易发生肝切除术后残肝体积不足引起急性肝功能不全的风险[6,14];如果肝切缘肉眼可见残留肿瘤,则是明确的预后不良因素,而切缘显微镜下阳性对预后影响有争议[15]。本研究中,相较于对照组,三维重建组80%的患儿属于POSTTEXT Ⅲ/Ⅵ期,73%合并有肝静脉/下腔静脉受累,且年龄明显偏大,以上因素仅为公认的肿瘤预后分层的高危险因素[1-2],因此更适合行肝移植。但各种原因所限,患儿家属均选择肝切除术,为临床治疗带来极大的挑战和不确定性。
在三维重建可视化技术成熟之前,外科医生往往通过CT或MRI的二维影像结合自身临床经验构建肿瘤及其周边毗邻的三维关系,进而制订手术方案,手术方案的可行性、合理性受术者临床经验、术中心态等诸多主观因素影响,一旦术中对肝内解剖关系把握欠准,极易导致肝内脉管系统损伤,造成严重的不良后果。随着计算机技术、现代医学影像学和外科技术的快速发展,催生了基于CT/MRI数据的三维可视化重建技术,推动肝切除术逐渐由传统经验外科向精准肝切除模式转变[8]。三维可视化重建技术可以更客观准确呈现肝内血管、胆道系统走形和变异,肿瘤与肝内脉管结构关系,计算肿瘤和肝脏各叶段体积情况。同时,还可以模拟不同手术场景的可行性和安全性,了解肝切除平面内脉管解剖结构,精确测算残肝体积,从而实现手术安全性和肿瘤学预后的双重获益[16]。本研究中,三维重建组患儿的手术更为复杂,多个患者实施了极限肝切除术,例如上文的典型病例,患儿残肝体积不足23.7%,但由于采用了三维可视化重建技术,三维可视化与对照组在手术时间、出血量、并发症、术后恢复和住院时间等方面无明显差异。换言之,富有经验的术者应用三维可视化重建技术可以使复杂肝母细胞瘤手术的安全性提升到与简单手术近乎相同水平,尤其是可以使部分POSTTEXT Ⅲ/Ⅵ期患者安全实施扩大肝切除术,从而避免行肝移植[6,14]。
本中心对于大部分POSTTEXT Ⅲ/Ⅵ期肝母细胞瘤手术,常规行术前吲哚菁绿肝功能储备检查,与三维可视化重建技术的体积测评相互印证,评估最大可切除肝体积,确保足够的残肝体积。本中心还常规应用术中超声和Doppler血流成像系统,以保护肝切除平面的重要脉管结构。此外根据临床实际情况,还需联合吲哚菁绿荧光染色加强术中的精准引导[8]。
由于本研究样本量较小,随访时间较短,尚无法评估三维可视化重建技术对肝切除术后肝母细胞瘤患儿远期肿瘤学预后的影响。需要强调的是,这种基于腹部CT检查基础上的三维可视化重建技术仍有局限性,受制于患者疾病的复杂多样性,工程师对临床医生意图了解的差异性,均一定程度影响三维重建的准确性。三维可视化重建技术只是辅助工具,手术成功与否的决定因素仍取决于术者长期积累的能力素质。但三维可视化重建技术相较于传统影像学检查,无疑具有明显优势和临床指导价值,可以有效提升极量肝切除手术的安全性。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:赵頔、叶进冬负责资料分析,撰写论文;李华丽、金奎、刘翔、李潇然、段留新、刘军桂、吕伟参与收集数据,修改论文;段伟宏、刘全达负责课题设计,拟定写作思路,指导撰写文章并最后定稿。
