基于质谱技术的代谢组学在体外药物肝毒性评价中的研究进展
2021-09-24李丽美臧清策张瑞萍再帕尔阿不力孜
李丽美,臧清策,张瑞萍,再帕尔·阿不力孜,2
(1.中国医学科学院/北京协和医学院药物研究所,天然药物活性物质与功能国家重点实验室,北京 100050;2.中央民族大学生物成像与系统生物学研究中心,北京 100081)
药物毒性评价是药物研发的重要环节,肝脏作为药物毒性反应的主要靶器官,暴露于外源性物质及其代谢产物,容易引发损伤,导致肝功能不全或肝功能紊乱[1]。药物诱导性肝损伤(drug-induced liver injury, DILI)是临床试验失败、药品上市后撤回和出现新黑匣子警告的主要原因之一[2-3]。据统计,由于DILI导致药物研发项目在早期终止的比例高达12%~14%[4]。因此,建立可靠的药物肝毒性评价方法,在研发早期对具有潜在DILI风险的药物进行预测和评价,对于提高药物研发成功率具有重要意义。
药物暴露会影响细胞的结构与功能,改变细胞代谢途径中内源性代谢物的转化平衡,引起细胞对毒物或其他外源刺激的响应,产生毒性反应[5],因此,细胞代谢表型变化可以作为直接反映药物毒性效应的评价指标。代谢组学通过分析生物样品中分子质量在1 000 u以下的代谢物信息,可以确定毒性损伤程度,推测毒性机制,发现生物标志物[6-7]。细胞代谢组学具有实验成本低、实验条件易控、重复性好等优势,已成为药物肝毒性体外评价的重要技术[8]。质谱(mass spectrometry, MS)单次检测可获得大量的代谢物信息,如精确质荷比、同位素分布、特征离子、峰强度、峰面积等。液相色谱-质谱(liquid chromatography-mass spectrometry, LC-MS)联用技术具有分离度好、灵敏度高和重现性好等特点,能够实现代谢组高灵敏、高覆盖的定量分析,且广泛的数据库可用于代谢物鉴定[9],是目前代谢组学研究常用的分析工具。质谱成像(mass spectrometry imaging, MSI)技术作为一种新型的分子影像技术,能够直接从细胞、组织、器官等生物样品中获得大量已知或未知的内源性代谢物或外源性药物的含量和空间分布信息。基于质谱成像技术的空间分辨代谢组学提供组织原位代谢物受药物刺激后的时空变化信息,为药物肝毒性研究提供了一种新颖的手段。
本文基于质谱技术的代谢组学分析方法及其在肝毒性研究中的应用,从目前肝毒性研究中常用的细胞模型与培养方法进行综述,旨在为药物体外肝毒性研究提供思路和途径。
1 药物肝毒性评价细胞模型
为准确进行体外药物肝毒性评价,首先应该选择合适的肝细胞类型和培养方法。本文对药物肝毒性研究中常用的几种细胞类型进行总结,并概括其优势和不足。
1.1 药物肝毒性评价的主要细胞类型
1.1.1原代肝细胞(primary hepatocytes, PHHs) PHHs是直接从肝脏中分离获得的,具有高水平的药物代谢酶和转运体,被认为是外源性化合物代谢和肝毒性研究细胞模型的“金标准”,可用于代谢酶的诱导/抑制以及化合物筛选的研究。然而,在常规的二维单层培养模式下,随着细胞从组织中剥离时间的延长,细胞肝特异性功能(如白蛋白生成和细胞色素P450(CYP450)表达)会迅速下降,通常仅能够维持24~72 h[10]。
1.1.2永生化肝细胞系 通常获取永生化肝细胞系的方法有2种:一种是通过PHH进行基因工程改造;另一种是从突变的肝肿瘤中分离得到永生化的肝肿瘤细胞[11]。永生化肝细胞系的主要优点是具有几乎无限的增殖能力和相对较低的培养成本。目前,HepaRG和HepG2细胞是研究药物肝毒性最常用的肝肿瘤细胞系,它们容易获得,且具有基因型稳定表达和无限增殖的能力。此外,这2种细胞均可对典型的P450诱导剂产生反应[12],诱导后可增加CYP450酶的活性。这类细胞的缺点是肝功能标志物的表达水平远低于原代肝细胞的平均水平;其次是基因型单一,仅能代表单个供体的表型,不适合进行人群异质性研究,并且其肿瘤特征可能导致对毒性损伤的敏感性减弱[13]。
1.1.3肝细胞样细胞(hepatocyte-like cells, HLCs) 随着干细胞培养技术以及相关研究的突破,基于干细胞衍生的肝细胞系成为一种广泛使用的肝细胞模型,其通常由诱导的多能干细胞(induced-pluripotent stem cell, iPSCs)和干细胞(stem cell)衍生,这些细胞模型常被用于肝毒性的相关研究[14]。然而,目前尚无干细胞能够成功分化为完全成熟的肝细胞,这些具有肝细胞特征的干细胞衍生细胞通常被称为HLCs[15]。在诱导干细胞重编程过程中可能会导致遗传改变和分化异质性,与成熟的人类肝细胞的表型相似性有限。这3种细胞类型的优、缺点列于表1,可根据需要选择细胞类型进行体外肝毒性研究。
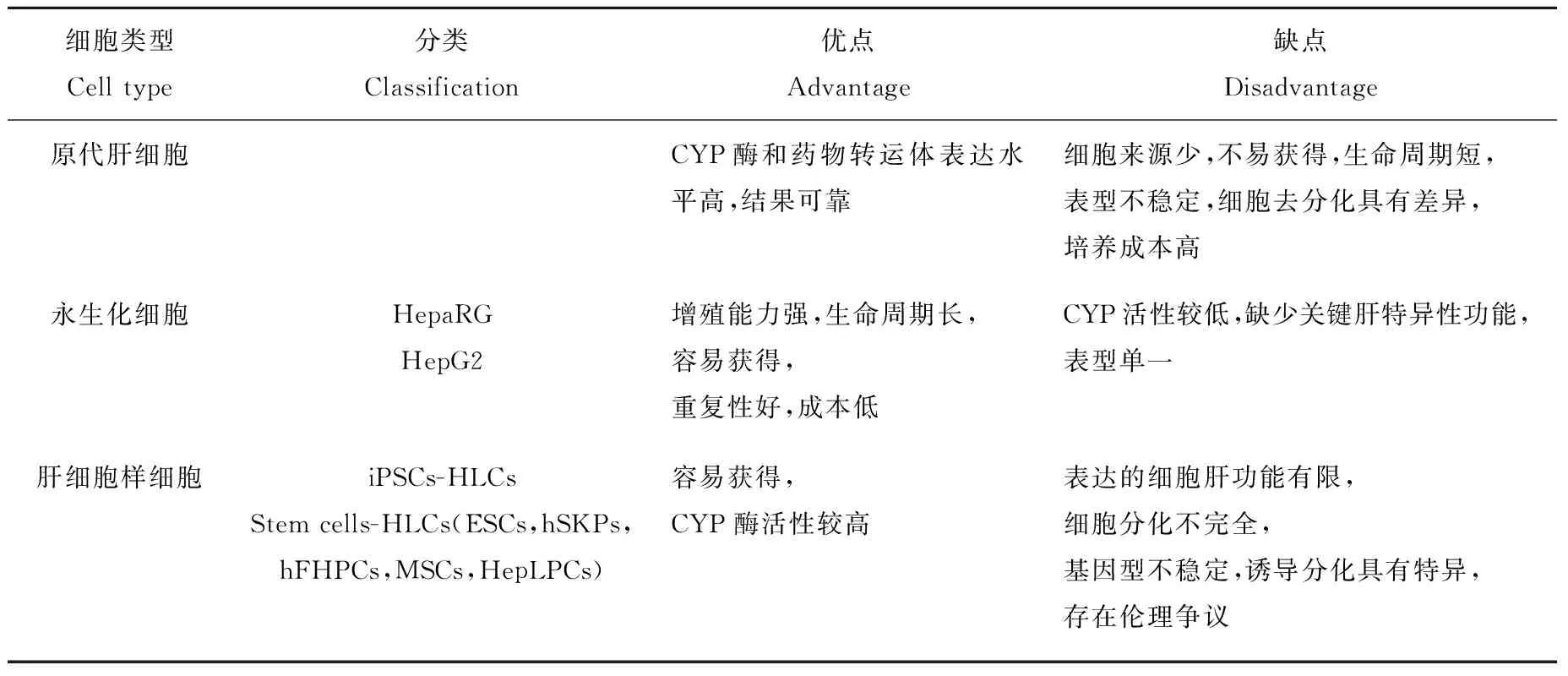
表1 肝毒性体外研究中常用肝细胞类型的比较[8]Table 1 Comparison of commonly used hepatocyte types in hepatotoxicity studies in vitro[8]
1.2 细胞模型的培养方式
与体内肝组织相比,二维(two dimension, 2D)培养的肝细胞缺乏细胞外基质、细胞间通讯和空间异质性,难以长期维持肝脏结构和功能,因此2D细胞培养模型的稳定性差,不适用于药物长期毒性测试[16]。三维(three dimension, 3D)细胞模型具有与体内肝组织类似的细胞外基质与细胞间相互作用,可以改善细胞表型的相关性,并延长现有模型的生存能力,所获得的3D结构能够模拟药物在体内的渗透过程,在药物肝毒性评价中更具准确性。
一些新颖的培养方法可以构建更具异质性微环境的3D细胞模型,例如肝细胞球、肝芯片等[17]。肝细胞球模型分为基于支架的培养模型和非支架的培养模型,示于图1。常见的基于支架的3D细胞球模型有水凝胶嵌入式培养、3D打印[18]等。非支架技术是将悬浮细胞在非粘附性基质上培养,促使细胞聚集,也可将细胞在悬浮液中短暂离心形成球体,主要有静态液体覆盖技术及悬滴法[18]。在早期研究中,通常利用琼脂糖在96孔板中凝固时形成的凹形表面培养细胞球[19],目前高速发展的3D打印技术可以更精准地构建均一可控的琼脂糖凹形微孔阵列模型[20],并已开发出广泛适用的超低吸附板和细胞悬滴板等商用产品[21]。3D肝细胞球模型可以促使细胞表达成熟肝细胞标志物,因此更具药物敏感性。器官芯片也是一种体外3D细胞模型,通过微芯片制造方法创建微流控细胞模型,包含连续灌注的小室,以模拟组织和器官的生理环境。该技术能够实现不同类型的细胞以空间相关的方式共培养,模拟体内细胞的微环境[22]。基于微流控技术构建的肝芯片的肝脏特异性生理功能更强,可以用于评价多种肝毒性表型,包括肝细胞损伤、脂肪变性、胆汁淤积和肝纤维化等。与肝细胞球的对比研究表明,肝芯片的毒性反应与肝细胞球相似[23],两者结合可以更好地模拟体内肝组织。
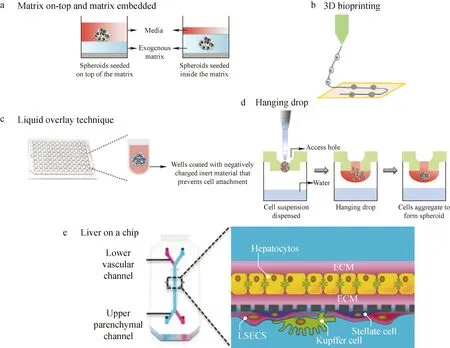
注:a.水凝胶嵌入式培养;b.3D生物打印技术;c.静态液体覆盖技术;d.悬滴法;e.器官芯片培养图1 3D细胞模型培养方式[22-23]Fig.1 3D cell model culture methods[22-23]
2 基于质谱技术的细胞代谢组学分析方法
2.1 基于液相色谱-质谱联用技术的细胞代谢组学研究
细胞代谢组学LC-MS分析流程主要包括:细胞培养、样本收集与制备、质谱数据采集、数据处理[9-10],示于图2。
2.1.1样品制备 与血浆、尿液和组织等生物样本的代谢组学研究相比,细胞样本的前处理过程相对复杂,涉及到细胞收集、代谢淬灭、细胞破碎和代谢物提取等多个步骤[24-25]。建立合理有效的细胞样本前处理方法,确保细胞内代谢物的真实性和稳定性,是利用细胞代谢组学研究生理生化机制的重要前提。本课题组[26]前期利用LC-MS技术对细胞代谢组学样品前处理过程的关键步骤进行了系统考察和优化,最终确定细胞代谢组研究的最佳样本前处理方法为PBS清洗细胞样本2次后,采用-40 ℃,60%甲醇(含0.85%(w/V)NH4HCO3)在5 min内完成细胞代谢淬灭,然后采用80%甲醇通过3个液氮冻融循环提取细胞代谢物。此外,发现不同批次收集和长时间的液氮冻存均会对胞内代谢物产生较大影响,因此在细胞代谢组学研究中应尽量对新鲜制备的同一培养条件下、同批次的细胞样本开展代谢组学研究。

注:a.细胞培养;b.分析样本制备;c.基于质谱的代谢谱采集;d.数据处理图2 细胞代谢组学工作流程Fig.2 Workflow of cell metabolomics
2.1.2分析技术与方法 代谢组学样品分析中最常用的是色谱与质谱技术。气相色谱和液相色谱是生物样本代谢物分离常用的色谱系统。与液相色谱相比,气相色谱在一定程度上可以降低基质效应和共洗脱化合物的离子抑制,在色谱分离的分辨率和重复性方面具有优势[27],适合低分子质量挥发性化合物的分析,对于极性、非挥发性化合物则需要溶剂萃取、干燥、衍生化等多步制备样品[28]。相比之下,液相色谱技术对极性代谢物具有更好的相容性,使其成为代谢组学首选的分离工具[29]。通常LC-MS可以通过选择2个互补柱:反相柱和亲水作用色谱柱来分析小极性和极性代谢物[30-31]。为了解决单一的分离技术不能检测所有内源性代谢物的难题,二维液相色谱利用2种不同分离机制的色谱模式或使用相同模式下具有一定正交性的不同色谱柱进行样品分离[32],可以提高单次样本分析的分辨率和代谢物的覆盖范围。
此外,有报道采用无需分离的质谱技术进行代谢组学研究。直接注入质谱(direct inject mass spectrometry, DIMS)能够灵敏、高通量地采集代谢指纹图谱,其优点是数据采集速度快,但会存在严重的离子抑制效应,且难以区分同分异构体。纳升电喷雾可以降低离子抑制效应,提高DIMS离子的电离效率,结合高分辨质谱,能够满足高通量、少量样本的代谢组分析。除了纳升电喷雾源外,利用四极杆将扫描区间分割成连续质荷比(m/z)间隔,并依据m/z信号的分布将扫描间隔进行优化的采集策略[33],能够显著降低质谱的离子过载,有助于进一步提高代谢组的分析通量。
2.1.3数据采集 细胞代谢组学数据采集包括靶向和非靶向分析。非靶向代谢组学是对样品中所有可测量代谢物的综合分析,有利于发现新的生物标志物,但是数据处理与代谢物鉴定的工作量大;靶向代谢组学则侧重于测定已知的代谢物组[34]。除以上2种数据采集方法外,中国科学院大连化物所许国旺研究员课题组提出了一种将非靶向与靶向分析方法相结合的拟靶向代谢组学分析策略[35],其通过非靶向分析的高通量、无偏向代谢物信息的获取、特征离子对的挑选和靶向方法的高特异性检测和准确定量[36],实现对待测样本中已知及未知代谢物的同时靶向检测[37],具有更好的重复性和更宽的线性范围,且不需要复杂的峰对齐等数据处理过程。
2.1.4数据处理与分析 代谢组学分析会产生大量的数据,首先需要进行噪声过滤、峰提取、峰解卷积和保留时间对齐等,将原始数据转换成1个包括每个样本检测到的离子及其对应的峰面积或强度的矩阵[12]。然后将数据进行多元统计分析,根据其代谢谱实现样本聚类。同时,采用一些新的算法和统计方法进一步优化模型,包括机器学习,如随机森林、支持向量机(support vector machine, SVM)和自组织映射(self-organization map, SOM)等[38],最终获得对分组贡献较大的差异变量。计算机模型作为临床前和临床研究的补充,也可进一步用于评估风险,了解单个机制对毒性的贡献,在预测DILI风险方面具有较好的准确性[39]。此外,代谢物结构鉴定非常关键,通常需要根据MS/MS谱数据,结合数据库检索(如HMDB、METLIN等)分析推断可能的结构,并与标准品的保留时间、MS谱和MS/MS谱进行比对分析与确认。此外,许多软件(如Met Frag、MS Finder等)可以基于理论裂解规律对代谢物进行分析,中科院上海有机化学研究所朱正江研究员课题组[40]开发的MetDNA分析策略可根据已知代谢物对可能发生生物转化的代谢物进行进一步注释,实现了更多代谢物的鉴定。
2.2 基于质谱成像技术体外细胞模型的研究
基于质谱成像技术的空间分辨代谢组学可以保留代谢物在异质性生物组织中的空间位置信息,将代谢信息扩展至二维乃至三维水平,以探究复杂的生物代谢。目前,最常用的质谱成像技术主要包括:二次离子质谱(secondary ion mass spectrometry, SIMS)、基质辅助激光解吸电离质谱(matrix-assisted laser desorption ionization, MALDI)和解吸电喷雾电离质谱(desorption electrospray ionization, DESI)等。
SIMS能够提供亚微米甚至纳米级的空间分辨率,可以进行单细胞乃至亚细胞水平的质谱研究[41]。Meliss等[42]采用SIMS技术实现了在单个细胞中胺碘酮及其代谢产物的3D可视化,但采用高能离子束轰击样本会产生大量碎片离子,因此利用SIMS难以对内源性代谢物进行准确鉴定,且对于分子质量大于1 000 u的化合物检测灵敏度较低[43]。
MALDI-MSI的分辨率一般在50~100 μm之间,最高可达几微米,能够实现较宽质量范围的分析。MALDI在小体积生物组织样本的质谱成像分析中具有明显优势,能够对直径仅约1 μm的多细胞肿瘤球(multicellular tumor spheroid, MCTS)中哌立福新和西妥昔单抗等药物的渗透及代谢过程进行表征[44-45]。此外,MALDI-MSI结合免疫荧光技术可以精准识别MCTS的乏氧、增殖和坏死等微区结构,有助于研究MCTS由药物引起的空间代谢变化,准确评估药物的毒性效应、发现潜在的毒性机制,示于图3。香港浸会大学蔡宗苇教授课题组[46]建立了适合MCTS质谱成像的冰冻切片制备方法,并利用MALDI-MSI考察了双酚S(bisphenol S, BPS)暴露后,结肠癌MCTS中代谢组的变化,发现ATP等能量相关的代谢物在细胞球外周区发生显著上调,推测BPS可能通过升高能量代谢水平诱导肿瘤细胞的增殖反应[47]。本课题组[48]采用MALDI-MSI方法绘制了食管癌MCTS的代谢特征,对食管癌肿瘤球体内不同增殖微区内源代谢物的异质性空间特征进行表征,并研究代谢物随培养时间的空间动态变化。然而,MALDI-MSI低质量区的信号容易受所选基质和溶剂的影响,此外,基质的喷涂可能会引起分子空间位移。
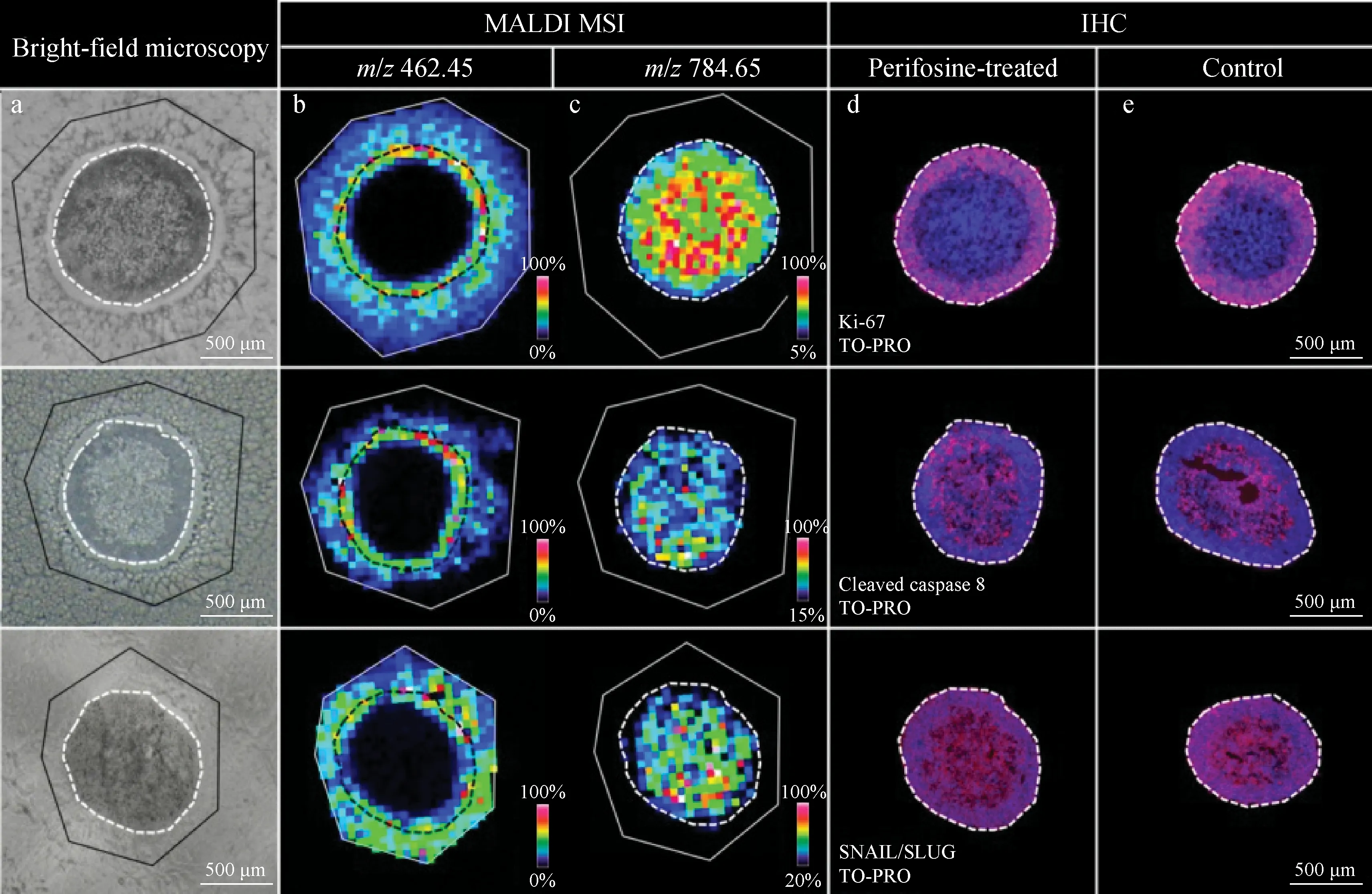
图3 MALDI-MSI技术结合荧光免疫组化表征MCTS中哌立福新的渗透与空间代谢改变[44]Fig.3 MALDI-MSI technology combined with fluorescence immunohistochemistry to characterize the penetration of perifosine and the spatial metabolic changes of MCTS[44]
DESI-MSI是一种敞开式质谱成像技术,操作方便,且样本分析过程不依赖喷涂基质,对低质量区物质的检测灵敏度高、代谢物覆盖范围宽。Lucy等[49]利用DESI-MSI技术可视化多种内源性分子的空间分布,表征肿瘤异质性区域和缺氧微环境,确定了MCTS的核心坏死区与外周增殖区,但DESI-MSI的空间分辨率在100 μm左右,使其在表征体外3D细胞球的微区代谢差异上存在一定的局限。
上述研究结果表明,质谱成像技术与3D细胞模型相结合,可以在体外对药物渗透、代谢等动力学过程进行原位表征。通过对与细胞活性密切相关的代谢物进行质谱成像分析,可以直观地呈现药物作用后细胞球的活性变化,实现药物毒性评价的可视化。将药物的空间分布与空间分辨代谢组的改变进行匹配,可以更精准地发现药物相关的作用靶点及潜在的毒性机制。此外,通过分析不同毒性机制药物引起的细胞代谢表型,结合机器学习等算法构建模型,将有望对未知药物的毒性进行评价与机制预测。质谱成像结合3D肝细胞培养模型为体外药物肝毒性评价提供了一种新策略。
3 体外药物肝毒性评价研究进展
肝毒性作为药物毒理学研究的重要内容,是国内外许多学者研究的焦点,我国学者在体外药物肝毒性评价方面做了许多重要工作。例如,解放军总医院第五医学中心肖小河与王伽伯研究员团队[50]基于体外3D HepG2细胞模型,准确地预测了何首乌易感物质顺式与反式二苯乙烯苷的肝毒性。中国食品药品检定研究院马双成研究员课题组[51]利用3D肝细胞模型结合彗星实验评价了大黄单蒽酮的体外肝毒性。苏州大学张乐帅教授团队[18]对3D细胞模型构建方法进行创新,设计了基于模具与倒模技术的琼脂糖压印方法,能够在单孔内获得大量的微组织,足以进行qPCR,Western Blot等研究,显著降低了培养成本。此外,沈阳药科大学陈晓辉教授团队[52]通过将细胞代谢组学与血清药理学相结合,确定了与芫花密切相关的9种显著改变的差异代谢物与信号分子,揭示了芫花肝毒性的可能机制。具体来讲,细胞代谢组学技术在体外肝毒性的研究主要包括以下两方面内容。
3.1 研究肝毒性药物的生物活化过程
常见的具有肝毒性药物主要包括非甾体抗炎药(NSAID)、抗感染药(包括抗结核药)、抗癌药、中枢神经系统药、心血管系统药、用于代谢紊乱药物、激素药物及中药[53]。通常认为,药物在肝脏经过生物转化生成反应性代谢产物,其可能会通过多种途径引起细胞应激。例如,细胞防御系统的消耗,以及与酶、脂质、核酸和其他细胞结构的结合,或直接抑制线粒体呼吸链,导致腺苷三磷酸(adenosime-triphosphate, ATP)耗竭、活性氧产生增加等,被认为是导致肝毒的机制之一。因此,了解药物的生物活化过程可以准确地将化学与生物学相联系,为了解药物的肝毒性分子机制提供物质基础。Kim等[54]采用非靶向代谢组学方法鉴定伊曲康唑(ITZ)在人肝细胞与微粒体中的代谢产物,共发现10种ITZ代谢产物,其中包括7种新的代谢产物,但并未发现ITZ及其代谢产物与谷胱甘肽等发生加合,从药物代谢角度证明了ITZ的安全性。Zhang等[55]使用非靶向高分辨质谱技术研究了HepG2细胞中PCB11代谢和相关的代谢组学变化,发现30种不同的PBC11代谢产物,其中邻苯二酚代谢物可能具有反应性和毒性。Sascha等[56]基于HepaRG细胞研究了α-PBP和α-PEP两种精神活性物的毒物代谢组学,结果显示,两种物质均与氨基酸加合生成亚胺,可能与其毒性机制密切相关。
3.2 揭示药物肝毒性机制与发现新的生物标志物
代谢组学可通过检测已知或未知的与肝毒性机制相关的代谢途径和代谢物,将代谢表型变化与毒性机制关联起来[7,57],有助于发现新的生物标志物,以改进DILI的诊断和治疗。近10年来,基于质谱技术的细胞代谢组学研究药物肝毒性情况列于表2。结果显示,药物诱导肝毒性的主要原因是由于药物或其活性代谢产物对细胞造成直接损害,此外药物及其代谢产物可能与蛋白质偶联形成半抗原,引起免疫反应导致细胞受损。药物肝毒性引起细胞代谢水平的变化主要包括脂质代谢紊乱、磷脂病变、氧化应激和胆汁积聚等。
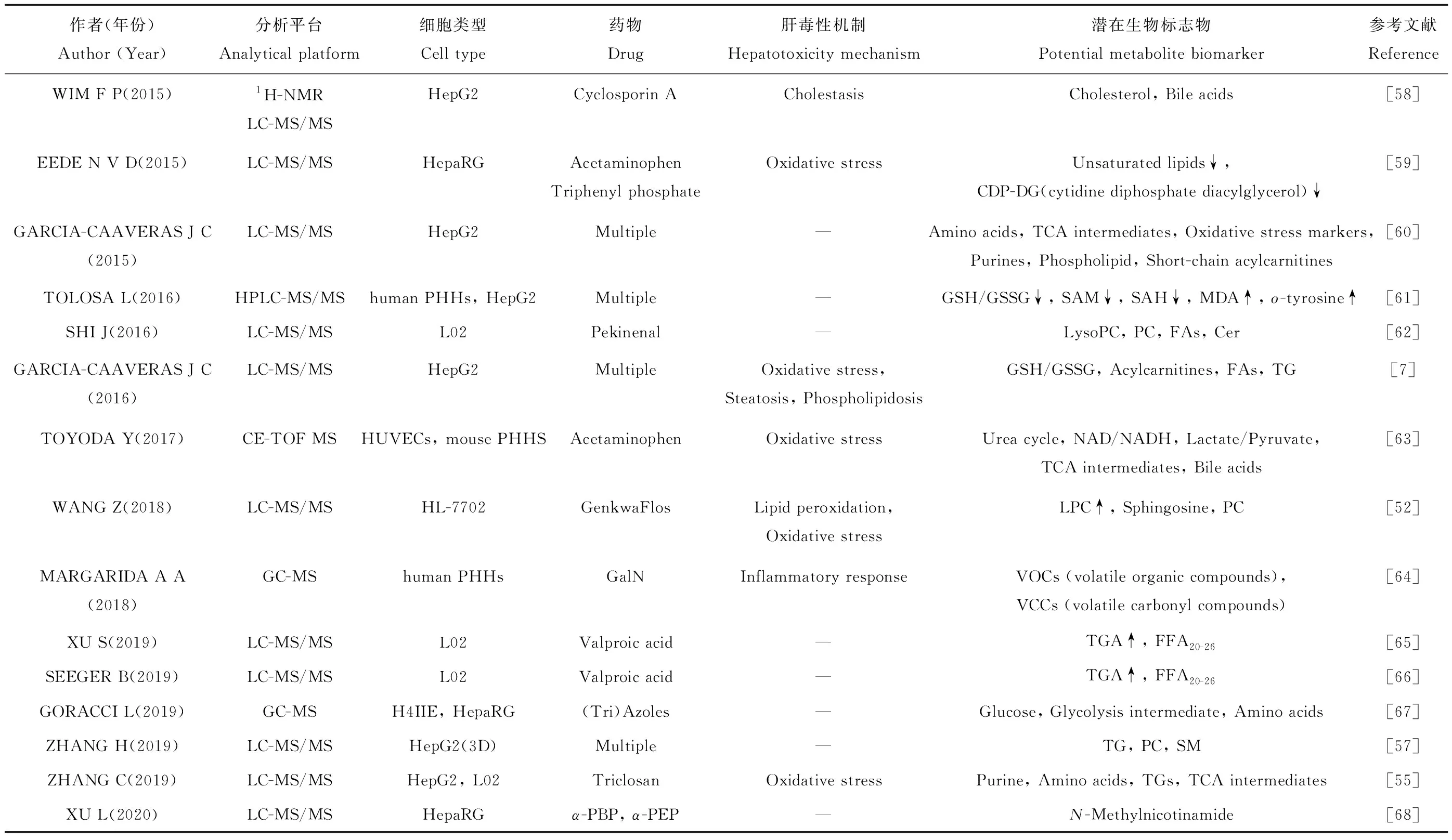
表2 细胞代谢组学在体外药物肝毒性评价中的应用研究Table 2 Application of cell metabolomics technology in the study of in vitro liver toxicity
3.2.1脂肪变性与磷脂病变 脂肪变性和磷脂病变是2种不同的肝脏毒性效应,其结果是不同类别的脂质在肝脏中过度积累。Garcia-Canaveras等[7]通过HepG2细胞脂质组学研究发现,脂肪病变型肝损伤引起的代谢变化主要是三酰基甘油酯(triglyceride, TG)、二酰基甘油酯(diacylglyceride, DG)、磷脂(phospholipid, PL)和溶血磷脂(lysophospholipid, LysoPL)水平升高,脂肪酸(fatty acid, FA)水平降低;磷脂病变药物主要引起PL、不饱和FA代谢紊乱。Garcia-Canaveras等[69]利用油酸和棕榈酸等游离脂肪酸(free fatty acid, FFA)培养的HepG2细胞研究药物诱导肝脂肪变性和磷脂病变性,由于棕榈酸和油酸可以加速脂质的积累,且参与不同的脂质代谢过程,从而能够更好地鉴别2种脂代谢紊乱。结果表明,磷脂病变的药物会显著增加磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰丝氨酸、磷脂酰肌醇的水平,而脂肪变性药物主要诱导FA氧化和TG合成途径代谢水平的改变,造成FFA、酰基肉碱、单酰基甘油、DG及TG的变化。大量研究表明,FA可通过增加氧化应激和激活炎症途径直接引起毒性[70],其在体内可以酯化生成TG并储存在脂滴中,因此,TG的积累可能是一种保护机制,防止脂肪酸特别是不饱和脂肪酸的毒性作用[71]。FA、PL等水平发生改变会进一步导致细胞活性氧产生,造成氧化应激。与脂肪变性与磷脂病变肝损伤相关的常用药物包括胺碘酮、丙戊酸、他莫昔芬、甲氨蝶呤,以及一些化疗药物和抗逆转录病毒药物。
3.2.2氧化应激 氧化应激是许多药物引起肝毒性的常见原因,其中还原型谷胱甘肽与氧化谷胱甘肽的比值(GSH/GSSG)是细胞内的主要氧化还原缓冲体系[72],该比值的变化与早期线粒体氧化损伤相关[73]。此外,与黄素腺嘌呤二核苷酸(flavin adenosine dinucleotide, FAD)、ATP、烟酰胺二核苷酸(nicotinamide adenine dinucleotide, NAD+)等氧化还原相关的代谢通常与三羧酸(tricarboxylic acid, TCA)循环、嘌呤代谢途径偶联,也常表现对外源刺激的刺激敏感性。普遍认为,对乙酰氨基酚(APAP)在高剂量暴露下产生肝毒性代谢产物N-乙酰-苯醌亚胺(NAPQI),其会消耗细胞中的GSH,造成细胞氧化还原状态失衡,导致细胞的氧化应激。Zhang等[60]通过整合代谢组学与脂质组学分析了三氯生给肝细胞带来的代谢扰动,结果表明,在正常肝细胞中,三氯生会诱导嘌呤代谢和氨基酸代谢上调,脂质蓄积,并增加活性氧(ROS)的产生,造成细胞氧化应激。Garcia-Canaveras等[7]研究显示,氧化应激型肝毒性药物会导致HepG2细胞的谷氨酸、谷胱甘肽、氮、谷氨酰胺等代谢途径发生改变,此外,包括FA、TG和PL代谢在内的脂质稳态也发生了改变。但是,细胞的氧化应激状态在其他几乎所有药物暴露或者应激过程中都会观察到,不是肝毒性的特异性生物标志物。
3.2.3胆汁积聚 胆汁酸(bile acids, BAs)在肝脏中由胆固醇合成,通过胆盐输出泵(bile salt export pump, BSEP)转运至细胞外。BSEP是主要的胆小管外排的转运体,药物介导的BSEP抑制可能是导致药物胆汁淤积型肝损伤的机制之一[74]。BAs对细胞膜的溶解和破坏作用曾被认为是BAs介导的细胞毒性的主要机制[75]。有研究结果表明,细胞中的BAs含量不能造成显著的膜溶解作用,而其毒性机制可能是由于BAs增加了胞质的游离钙,引起线粒体损伤,或通过控制炎症因子的释放、中性粒细胞募集等炎症反应导致肝细胞凋亡[76]。胆汁淤积型药物肝损伤在体内通常表现为肝脏和血清胆汁酸升高。Sharanek等[77]首次证明了一种胆汁淤积药物可以诱导人HepaRG肝细胞内BAs的积累,但是这种效应是短暂的,由于体外胆汁淤积研究复杂,细胞可能仍然可以通过它们的基底外侧转运体排出积聚的胞内BAs,因此体外代谢组学结果常显示胆汁酸水平降低[78]。能够影响BSEP活性的药物可能会造成胆汁淤积型的肝损伤,包括环孢素A、利福平、奈法唑酮、格列本脲、曲格列酮和波生坦[79]等。
4 总结与展望
利用人源细胞开展药物体外肝毒性评价具有许多优点,如实验可控性高、周期短、重复性高、可以减少动物的使用数量、饲养和护理成本等。肝细胞的选择和培养方式在药物体外肝毒性评价中非常关键,3D细胞培养模型显著改善了细胞模型的性能,可以更好地维持肝脏的特异功能,提高预测毒副反应的准确性。单一细胞模型难以完全概括体内肝细胞的形态、表型和功能,因此开发可靠、快速、高通量的细胞毒性评价模型仍然十分重要。
基于质谱的细胞代谢组学技术与多种生物学分析技术相互补充,已成为一种新型的发现毒理学评价生物标志物与毒性机制的有效手段。目前的分析技术仍然存在许多挑战,如单次分析代谢物的覆盖度需要进一步提高,代谢物鉴定与定量分析的难度大,以及样本检测的通量低等。二维液相色谱分离技术在改善单次分析过程中代谢物分辨率及覆盖度方面具有优势,结合拟靶向分析策略可进一步提高代谢物的检测灵敏度与分析效率。纳升电喷雾技术与基于扫描范围拆分采集模式的流动注射质谱降低了代谢组学分析的样品用量及分析时间,有利于代谢组学的高通量分析。基于代谢反应网络对代谢物进行注释的MetDNA算法,可以改善标准品二级谱图库不足的问题,提高未知代谢物的注释效率。此外,随着质谱成像技术的兴起,可以在空间水平上直观地反映药物渗透、代谢等药物代谢动力学信息,实现细胞代谢组的时空变化分析,将药物、药物代谢产物分布与细胞代谢水平同时定位和可视化,有助于更好地理解药物毒性及其作用模式。
将细胞代谢组学发现的药物肝毒性生物标志物应用于临床用药安全性评价的有效性仍需要深入验证。代谢组学与计算机模型相结合的风险评估策略有助于对所获得的代谢信息进行有效的挖掘和应用,将药物与毒性相关的代谢改变相关联,从而实现药物肝毒性的风险预测。将细胞模型结合代谢组学技术进行肝毒性评价,能够改善临床前药物肝毒性的预测,在化学药与中药肝毒性研究中已显现出潜在应用价值,基于3D细胞模型开发的具有体内微环境的肝毒性评价系统,有望为生物制品的药物毒理学研究提供新的思路和方法。
