贵州某废弃煤矿酸性废水处理系统中细菌群落结构及功能分析
2021-09-24张瑞雪张世鸿张亚辉
王 能, 张瑞雪,2*, 吴 攀,2, 张世鸿, 张亚辉
1.贵州大学资源与环境工程学院, 贵州 贵阳 550025 2.喀斯特地质资源与环境教育部重点实验室, 贵州 贵阳 550025
煤炭资源开采产生的大量煤矸石和围岩等暴露在空气和水中,经过复杂的化学与生物氧化过程,极易形成低pH、高硫酸盐以及Fe、Mn等重金属的酸性矿山废水[1]. 酸性矿山废水任意排放会对周围环境和生态系统造成长期损害,其含有的有害金属离子可在动植物体内富集,进而通过食物链威胁人体健康[2-3].
酸性矿山废水是一个全球性环境污染问题[4]. 贵州煤炭资源丰富,且煤中含硫较高,酸性煤矿排水对区域水环境的污染问题日益突出[5-6]. 笔者所在课题组根据贵州废弃煤矿分布特征和废水排放特点,因地制宜地开发了系列以碳酸盐岩为主要反应介质被动处理煤矿酸性废水的技术方法,并在多地开展工程示范及应用,且处理效果显著[7-8]. 碳酸盐岩作为煤矿酸性废水治理的反应介质,不仅对废水中pH提升及Fe去除有很好效果[9],同时反应体系中形成的铁氧化物沉积物对废水中其他金属离子有很好的吸附共沉淀作用[10]. 当前对碳酸盐岩作为反应介质处理酸性煤矿废水主要关注于反应过程中的物理化学作用[8-12],而在酸性矿山废水环境(水、沉积物和生物膜等[13])中还存在丰富的嗜酸性铁、硫氧化以及异养的细菌和古菌[14],此类微生物存在会对沉积物-水界面的各种污染物去除和迁移转化等发挥重要作用[15]. 如在酸性矿山废水环境中生存的嗜酸性氧化亚铁硫杆菌(A.ferrooxidans)能有效促进酸性硫酸盐体系中Fe2+向Fe3+转化,同时Fe3+水解生成施氏矿物、黄铁矾等次生矿物,而此类矿物的生物相容性好,且能与金属元素发生吸附或者共沉淀作用[16-17].
近年来,利用16S rRNA高通量测序和基因组学方法对酸性矿山废水环境中微生物群落的不断研究促进了人们对酸性环境中微生物多样性、群落功能和进化的深入了解[18]. 该研究以贵州某废弃煤矿酸性废水处理系统(碳酸盐岩为主要反应介质)为例,采用高通量测序MiSeq技术,分析反应系统中细菌群落结构的沿程变化特征,并根据细菌群落组成分析其主要功能作用,以期为酸性矿山废水的生物强化处理技术与理念方法提供基础理论支撑.
1 材料与方法
1.1 处理系统概况及样品采集
贵州某废弃煤矿酸性废水处理系统于2017年8月建成运行,反应系统中填充的碳酸盐岩为较纯的方解石. 处理系统共设有6组平行,每组由多级复氧反应池和垂直流人工湿地构成,其中多级复氧反应池分5级,第1级为可渗透反应墙,其余4级分别由反应池和沉淀池组成;沉淀池中添加立体弹性填料,人工湿地中种植梭鱼草、黄菖蒲和金丝草等植物,工艺流程见图1. 该处理系统总占地面积 2 160 m2,设计处理能力500 m3/d(枯水期约300 m3/d,丰水期约500 m3/d),进水水力负荷0.32~0.52 m3/(m2·d). 由于该处理系统进水自废弃煤矿硐口地下涌水,其特征污染指标主要为pH以及Fe、Mn和其他重金属,且运行前期对系统监测结果表明,进水COD (10 mg/L)、TN (0.2 mg/L)和TP (0.1 mg/L)等污染物浓度较低,故该研究并未对其去除效果及机理进行探讨. 系统处理后出水中Fe、Mn浓度可达《生活饮用水水源水质标准》(CJ 3020—1993)的一级标准[8].
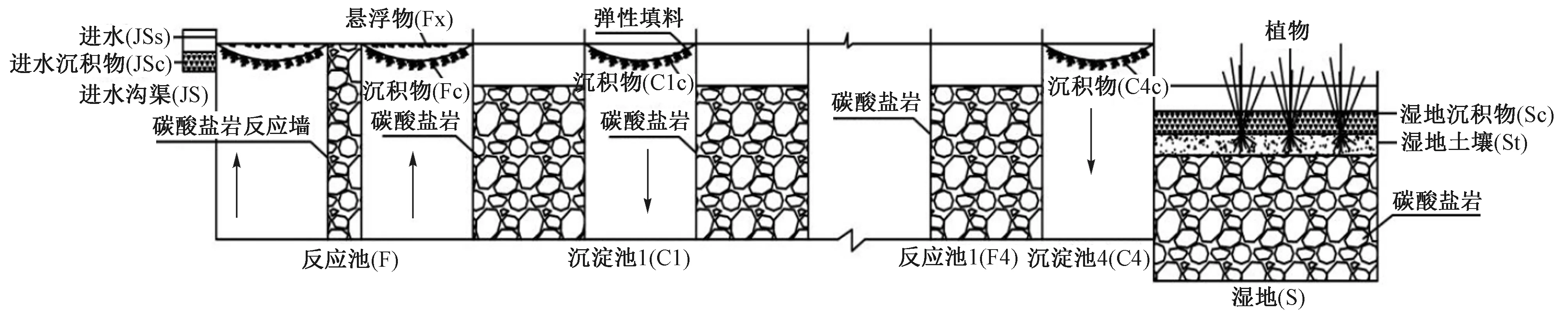
图1 贵州某废弃煤矿酸性废水处理系统工艺流程Fig.1 Process flow of acid wastewater treatment system of an abandoned coal mine in Guizhou Province
样品采集于2019年10月,共采集8个样品测定细菌群落结构,即进水沉积物(JSc)、进水水(JSs)、反应池沉积物(Fc)、反应池悬浮物(Fx)、沉淀池1沉积物(C1c)和沉淀池4沉积物(C4c)、湿地沉积物(Sc)和湿地植物根际土壤(St). 反应池与沉淀池的沉积物采自弹性填料,湿地系统主要以碳酸盐岩为反应介质,在碳酸盐岩层上添加土壤种植植物,植物根际土壤中混有大量铁絮体沉积物,采样点布设见图1.
1.2 样品分析
利用便携式水质参数仪现场测定温度(T)、pH、DO浓度和ORP等,用于测定Fe2+的样品现场用0.45 μm滤膜过滤,添加缓冲溶液和邻菲啰啉显色剂现场显色. 用于其他理化指标测定的样品均过滤到聚乙烯瓶中,测定金属的样品加适量硝酸酸化(pH<2). 用0.22 μm (Millipore, 美国)无菌微孔滤膜过滤进水水样,用以收集水样微生物,将滤膜置于无菌离心管于干冰盒中低温(约-20 ℃)保存. 沉积物放入灭菌的自封袋中均匀混合后过滤掉水,取一定量的沉积物置于无菌离心管中置于冰盒中. 将样品带回实验室储存于-80 ℃冰箱,用于16S rRNA扩增测序分析. 取部分沉积物样品带回实验室冷冻干燥后消解测定金属含量. Fe和Mn含量用原子吸收测定(TAS-990, 北京普析通用仪器有限责任公司),SO42-含量用离子色谱仪(ICS-1100, 美国Dionex公司)测定,Fe2+含量用邻菲啰啉分光光度法测定,Cu、Pb、Zn、As和Cr含量用电感耦合等离子质谱仪测定(ICP-MS, 美国赛默飞公司).
1.3 DNA提取、PCR扩增及高通量测序
根据FastDNA® Spin Kit for Soil(MP Biomedicals, 美国)说明书进行总DNA抽提,使用1%的琼脂糖凝胶电泳检测DNA提取质量,使用NanoDrop2000(Thermo Fisher,美国)测定DNA浓度和纯度.
使用338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)对16r RNA基因V3~V4可变区进行PCR扩增,扩增程序:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃ 延伸30 s,27个循环;然后72 ℃稳定延伸10 min;最后4 ℃ 进行保存. PCR(ABI GeneAmp® 9700型PCR仪,美国)反应体系:5×TransStart FastPfu 缓冲液4 μL;2.5 mmol/L dNTPs 2 μL;上游引物(5 μmol/L)0.8 μL;下游引物(5 μmol/L)0.8 μL;TransStart FastPfu DNA聚合酶0.4 μL;模板DNA 10 ng;补足至20 μL. 每个样本3个重复. 将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, Union City, CA, 美国)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用QuantusTMFluorometer(Promega, 美国)对回收产物进行检测定量. 使用NEXTFLEX Rapid DNA-Seq Kit进行建库,利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司).
1.4 数据处理与分析
使用Trimmomatic软件对原始测序序列进行质控,使用FLASH软件进行拼接,过滤reads尾部质量值20以下的碱基. 设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,过滤质控后50 bp以下的reads,去除含N碱基的reads. 使用UPARSE软件(version 7.1),根据97%的相似度对序列进行OTU聚类并剔除嵌合体,利用RDP classifier对每条序列进行物种分类注释,比对SiIva132/sbacteria数据库,设置比对阈值为70%. 所有的统计分析都使用R包进行统计分析及数据可视化,基于样品最小序列数抽平后计算α-多样性指数和距离矩阵. 用Canoco 5.0软件对细菌群落物种信息进行冗余分析(RDA),并结合Pearson相关系数评价细菌群落与环境因子之间的关系.
2 结果与分析
2.1 反应系统水质特征
反应系统中各样品理化参数结果见表1,系统进水为弱酸性煤矿废水(pH为5.85),废水中典型污染物Fe(51.36 mg/L)经系统处理后去除率接近100%,同时对低浓度Mn、As、Pb、Cu和Cr等金属也有明显的去除效果. 经多级复氧反应池和人工湿地系统处理后废水的pH、DO浓度和Eh沿程升高,EC沿程降低. 系统中生成的大量铁絮体沉积物能富集多种金属元素,如Fe、Mn、As、Cd和Pb等,其中Fe含量最高,在反应池沉积物(Fc)中最高可达26.74%.
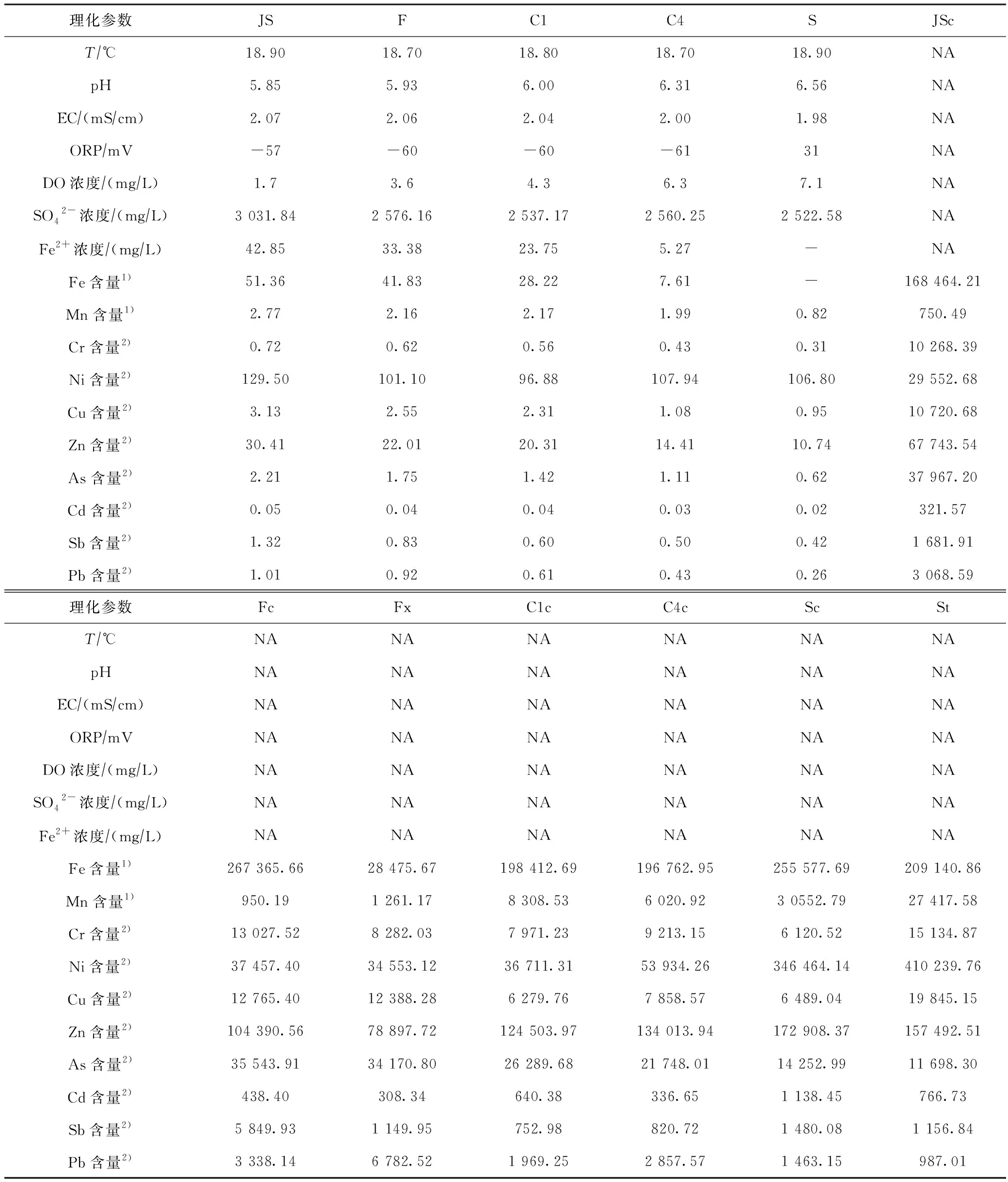
表1 反应系统中样品理化参数
2.2 反应系统中细菌群落Alpha多样性分析
通过Miseq PE300高通量测序平台对8个样品测序,优化序列信息后获得有效序列数 472 422 条,有效碱基数目 195 031 650 bp,序列平均长度412.84 bp,共获得 8 917 个OTUs. 对原始数据质控优化后,样品平均序列数、OTU数、覆盖度(Coverage)、细菌群落丰富度指数(Chao指数和ACE指数)和多样性指数(Shannon-Wiener指数和Simpson指数)见表2. 样品间OTU数存在差异,JSs样品中OTU数最高(1 561 个),Fx样品中OTU数最低(384个). 8个样品Coverage均在98%以上,表明该研究的测试深度足够. 样品间丰富度指数(Chao指数和ACE指数)和多样性指数(Shannon-Wiener指数和Simpson指数)存在差异,JSs样品中细菌群落丰富度指数和多样性指数高于JSc样品,Fc样品中细菌群落丰富度指数和多样性指数高于Fx样品,沉积物样品JSc、Fc多样性指数低于C1c、C4c、Sc样品,由此可见反应系统沉积物样品中细菌群落多样性随系统处理进程增加.
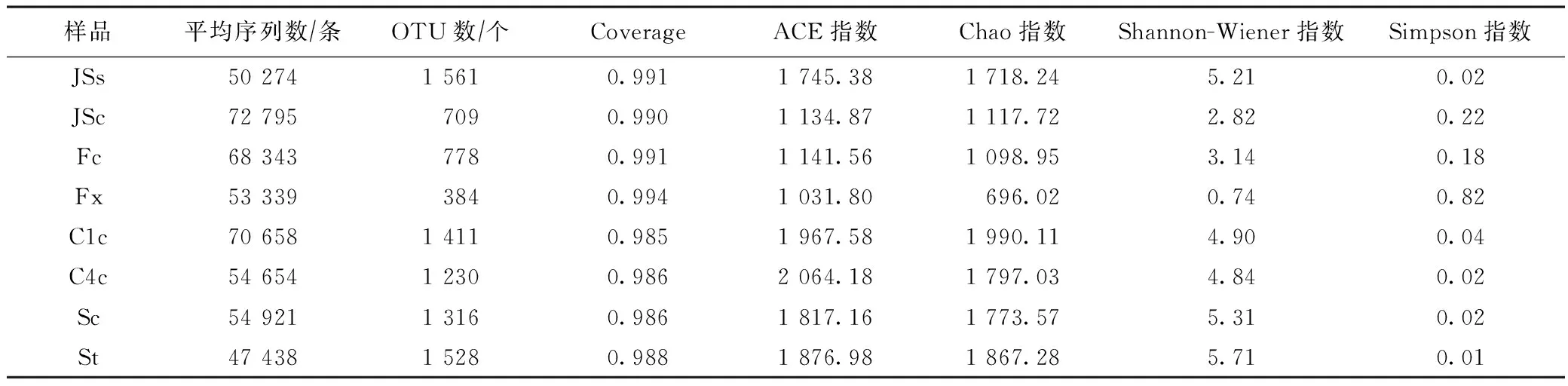
表2 细菌群落Alpha多样性分析结果
2.3 反应系统中细菌群落结构特征
8个样品共注释了24个门、234个属,将门水平丰度小于0.01%的细菌群落合并为其他(others)(见图2). 由图2可见,反应系统中变形菌门(Proteobacteria)和绿弯菌门(Chloroflexi)为主要优势菌门. 变形菌门在JSs、C1c、C4c、Sc和St样品中的丰度最高,为37.64%~69.18%;在JSc、Fc和Fx样品中的丰度次之,为6%~32.84%. 绿弯菌门在Fc样品中的丰度最高,为47.07%;在C1c、C4c、Sc和St样品中的丰度次之,为22.37%~33.87%;在JSc、JSs、Fx样品中的丰度较低,分别为11.62%、2.12%、1.91%. 蓝细菌门(Cyanobacteria)在Fx样品中的丰度最高,为90.95%;在JSc和Fc样品中的丰度次之,分别为53.00%和17.29%;在沉淀池和湿地样品中的丰度较小,为0.27%~9.87%. 硝化螺旋菌门(Nitrospirae)在Sc和St样品中的丰度较高,分别为12.98%和12.06%;在进水沉积物、反应池和沉淀池样品中的丰度很低,小于0.41%. 在反应池、沉淀池和湿地样品中还有丰度较低(<10%)的拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria)等.
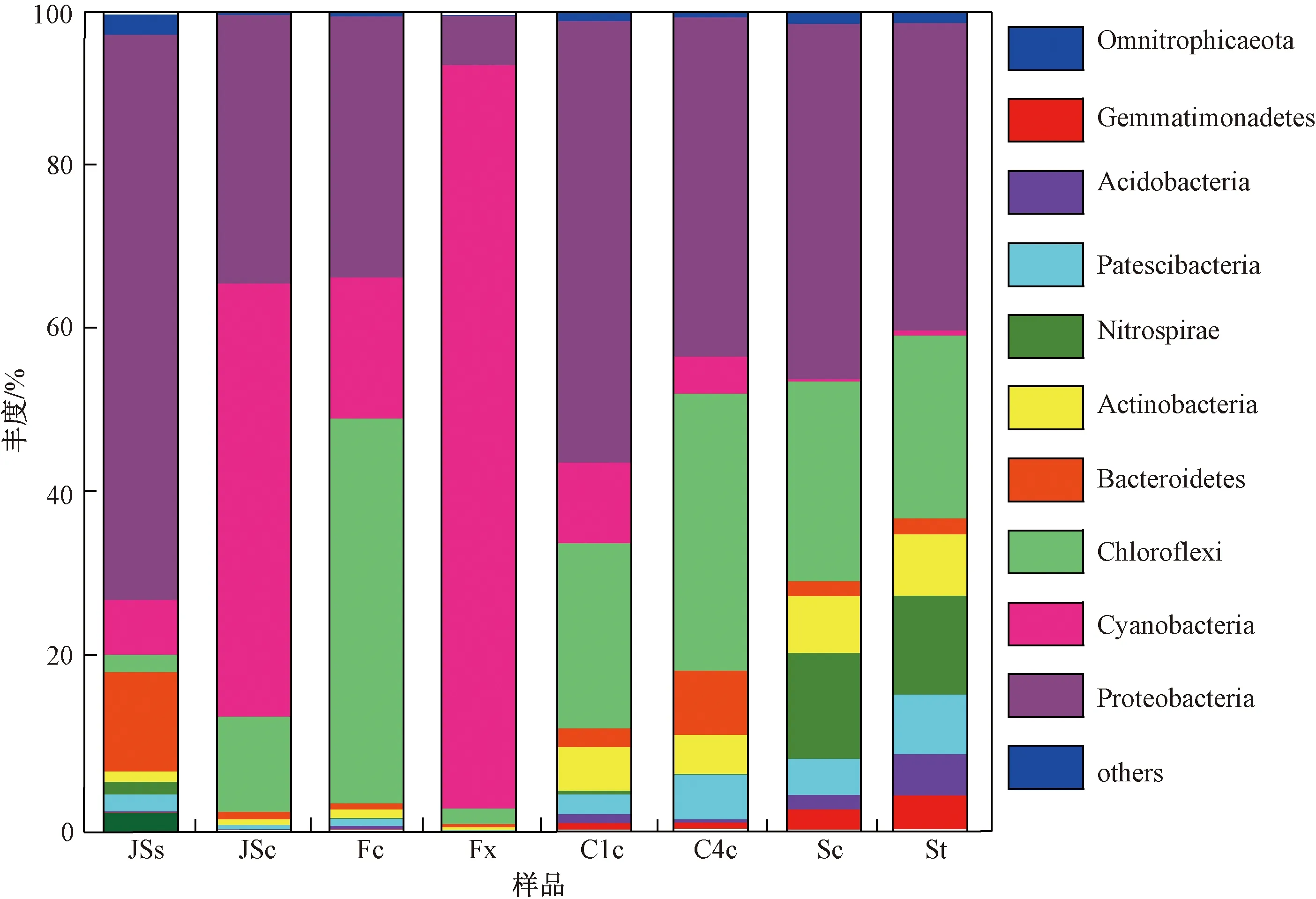
图2 反应系统中细菌群落在门水平上的丰度Fig.2 The abundance of bacterial communities in the reaction system at the phylum level
属水平上细菌群落的组成如图3所示. 由图3可见,属水平上反应系统中细菌群落组成在系统前端(反应池和进水沟渠)与后端(沉淀池和湿地)有显著差异,高丰度细菌类群主要归于变形菌门. 披毛菌属(Gallionella)、Sideroxydans和地杆菌属(Geobacter)在Fx样品中的丰度(0.20%~0.88%)较低,处理系统前端样品(JSs、JSc、Fc)的丰度明显高于后端样品(C1c、C4c、Sc、St),且在沉积物样品(JSc、Fc、C1c、C4c、Sc)中丰度随流程不断降低. 其中披毛菌属、Sideroxydans和地杆菌属在反应系统前端分别为3.78%~46.24%、4.51%~13.14%和6%~9.81%,后端分别为0~0.53%、0~0.94%和0.23%~3.01%. 红育菌属(Rhodoferax)在多级复氧反应池样品中的丰度(1.73%~24.91%)高于湿地系统(0~0.32%). 土微菌属(Pedomicrobium)在沉淀池和湿地系统样品中的丰度(2.23%~9.89%)明显高于进水和反应池样品(丰度接近0),硝化螺旋菌属(Nitrospira)在湿地系统样品中的丰度(14.29%~15.20%)较高,在进水和多级复氧反应池样品中的丰度(<0.5%)较低.
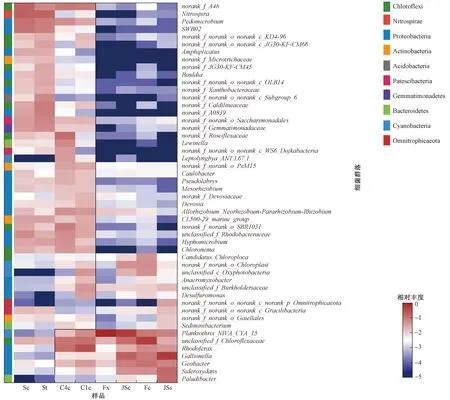
图3 属水平上反应系统中细菌群落相对丰度热图Fig.3 Heat map of the relative abundance of bacterial communities in the reaction system at the genus level
2.4 反应系统中细菌群落结构差异及其与金属元素之间的关系
Beta多样性分析主要通过计算各样品中的OUT丰度信息,评估各样品间细菌群落结构的差异. 基于Abund-Jaccard相似和Bray-Curtis相异距离矩阵的主成分分析(PcoA)结果表明,不考虑细菌群落组成丰度时〔见图4(a)〕,样本群落结构间存在差异;当考虑群落组成丰度时〔见图4(b)〕,沉淀池和湿地的细菌群落结构差异明显减小,说明沉淀池和湿地中的细菌群落结构差异受丰度的影响.
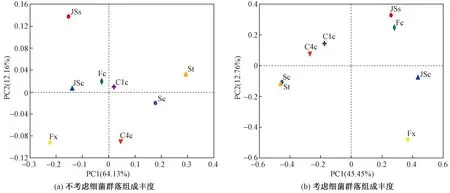
图4 基于Abund-Jaccard相似和Bray-Curtis相异距离矩阵的主成分分析Fig.4 Principal component analysis based on Abund-Jaccard similarity and Bray-Curtis dissimilarity distance matrix

注:Proteobc表示Proteobacteria (变形菌门);Actinobc表示Actinobacteria(放线菌门);Acidobac表示Acidobacteria(酸杆菌门);Bacteroi表示Bacteroidetes(拟杆菌门);Cyanobac表示Cyanobacteria(蓝细菌门);Chorofl表示Chlorofexi(绿弯菌门);Nitrospr表示Nitrospirae(硝化螺旋菌门);Fe表示Fe含量;Cr表示Cr含量;Cu表示Cu含量;As表示As含量;Pb表示Pb含量;Ni表示Ni含量. 图5 门水平细菌群落与金属元素含量的RDA分析Fig.5 RDA analysis of bacterial communities and metal elements at phylum level
利用Canoco 5.0 软件对门水平上反应系统中细菌群落丰度与金属元素进行冗余分析(RDA),结果如图5所示. 箭头长度表示理化参数对细菌群落结构影响强度,箭头越长说明相关性越大,箭头连线之间为锐角表示呈正相关,为钝角表示呈负相关. 反应系统中细菌群落结构受金属元素Fe、Ni、As和Pb的影响较大,变形菌门、绿弯菌门、放线菌门和酸杆菌门等与Fe和Ni含量均呈正相关,与As和Pb含量均呈负相关,其中与Fe含量呈显著正相关(P<0.05),与Pb含量呈显著负相关(P<0.05);蓝细菌门与Fe和Ni含量均呈负相关,与As和Pb含量均呈正相关,其中与Fe含量呈显著负相关(P<0.05),与Pb含量呈显著正相关(P<0.01)(见表3).
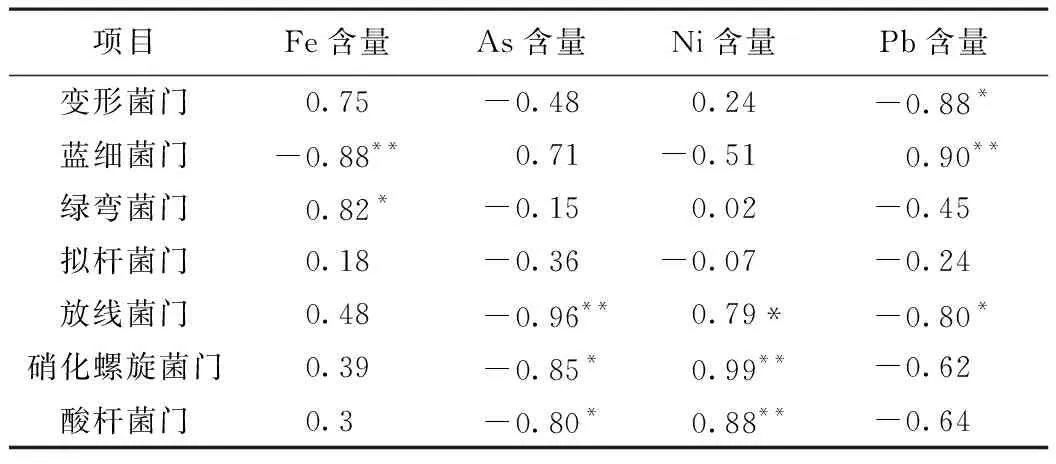
表3 细菌群落与金属元素间Pearson相关系数
3 讨论
3.1 煤矿废水处理系统中细菌群落组成分析
处理系统对酸性煤矿废水具有很好的处理效果,碳酸盐岩能有效提高酸性煤矿废水pH,而pH升高有利于Fe3+水解沉淀. 通过多级复氧使DO浓度从进水时的1.7 mg/L升至出水时的7.1 mg/L,DO浓度升高有利于Fe2+的氧化,因此该反应系统对Fe2+及TFe(总铁)均有很好的去除效果. 反应系统中添加立体弹性填料能有效地将铁絮体沉积物附着在其表面[8]. 随着系统中酸性废水pH和DO浓度的升高,以及金属离子被去除、EC降低和Eh升高,沉积物(JSc、Fc、C1c、C4c、Sc)样品中细菌α-多样性指数增加,如Shannon-Wiener指数从2.82增至5.31. 因此,酸性煤矿废水中细菌丰度和多样性受pH、DO浓度和金属元素含量等影响[3,19].
反应系统中变形菌门、绿弯菌门、拟杆菌门、放线菌门、硝化螺旋菌门和蓝细菌门等为优势菌门,其中变形菌门和绿弯菌门为主要优势菌门. 这些细菌群落在矿山水环境中多有报道[20-21],其中变形菌门在酸性矿山废水中为丰富物种[21-22],且表现出很强的适应性,同时也是铁硫循环细菌的主要细菌群落[23-24]. 绿弯菌门在沉积物和湿地土壤中的丰度较高,但在进水水样和反应池悬浮物中的丰度较低,其在沉积物中很常见,参与沉积物碳循环[25]. 拟杆菌门、酸杆菌门、放线菌门和硝化螺旋菌门在处理系统后端的丰度高于前端,其中拟杆菌门在酸性矿山排水中不常见,在环境酸度低的情况下偶有报道[14];酸杆菌门是一类化能异养嗜酸菌,在酸性生态系统中可降解植物残体多聚物、参与铁循环[20,26]. 蓝细菌门在立体弹性填料和悬浮物样品中为优势菌门,其中在反应池悬浮物样品中占90.95%. 蓝细菌对金属离子具有一定耐性,大多数蓝细菌可以通过产生细胞外物质(如多糖)来吸附金属离子[3],同时蓝细菌光合作用产生的氧气可以增强酸性废水环境中的氧化反应.
酸性矿山废水环境中金属离子对细菌群落结构有显著影响,当金属离子浓度超出细菌耐性值时,会导致细菌群落结构组成发生严重变化[20,22,27],如在低浓度As胁迫下会刺激对As敏感的微生物生长繁殖,但高浓度As会对微生物有明显的抑制作用,从而导致某些微生物死亡和多样性降低[28]. 在该反应系统铁絮体沉积物样品(JSc、Fc、Fx、C1c、C4c、Sc)中门水平上细菌群落丰度主要受金属元素Fe、As、Ni和Pb含量的影响较大.
3.2 煤矿废水处理系统中细菌群落功能分析
由于该处理系统的进水呈弱酸性,Fe2+浓度相对较低(42.85 mg/L),不适宜典型嗜酸性铁氧细菌(Acidithiobacillus)生存[25],但是在系统中发现了适宜于低酸度环境的铁氧化细菌披毛菌属[29]和Sideroxydans[25]等,两种细菌的丰度在处理系统前端和后端存在显著差异,且随着处理进程在沉积物中逐渐降低. 披毛菌属[24,30]和Sideroxydans在微氧条件下具备氧化Fe2+的能力,其中Sideroxydans可以在DO摩尔浓度小于50 μmol/L情况下,将Fe2+有效氧化成Fe3+[31]. 由于在多级复氧反应池中87.7%的Fe2+被氧化,导致进入湿地系统中Fe2+浓度极低,因此在湿地系统中低浓度Fe不足以维持化能自养细菌的大量生长.
地杆菌属和红育菌属主要存在于多级复氧反应池样品中,而湿地样品中的丰度较低(<0.47%). 地杆菌属[32]和红育菌属[22]在酸性矿山废水环境中能将Fe3+还原成Fe2+,其中地杆菌属在Fe3+丰富且可供细菌利用时成为Fe3+还原的主力军[33],在酸性矿山环境中低浓度DO和高浓度Fe3+有利于铁还原细菌对Fe3+的还原[34-35]. 随着反应系统DO浓度不断提升,且进入湿地系统中Fe浓度较低,故铁还原细菌在湿地中不宜生存,但在反应系统中存在较低丰度(<1%)的铁氧化细菌Rhodobacter、Sediminibacterium与铁还原细菌Anaeromyxobacter、Desulfuromonas等[24]. 其中Desulfuromonas是典型的SRB(sulfate-reducing bacteria)菌,不仅可以还原硫酸盐,还可以利用Fe3+和Mn4+作为电子受体,使其还原为Fe2+和Mn2+[36].
煤矿废水经多级复氧反应池处理后进入垂直流人工湿地,人工湿地中植物可通过吸收和吸附等作用去除废水中的金属离子,如菖蒲对废水中Mn具有很好的生物富集能力[37]. 湿地沉积物和植物根际土壤中Mn的含量(2.9%±0.16%)明显高于多级复氧反应池沉积物样品中Mn的含量(0.08%~0.83%),说明在湿地系统中更有利于锰氧化物生成. 湿地系统沉积物和植物根际土壤中铁和锰氧化物累积微生物土微菌属和硝化螺旋菌属,其丰度明显高于多级复氧反应池样品. 土微菌属可黏附在湿地系统中植物或者池壁等的表面,形成生物膜吸附铁锰氧化物[38]. 硝化螺旋菌属在湿地系统中不仅具有硝化功能,同时还能产生硫化物醌还原酶,将硫化物氧化为单质硫[39]. 此外,从图3中还可看出,反应系统中有很多未归类和未培养的细菌群落丰度在沉淀池和湿地中高于进水和反应池,这些细菌的生理代谢和环境功能仍需依赖菌株分离培养来进一步验证[14].
4 结论
a) 该煤矿酸性废水中Fe主要在多级复氧反应池中去除,Mn主要在湿地系统中去除. 沉积物中富集了大量Fe、Mn、Ni、As和Pb等金属,其中Fe含量高达26.74%,在湿地系统沉积物和植物根际土壤中Mn的含量(2.9%±0.16%)明显高于多级复氧反应池沉积物中Mn的含量(0.08%~0.83%).
b) 反应系统中的主要优势菌门为变形菌门(Proteobacteria)和绿弯菌门(Chloroflexi),蓝细菌门(Cyanobacteria)为反应池悬浮物中的主要优势菌门,丰度为90.95%. 沉积物中的细菌群落结构受金属元素Fe、Ni、As和Pb含量影响较大,随反应系统的处理程度,沉积物中细菌α-多样性指数增加.
c) Beta分析表明,细菌群落丰度在系统前端(进水沟渠和反应池)和后端(沉淀池和湿地)存在差异. 系统沉积物中铁氧化细菌〔披毛菌属(Gallionella)和Sideroxydans等〕和铁还原细菌〔地杆菌属(Geobacter)等〕丰度随处理进程均降低,但在湿地系统沉积物和植物根际土壤中土微菌属(Pedomicrobium)(8.38%±1.51%)和硝化螺旋菌属(Nitrospira)(14.75%±0.46%)丰度明显高于多级复氧反应池.
