人造蛋白功能材料的生物合成及应用
2021-09-24曾丹储建林陈燕茹范代娣
曾丹,储建林,陈燕茹,范代娣
(1 西北大学化工学院,陕西省可降解生物医用材料重点实验室,陕西省生物材料与发酵工程技术研究中心,陕西 西安 710069;2 南京工业大学药学院,江苏 南京 210000)
王义翘教授是国际生物工程和生物技术领域的奠基人,一生致力于生物工程技术研究和产业开发,研究方向包括重组蛋白生产和纯化工艺研究,蛋白质稳定性和制剂技术研究,生物反应器控制理论研究,酶技术和酶工程,生物高分子生产,食品科学和生物能源研究等,荣获了美国化学学会M.J.Johnson Award 亚太地区杰出生物化工奖,新加坡公共服务奖章和马里兰大学杰出工程技术奖等生物技术领域的重要奖项。
王教授一直以来心系中国生物技术的发展,是我国5所大学的名誉教授,经常参加国内的权威会议和学术讲座,为我国的生物工程和生物技术领域的学者提供了很多的指导和帮助。2013 年,在王教授78 岁高龄的时候,仍然作为大会荣誉主席参加了第18 届国际生物化学和分子工程大会。王教授不仅是科技创新者,而且是教育家,为生物工程和技术领域培养了众多高级技术和管理人才,学生遍布世界各地,推动着整个生物化工领域的发展。
谨以此文沉痛悼念王义翘教授,我辈将铭记王教授为生物工程领域做出的突出贡献,为生物工程和生物技术的发展继续努力奋斗,砥砺前行。
合成生物学(synthetic biology)是在现代生物学和系统科学以及合成科学基础上发展起来、融入工程学思想和策略的新兴交叉学科,通过将自然界存在的生物元件标准化、去耦合和模块化来设计新的生物系统或改造已有的生物系统[1]。合成生物学的研究策略涵盖了多种学科的综合应用,包括基因工程、代谢工程、蛋白质工程、化学工程、电子信息工程等,侧重于“自下而上”(bottom-up)的理念,从元件、模块到系统,应用不同学科的知识实现新的细胞行为,合成工程学所设计的生物学目标,具有广泛的应用潜力[2-3]。
蛋白质功能材料具有良好的生物相容性和多功能性,在医药、军事和纺织等领域应用价值巨大[4-8]。国际上对蛛丝蛋白、蚕丝蛋白、贻贝蛋白和胶原蛋白等蛋白质功能材料的人工合成方面开展了大量研究,构建了包括大肠杆菌、酵母和家蚕细胞等多种人工表达体系[9-15]。然而,蛋白质材料存在分子量大、特定氨基酸含量高、翻译后修饰特殊、结构性能不佳等问题,导致其产量和性能尚不能满足应用需求。合成生物学和化学生物学的进展促进了新的蛋白质融合和新的功能基团的整合,使蛋白质功能材料成为具有新兴特性的生物材料[16]。新的研究策略具有加工过程和性能易于控制、材料稳定性高、降解产物可控、副产物少、可规模化生产等优势,解决了天然蛋白提取困难的问题,成为人造蛋白合成的新趋势。
随着结构解析、计算模拟和设计改造等技术的快速发展,蛋白质功能材料的精准设计成为可能[17-18]。冷冻电镜技术的发展快速弥补了蛋白质晶体结构上的不足;分子动力学模拟和量子化学计算等理论计算已成为蛋白质动态模拟的重要方法。美国科学院院士Baker 等通过催化反应路径的量子化学计算和蛋白质折叠预测,成功创造了全新的可催化双分子Diels-Alder 反应的人工酶[19],UCLA 的Todd O.Yeates 等[20]设计的多面体蛋白单体可自组装成具有特殊功能的蛋白材料。Buehler 实验室[21]通过计算模型辅助理性设计实现了丝素蛋白复杂有序结构的预测和构建表达。清华大学刘凯课题组[22]通过计算机模拟对胶原蛋白和贻贝蛋白等力学蛋白进行理性设计并优化,成功构建并表达了多物种融合力学蛋白。Scheibel 课题组[23]详细阐述了不同蛛丝的构成并且推测了蛛丝结构模型。然而,研究者只解析出蛛丝蛋白的C 末端(2K3P,2KHM)和N 末端(2LPI)的三维结构,对于中间区域的结构尚未解析[24]。
考虑到合理设计方法受限于相对稀缺且难于得到的可分辨3D蛋白质结构,哈佛大学Wyss生物启发工程研究所和哈佛医学院George Church 研究团队[25]创建了利用深度学习直接从蛋白质的氨基酸序列中提取蛋白质的基本特征的工程化蛋白质设计方法。该方法无需其他信息,可稳健地预测天然蛋白质和从头设计(de novo)蛋白质功能,还使蛋白质工程任务的效率提高了两个数量级,实现了蛋白质的功能定制,在治疗、诊断、生物制造和生物催化等领域都将有很大的应用空间。美国Arnold 研究团队[26]阐述了利用机器学习进化蛋白质的方法,其中机器学习可以指导进行蛋白质工程的定向进化,优化蛋白质功能,而无需详细的基础物理或生物学途径模型,这为按需开发优质蛋白质元件提供了全新的思路。美国David Baker 研究团队选择了能够在广泛动态范围内调整“笼子-门闩”和“笼子-钥匙”相互作用密切关系的结构特征——螺旋结构,从头设计出自然界不存在的生物活性蛋白质开关LOCKR[18]和生物反馈网络degronLOCK[27],可在体内降解目标蛋白,通过即插即用的特性来实现对内源性信号通路和合成基因电路的反馈控制。这是蛋白质从头设计领域的又一里程碑,为合成生物学提供了全新的调控工具。这些工作为全新的功能蛋白的设计奠定了基础,为蛋白质功能材料的精准设计提供了可鉴技术手段。
通过精准设计策略,根据易表达和高性能的应用要求,通过二级结构重排、酶切位点氨基酸优化改造、非键作用力平衡网络重构以及整体(局部)自由能增强等策略,优化或从头设计新型蛋白分子[28-29]。从而建立起蛋白质功能材料从“分子结构确定、功能机制解析到全新设计”的研究理念。
本文针对蛛丝蛋白、蚕丝蛋白、类人胶原蛋白(human-like collagen,HLC)和贻贝蛋白等人造蛋白功能材料目前在生物合成以及实际应用中遇到的瓶颈问题,同时从生物学和材料学两个不同角度,利用合成生物学技术手段,以高效合成及功能需求为导向,主要从人造蛋白细胞工厂的构建、适配调控和多种蛋白材料相关产品的应用展开介绍,为人造蛋白功能材料的高效合成和应用提供可借鉴的研究思路。
1 人造蛋白表达系统的构建
蛛丝蛋白和蚕丝蛋白材料的透水性、透气性、生物相容性和可降解性是化学纤维不可匹敌的。蜘蛛丝有“生物钢材”之称,是已知生物材料中强度最高的天然蛋白纤维,其强度甚至高于制作防弹衣的凯夫拉纤维[24]。蛛丝蛋白材料可用于制备外科手术缝线、防弹衣及降落伞等材料,在生物医学、材料、纺织、航空航天、信息存储等领域应用广泛[30-31]。虽然蛛丝蛋白材料具有质量轻、强度高、弹性好、抗张力强等显著特性,但大量获取蛛丝蛋白非常困难。
科学家们一直致力于研究蛛丝的生产原理,并尝试复制这一过程。已有报道植物表达系统[32]、哺乳动物细胞表达系统[33]、昆虫表达系统[34]、酵母表达系统[35]、大肠杆菌表达系统[36]等来表达蛛丝蛋白基因片段,往往获得的重组蛛丝蛋白的分子量大小只有天然蛛丝蛋白的一半左右,表达量也较低,难以实现大量获取。韩国科学院院士Lee Sang-Yup模拟自然界的蜘蛛丝蛋白表达调控过程,利用基序串联拼接法构建了蛛丝蛋白的多组重复序列,根据蛛丝蛋白基因的特点对大肠杆菌宿主的代谢途径进行改造,通过重构代谢途径提高相应氨基酸在细胞内的合成量,同时过表达相应tRNA 并改造相应氨酰-RNA 合成酶,提高细胞内相应氨酰-RNA 的含量,加强了频繁使用的甘氨酸和丙氨酸途径的供给,实现在大肠杆菌中表达蛛丝蛋白MaSp1 的分子量达到285 kDa,然而随着重复基序的单元数增加,蛛丝蛋白的表达量却显著下降[37]。
丝蛋白材料的生物合成对于其应用将是一个巨大的飞跃,丝蛋白材料的人工设计和加工定制可以满足不同领域应用特性需求。通过复制蜘蛛丝的特性,科学家们设计开发出了一种新型人造蛛丝蛋白,在大肠杆菌中实现该新型人造蛛丝蛋白的可溶性表达,显著提升新型人造蛛丝蛋白的表达水平。模拟蜘蛛天然成丝过程,设计了新型人造蛛丝蛋白组装的纺丝装置,成功纺织出性能优异的新型蛛丝纤维[38]。据估算,仅利用1 L大肠杆菌培养液产生的大量新型人造蛛丝蛋白就能够织出长度约1 km 的仿生纤维,该型人造蛛丝蛋白具有良好的生物相容性,在再生医学研究中将发挥重要作用。
蛛丝蛋白的序列重复次数越多、蛋白质分子量越大,所得的合成蛛丝性能也越强。然而,大肠杆菌难以高效表达很长片段的序列,是困扰人工合成天然蛛丝蛋白的一大难题。近期,科学家将蛛丝蛋白序列分割成小片段,利用大肠杆菌表达蛛丝蛋白片段,生物合成的蛛丝经体外连接获得大片段的蛛丝蛋白,获得了556 kDa 的蛛丝蛋白,较普通天然丝蛋白的370 kDa 更长,几乎是其他生物合成蛛丝蛋白(最大285 kDa左右)的2倍[39]。
家蚕丝蛋白质含量高达98%,由70%~80%的丝素蛋白和20%~30%丝胶蛋白组成。家蚕丝蛋白的主要成分有丝素重链(FibH)、丝素轻链(FibL)、丝胶蛋白(Sericin)等,其中FibH 的分子量达350 kDa,约占全部丝蛋白含量的70%以上,也是决定蚕丝纤维机械性能的主要因素。线状的丝素蛋白具有抗蛋白水解酶、抗紫外线,尤其是显著的柔韧性、抗疲劳和与钢材相似的张力强度,透气吸湿性、弹性良好,无毒、无刺激,与人体相容性强等优势,已广泛应用于医学、化工、食品等领域[40]。新型功能化的丝素蛋白可在药物载体、人造组织材料、骨骼与软骨组织修复材料、神经与血管移植、生物传感器等生物医学材料和环保新材料等领域得到更深、更广的开发和应用[41-43]。
由于蚕丝蛋白和蛛丝蛋白在结构上有一定的相似性,利用家蚕遗传改造大量获取类蛛丝纤维是一个可行性高的策略[44]。近年来,已有利用转基因技术实现了蛛丝蛋白在家蚕细胞中表达的报道,但由于转基因技术本身的限制以及内源性蚕丝蛋白的表达干扰,蛛丝蛋白的产量一直难以得到提高。利用基因组编辑工具TALEN 完全敲除家蚕丝蛋白FibH编码区,同时保留编码区上下游完整的调控序列。在此基础上定点整合含有部分蜘蛛丝基因和荧光标记的DNA 片段,实现了完全去除内源性丝蛋白FibH的表达和利用FibH的内源性调控序列调控外源性蛛丝基因的表达。在转化个体的丝腺和蚕茧中均可检测到蛛丝蛋白的表达,其含量在个体茧层中可达35.2%,远远高于已报道的转基因方法(0.3%~3%)。由于转入的蛛丝蛋白片段分子量较小(约70 kDa),获得的嵌合型蜘蛛丝与对照品种蚕丝相比,在强度上有所下降,但在延展性上有了显著提高,如图1所示。该研究拓展了家蚕丝腺生物反应器的应用,为利用家蚕大量生产新型纤维材料及表达其他高附加值蛋白提供了新策略[45]。

图1 利用基因组编辑家蚕大量表达蜘蛛丝基因[45]Fig.1 Massive expression of spider silk through the genome editing of silkworm
在家蚕“吐”蜘蛛丝方面,有研究报道基于CRISPR/Cas9 的转座子等基因编辑技术改造家蚕腺细胞,将蜘蛛丝基因导入自然吐丝的家蚕中,转基因家蚕可产生机械强度接近天然蜘蛛丝的人造丝蛋白[46],如图2 所示。CRISPR/Cas9 技 术介导天然大小的蜘蛛丝基因插入丝素重链或轻链的内含子(FibH或FibL)可精确控制序列突变,对丝蛋白产量没有影响。但家蚕本身合成大量丝蛋白,占用了过多的氨基酸资源,使得外来基因所用氨基酸资源有限,产量严重受到影响,有待设计构建新型的家蚕细胞工厂表达制备新型丝蛋白材料。

图2 转基因家蚕制成的蜘蛛丝状纤维[46](a)替换天然大小蜘蛛丝蛋白(MaSp1/MiSp1)对丝素重链的替换及其吐丝结茧;(b)蜘蛛丝蛋白MaSp1/MiSp1掺入丝素重链融合表达丝蛋白及其吐丝结茧Fig.2 Spider silk fiber made from transgenic silkworm[46](a)Replacement of the natural spider silk protein(MaSp1/MiSp1)through engineering silk fibroin heavy chain and cocooning;(b)Incorporation of the spider silk protein MaSp1/MiSp1 fibroin heavy chain for the fusion expression of silk protein and its cocooning
2 人造蛋白的适配调控和高效表达
利用原核微生物表达蛋白材料具有细胞生长快速、分子操作简单和适合高密度发酵培养、成本低廉及易于自动控制等优势,然而在大肠杆菌和枯草芽孢杆菌系统中表达的可溶性及分泌性能较低。外源丝蛋白在大肠杆菌等微生物系统中的表达调节因素多、系统复杂,表达元件设计与目的基因之间适配性、蛋白合成途径调控有待研究。利用人工细胞高效表达是实现其人工生产和改性的重要途径,已成为世界各国重点投入的竞争领域。
基因表达调控一直是生物学的主要研究领域,人工合成基因线路(synthetic gene circuit)则在其中发挥着重要的作用[47]。调节基因表达的万能工具对于扩大工程基因网络的规模和增加定制反馈的复杂性是至关重要的。近年来,随着合成生物学的高速发展,研究者们不断追求设计大规模、复杂功能的人工合成基因线路,而其中实现基因表达的精确控制至关重要。近期,爱丁堡大学王宝军[48]研究报道了一套针对合成基因线路设计的多功能基因调控工具建立了一种普遍存在的、来自自然界的间接基因调控机制,即利用诱饵蛋白结合DNA 位点(DNA 海绵)调控大肠杆菌靶点基因的表达。人工合成核酸海绵可系统地调节基因线路中的基因表达,从而精确改变该线路中的基因表达泄漏、输出幅度和诱导倍数、对小分子的响应灵敏度,并改善宿主细胞的生长速度。该基因调节方法简单、有效,可广泛用于多种应用领域相关的人工合成基因线路设计,不仅可以简单、有效地调节基因表达,还能降低因异质蛋白过量表达而造成的细胞负荷。
随着基因工程技术的大规模应用,基因工程重组胶原利用模式化表达宿主,以外源蛋白表达的形式成功克服了胶原蛋白大规模制备的瓶颈。羟脯氨酸是胶原蛋白所独有的非天然氨基酸,其表达对胶原蛋白的螺旋域形成及结构的稳定具有重要作用,是重组胶原与天然胶原结构的主要区别之一。本课题组通过将来源于孢囊菌RH1的脯氨酸羟化酶基因(TPH)与人源Ⅲ型胶原蛋白α1 链基因(COL3A1)共表达,成功地实现了重组胶原的羟化[49]。经该方法制备的重组胶原与天然胶原在氨基酸组成及空间结构上更相近,活性更相似;并且该方法所提供的细菌来源脯氨酸羟化酶与现有的人源脯氨酸羟化酶相比结构更简单,更易于高通量表达,且制备容易,适宜进行大规模生产。同时,利用代谢工程等技术解析了HLC异源表达的关键调控节点;通过对生物反应过程中细胞代谢特性参数分析,结合计算机辅助建立相关分析模型,阐明了发酵过程各参数对人工细胞比生长速率、物质代谢、能量和还原力的影响;结合过程工程技术,如乙酸调控等,实现了HLC 在大肠杆菌、酵母菌等中的高效合成[50-51],合成过程如图3所示[52]。
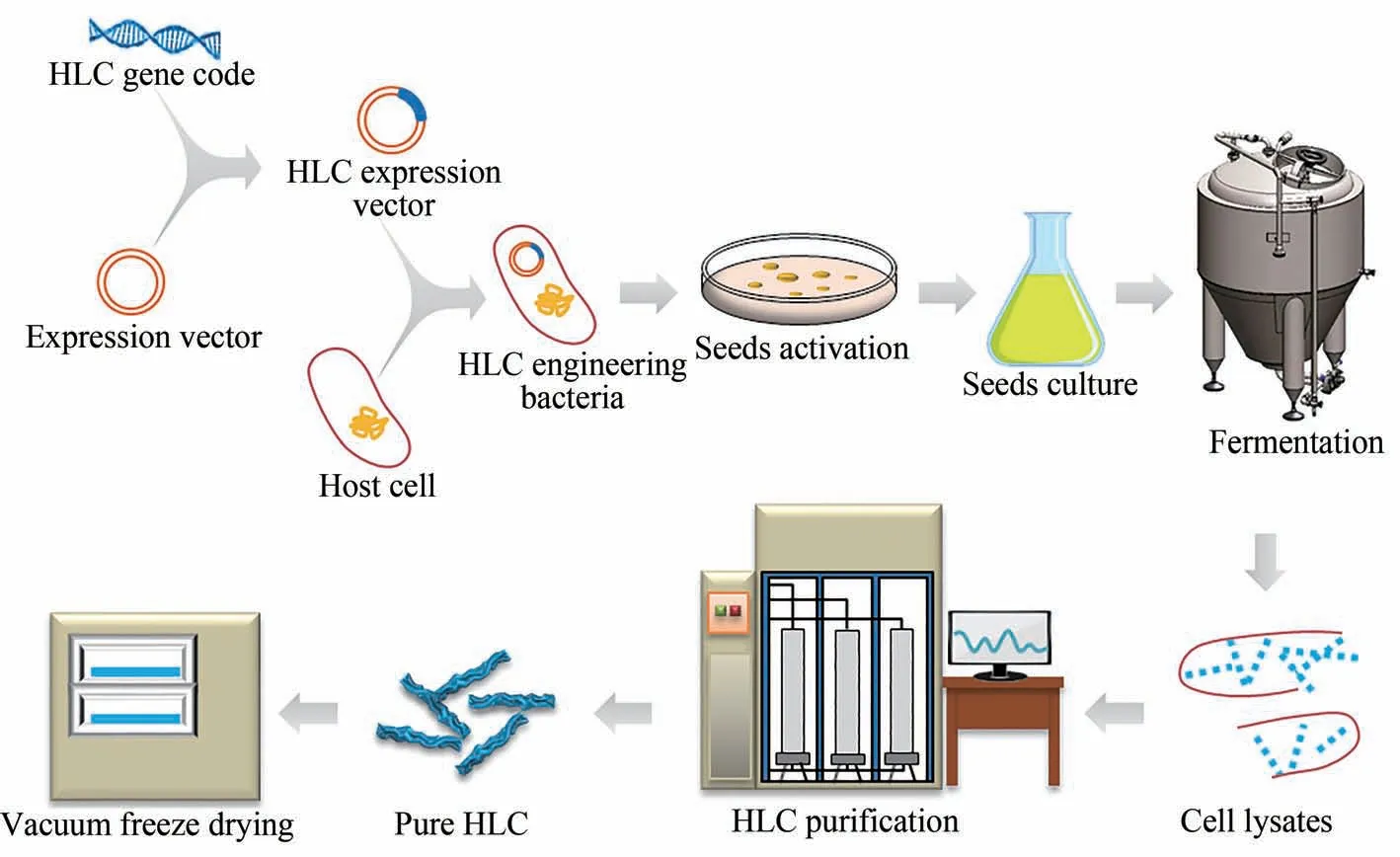
图3 类人胶原蛋白的生产过程示意图[52]Fig.3 Schematic diagram of the production process of HLC[52]
贻贝黏附蛋白由于具有超强吸附能力而备受关注,其蛋白结构中的非天然氨基酸多巴含量是影响其功能的重要因素,因此,非天然氨基酸的掺入是贻贝黏附蛋白生物合成的主要挑战之一。非天然氨基酸的掺入具体是指通过基因编码插入非天然氨基酸(ncAAs)的方法与技术。新的正交氨酰-tRNA 合成酶/tRNA 对的发展可向遗传密码中添加多种非天然氨基酸,非天然氨基酸可展现出20 种天然氨基酸中不存在的结构和功能,为蛋白质功能的增强或产生新的蛋白质特性提供了可能。研究发现,多巴的氨基酰化反应,通过内源性酪氨酰-tRNA 合成酶(TyrRS)可以定量取代残留的酪氨酸,实现体内特异性掺入非天然氨基酸多巴。为此,Yang 等[53]创建了Tyr 营养缺陷型大肠杆菌宿主,实现了贻贝黏附蛋白在大肠杆菌中的表达。该方法掺入的多巴含量非常高,掺入效率达90%,可使表达获得的Mfp-3 和Mfp-5 非常接近天然贻贝黏附蛋白,重组多巴结合的贻贝黏附蛋白表现出优异的表面附着力和在双光子辅助下的耐水性;特别是重组Mfp3和Mfp5的水下粘接性能可与自然贻贝黏附蛋白相媲美,可作为生物胶或黏着水凝胶展现新的应用前景,如图4所示。
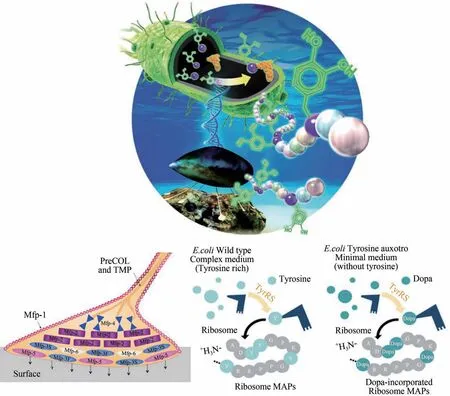
图4 Tyr营养缺陷型大肠杆菌宿主构建及其表达贻贝黏附蛋白Mfp-3和Mfp-5[53]Fig.4 Construction of Tyr auxotrophic E.coli host for the expression of mussel adhesion proteins Mfp-3 and Mfp-5[53]
毕赤酵母是甲醇营养型酵母中一类能够利用甲醇作为唯一碳源和能源的酵母菌,被人们认为是最适用的重组蛋白异源表达系统之一[54]。许多蛋白药物及工业酶都在毕赤酵母中实现了高效的重组表达。目前,人们研究的热点集中在提高外源基因拷贝数以及共表达分子伴侣[55-56]。这两种方案都需要向酵母基因组中整合新的质粒片段,而这样的基因操作是有次数限制的:宿主能接受多少种筛选压力,类似的片段整合就能进行多少次。虽然有人尝试针对一种抗生素通过不断提高其浓度反复进行电击转化,进而筛选多拷贝宿主,但这种方法极易产生假阳性,筛选转化子的工作量非常大。已开发的“Marker 回收系统”能够实现对毕赤酵母的基因敲除,将抗性基因整合到基因组又从基因组上消除[57]。可基于“Marker 回收系统”,通过添加lacO操纵基因,关闭AOX1 在大肠杆菌中的“泄漏表达”,进而构建可以进行抗性自消除的毕赤酵母表达载体,以实现外源基因在毕赤酵母中的高效合成。
翻译起始是蛋白质合成的主要限速步骤,有研究表明,蛋白质合成可能还受到与延伸阶段有关的多重因素调控[58-59]。利用其构建的蛋白库,结合体内与体外实验,系统评估了早期延伸阶段对大肠杆菌表达合成蛋白质的影响,研究了编码蛋白质的基因的前10 个核苷酸碱基序列,该序列区域可能与通过翻译起始或延伸来调控蛋白质合成有关。位于N 端的氨基酸和核苷酸分别都会对蛋白质合成效率造成影响,可能是由tRNA、mRNA、核糖体和新生多肽链一起参与的相互作用决定了蛋白质合成的效率,并根据单分子荧光共振能量转移实验结果推测,该位置特定的核苷酸和氨基酸组成造成了核糖体停顿并导致蛋白质合成的提前终止。此外,关于蛋白质在翻译和发酵过程中的表达优化,本课题组利用伴侣蛋白GroEL 体系与GroES 协同使用,通过协助折叠HLC 和增加HLC 编码基因的mRNA 水平来增加其产量[60];同时,触发因子也可以积极促进HLC的表达[61]。
蛋白糖基化是最普遍的蛋白质翻译后修饰之一,它与所修饰蛋白的折叠、结构、运输、定位和生物活性的保持等关系密切。因此,在人造蛋白重组表达时,糖基化是重要的考虑因素之一[62]。由于不同表达系统的蛋白糖基化受到糖基转移酶表达水平、底物特异性等因素的影响,蛋白糖基化的准确分析十分必要[63]。目前,多种不同的完整糖肽质谱分析策略和相应分析软件不断被开发出来,包括Byonic[64]、GPQuest[65]、pGlyco 2.0[66]、GPSeeker[67]和MSragger-Glyco[68]等。这些软件可实现快速、高通量的完整糖肽分析,且在单次分析中可同时获得糖基化的多肽序列和糖链信息,使得分析结果更为精细。
目前蛋白糖基化分析方法仍存在局限性,比如当解析完整糖肽上的糖链信息时,上述软件多数仅能获得糖链的单糖组成信息,依然无法获知糖链精细结构信息。另外,上述软件均采用了数据库匹配打分的方式进行糖链组成分析,仅能鉴定已知的糖链结构,因此现有完整糖肽分析方法和软件均难以直接应用到含有大量特殊糖链结构蛋白质的完整糖肽分析中。综合以上分析,常用的糖组学和完整糖肽分析方法均无法完全满足当前的研究需要,亟待开发不依赖已知数据库的糖链结构从头测序新软件。新的糖肽软件的开发可以为后期人造蛋白的糖基化分析提供坚实的技术基础。
3 人造蛋白功能材料的应用
针对当前临床产品存在的生物相容性差、功效不足等问题,人造蛋白功能材料可根据功能需求,进行定向装配加工,应用于制备人工肌腱、人工皮肤、可降解止血材料、人工骨和高黏抗污涂层产品等新型蛋白材料医学产品。
3.1 人工肌腱
生物材料构建的人工肌腱具有机械强度高、组织相容性好、无明显排斥反应、衔接部牢固等优点,但同时存在易于感染粘连、诱导腱化过程缓慢、生长的肌腱滑动性差等问题[69]。可以借助蛋白积木技术[70],采用生物相容性优异的蚕丝蛋白、蛛丝蛋白复合糖类等制备人工肌腱。研究发现,通过静电纺丝蚕丝蛋白纤维板包裹能促进移植软组织的肌腱-骨愈合[71-72]。肌腱/韧带-骨界面的结构和细胞外基质组成是复杂的,且允许肌腱/韧带和骨之间的渐进机械应力转移。因此,模仿原生界面结构特征的支架可以更好地支持功能性组织再生。慕尼黑工业大学Sònia Font Tellado 等人[73]制备了肌腱/韧带侧各向异性和骨侧各向同性的双相丝素蛋白支架,用以模拟胶原分子排列在界面上的梯度。此支架支持细胞附着,并根据孔隙排列影响细胞骨架组织。同时,肌腱/韧带、植入物和软骨标记物的基因表达可随支架各区域的孔隙排列而发生显著变化。双相支架在肌腱/韧带-骨组织工程中具有良好的应用前景。
3.2 人工皮肤
人工皮肤可穿戴贴片一般具备柔性、实时监测、非侵入性、用后可丢弃、高集成度、高灵敏度、高稳定性等独特优势,选择性能优异的材料是人工皮肤可穿戴贴片制作的关键。蚕丝因其优异的生物相容性、可降解性质、易加工、优良的力学机械性能,是可穿戴贴片最理想的选择之一[74]。南京工业大学何冰芳团队[75]利用丝素蛋白设计了一种多功能高度集成化的人工皮肤贴片,在贴片上面集成光子晶体反蛋白石结构、微流控通道以及柔性电路,使用Origami(折纸技术)实现三维复合贴片的制作,贴片具备药物释放、光学传感和运动传感的功能,有望在慢性伤口管理、个性化医疗、器官芯片等领域得到应用。Kundu等[76]制备了丝素/羊膜三维双层人造皮肤支架,由于丝素蛋白的加入,此支架具有良好的力学性能、细胞黏附和增殖性能,并能促进血管内皮生长因子和碱性成纤维细胞生长因子的产生,可用于临床皮肤再生。近期,Radacsi等[77]报道了一种高通量生产丝素蛋白基生物相容性复合纤维的方法,并以聚己内酯、聚癸二酸甘油和再生丝素为原料,制备了可调节疏水性/亲水性的纤维毡。此方法显著提高了蛋白质的产量;同时,该三元复合生物材料在体外具有良好的成纤维细胞附着和最佳生长,表明这种结构有潜力发展成有助于伤口愈合和皮肤再生的人造皮肤平台。
3.3 可降解止血材料及人工骨
人造蛋白功能材料中的HLC 以其良好的凝胶性、吸水性、生物相容性、可降解、无毒等诸多优良特性,在伤口缝线、软骨缺损填充、骨骼金属植入物镀膜等领域广泛应用,是一种非常重要的生物医用材料[78-79]。本课题组基于HLC 材料,结合小分子壳聚糖制备了系列植入型止血材料[80-82]。与同类临床产品相比,该材料止血迅速,并可以通过调节壳聚糖的比例获得不同的降解速度,适用范围更广。另外,以HLC、羟基磷灰石和透明质酸等为原料,制备了多种复合人工骨支架材料[83-88]。研究表明,添加HLC 的支架材料不仅能促进细胞很好地黏附、生长和增殖,引导细胞向孔隙内生长,并能维持细胞天然的圆形或多角形软骨形态,促进细胞外基质分泌,形成致密的细胞层,对骨软骨缺损的修复重建在临床应用方面具有重要意义。吴斌团队开发了一种聚多巴胺(pDA)辅助的bmp-2 衍生肽(指定为P24)表面修饰策略,用以改善以纳米羟基磷灰石/重组类人胶原/聚乳酸(nHA/RHLC/PLA)为材料制备的三维多孔支架的成骨[89]。结果表明,pDA 辅助表面修饰可以显著提高nHA/RHLC/PLA 支架的成骨活性,新型nHA/RHLC/PLA-pDA-p24 支架是一种很有前途的骨组织再生支架生物材料。
3.4 黏附抗污涂层
医疗器械的涂层材料存在湿性黏附力弱、生物污损和难以自修复三大难题[90],开发一种能够简便快速黏附在医疗设备表面,且兼具抗污和良好生物相容性等多功能的涂层材料,是当前医学界急需解决的问题。贻贝黏附蛋白具有高强度、高韧性和防水性,以及极强的黏附基体的功能。贻贝黏附蛋白中特殊的分子结构、多巴介导的链间交联和与底材之间的相互作用方式形成了其独特的生物学功能,还具有很好的生物相容性和可降解性。贻贝黏附蛋白Mfp-3、Mfp-5 主要分布在附着基与基底表面相互接触的界面处,被认为是贻贝附着基与外界固体表面形成黏合的主要黏附蛋白,是一类极具优势和潜力的生物胶黏剂,非常适用于医用涂层的制备[91-92]。天津大学张雷和齐海山团队受贻贝黏附特性的启发,通过生物合成法设计制备了贻贝融合蛋白MP-KE。MP-KE 涂层能抵抗95%以上细菌和细胞黏附,且抗菌性突出;在热蒸汽环境下,将其涂覆于玻璃基板仍表现出高透光率,说明此涂层兼具优异的防雾性能;同时该蛋白涂层生物相容性良好,体内植入器件或传感器等使用此涂层有望克服机体免疫排异反应,在生物医学和制药领域具有潜在的应用前景[93-95]。人造蛋白功能材料的主要应用总结于表1。

表1 人造蛋白功能材料的应用Tab.1 Applications of artificial protein functional materials
4 结论与展望
人造蛋白功能材料在医药、军事和纺织等领域都显示出越来越重要的应用价值。然而,天然生物元件来源于自然进化,在模块化、组装、集成等方面,难以符合特定工程需求。随着人口老龄化时代的到来,对生物材料的要求将从简单的多功能和高效,逐步发展为动态可调控以及仿生交互等方向。合成生物学通过合成生物功能元件、装置和系统,对细胞或生命体进行遗传学设计、改造,利用合成基因线路研究转录、后转录调控网络设计;具有良好协调行为、协同执行功能的生物系统可为新型功能蛋白材料研究提供全新的解决方案。根据蛋白材料的不同特性,蛋白材料特性的结构机制解析、基因工程原理设计并制备出满足医用材料、组织工程和药物载体等特定需求的蛋白功能材料,极具开发价值和应用前景。
近年来,人造蛋白功能材料的合成及应用研究范围得到了极大拓展,在合成生物学理念的指导下,建立了“精准设计—系统构建—调控表达—工程应用”的研究策略。利用合成生物学的技术和原理,可以优化人造蛋白功能材料的合成流程,提供新的合成路径,提高制造效率;但合成生物学兴起的时间不长,在发展过程中会遇到各种挑战,目前还存在以下几个方面的问题亟待解决:①现阶段理论分析工具及模型较少,对功能蛋白的设计、预测和分析比较局限,需要建立更全面的蛋白数据库;②在蛋白表达阶段,不同细胞的系统构建还需突破,蛋白的表达效率还需要进一步提高;③在工程应用方面,在不断提升蛋白材料功能的同时,还需要综合考虑材料的稳定性以及生物安全性等方面。
从实际应用需求来看,设计具有动态响应特性的人造蛋白功能材料是未来发展的必然趋势,这对人造蛋白功能材料系统的设计和工程控制提出了新的要求。自下而上的材料设计方法面临的核心问题是如何忠实地将分子级的功能转移到宏观级的材料特性。因此,需要着重开发使工程蛋白质分子组装成功能性宏观材料的研究方法。基于现阶段存在的问题,一些新技术的发展为得到具有全新结构、功能的蛋白提供了可行的途径,如借助定向进化技术、人工智能和深度学习技术[96-98]、遗传密码子扩展技术[99]等,相信人造蛋白功能材料必将依赖于蛋白质合成生物技术的突破而快速发展。
