土壤中可降解塑料微生物的分离和初步鉴定*
2021-09-24蒋欣怡王书卿杨怡萱朱振洪
蒋欣怡,王书卿,杨怡萱,朱振洪
(浙江中医药大学 生命科学学院,浙江 杭州 310053)
塑料制品具有强度较高、质量较轻、抗腐蚀、价格较便宜等优点,在人们生产生活中得到了广泛应用[1]。塑料的应用在给人们带来极大便利的同时也带来了很大程度上的负面影响。当今,大部分废弃塑料制品只有通过焚烧、使用化学试剂等方法才能快速降解,在自然环境中通过光、生物降解[2]的速度非常缓慢,大概需要几百年的时间才可能降解到完全消失[3],研究发现有一些菌种可以以塑料为食并在其上生长,菌种产生的酶将其转化为自己生长所需的物质[4-5]且不会破坏[6-7]环境[8]。所以当前利用生物技术处理废弃塑料[9]已经成为了非常值得研究的内容。
1 材料与方法
1.1 材料
1.1.1 试剂
胰蛋白胨、酵母提取物、葡萄糖、可溶性淀粉、聚乙烯醇(PVA)、聚氯乙烯(PVC)。
1.1.2 主要仪器
PCR扩增仪、台式冷冻离心机、立式压力蒸汽灭菌器、琼脂糖DNA凝胶电泳仪。
1.2 方法
1.2.1 土壤菌种的采样
在杭州市生活垃圾填埋场周边的土壤中采样,挖取地表下约15cm的土壤用塑料袋装好,取回保存备用。
1.2.2 土壤微生物的分离
(1)通过稀释涂布的方法将菌种进行浓度梯度分离,划分成细菌、真菌。(2)观察并标记不同形态、类型的菌落,进行挑菌分离培养。(3)通过分析菌种的长势、形态,观察其中是否含有其他菌种,并再次进行分离,以确保菌种分离的完整性。
1.2.3 菌种的选择性培养
将固定培养基培养的纯化菌种培养在以PVA、PVC为碳源的培养基上,观察是否生长(细菌大概1-2天的生长周期,放线菌和真菌大概3-5天生长周期)。
1.2.4 菌种的液体培养以及对塑料薄模和塑料包装袋的分解速率及测定
(1)配制液体培养基(真菌为改良的马丁氏培养基,放线菌为高氏1号培养基,细菌为LB培养基)。(2)将紫外线处理后的塑料薄模长宽约5cm×5cm的小块片段放入液体培养基中,并将相关的菌种接种到其液体培养基内培养,大约2-3天后拿出液体培养基中的塑料薄模小块片段,通过对照实验,观察菌种对其的影响。(3)用100mL锥形瓶培养菌种,并将紫外线处理后的塑料薄模小块片段放入液体培养基中,观察分解效率和强度。(4)通过对照实验,改变碳源(氯化钠1g,胰蛋白胨1g,酵母粉0.5g,蒸馏水100ml)的用量,促进菌种基因的表达,减少遏制基因的作用,对比碳源的用量观察分解速率找出最适合表达基因、酶活性的用量。(5)加入表面活性剂,改变培养液的用量,促进酶的活性,促使微生物能够发酵产生更多的酶,促进对塑料的降解。
1.2.5 菌种的冻存与复苏
菌种冻存一般加20%甘油,-80℃保存。复苏时将甘油菌保存的菌种冰上解冻后,划线接种在固体培养基上,再将固体培养基的单菌落接种到液体培养基中。
1.2.6 基因组的提取与检测
(1)运用试剂盒提取降解塑料的基因组,将提取的基因组溶解于30μL TE缓冲液中。(2)将0.5μL 10×Loadding Buffer与4.5μL DNA溶液混合,加入凝胶中,用凝胶成像仪观察并拍照。
1.2.7 PCR扩增与电泳检测
(1)设置PCR程序和体系PCR引物:ddH2O 18.26μL;PCR Buffer 2.5μL;dNTP 2μL;上游引物:0.25μL;下游引物:0.25μL;模板(基因组)1μL。PCR程序:a.94℃预变性;b.94℃变性30S;c.57℃复性30S;d.72℃延伸30S,返回第2步,循环3次;e.94℃变性30S;f.54℃复性30S,72℃延伸30S,返回第5步,循环27次;g.72℃,10min。(2)将0.5μL10×Loadding Buffer与4.5μL PCR产物混合,加入凝胶中,用凝胶成像仪观察条带质量。1.2.8测序(测定核苷酸序列)
将PCR产物和上下游引物ITS4(TCCTCCGCTTATTGATATGC)和ITS1(TCCGTAGGTGAACCTGCGG)送到上海桑尼生物技术公司测序。
1.2.9 将序列网上比对鉴定菌种
通过NCBI序列比对查找同源性较高的片段并添加到MAGA5.0软件中进行比对运算,并制作进化树并分析其同源性。
2 结果
2.1 通过稀释涂布的方式进行初步的种属菌种分离
通过稀释涂布法,将培养液稀释到10-6所形成的浓度为真菌分离最适宜的挑菌浓度,将培养液稀释到10-7所形成的浓度为细菌分离最适宜的挑菌浓度,并且培养的菌种形成肉眼可观察到的单菌落。菌落大小、形态各异,放线菌颜色大部分较为鲜艳并且有光泽、略带有土腥味,细菌颜色大部分偏黄色略带臭味,真菌偏乳黄色,乳白色居多略带酒香味和霉味。
2.2 接种在固定菌种的培养基中进行再次分离
初步分离得到单菌落培养,细菌分离出4种不同形态、颜色和大小的菌株、真菌分离出3种不同形态、颜色和大小的菌株,并且菌落特征与初步分离得到的菌落特征基本一致。
2.3 将纯化的菌种培养在以PVA(聚乙烯醇)为唯一碳源的培养基上
当2.2中初步分离的菌株在含PVA的选择性培养基上生长时,发现真菌1、2、3号可在PVA选择培养基上生长,并且长势良好,无杂菌污染,形成单菌落,菌落形态、颜色和大小也与固定培养基形态一致,如图1(A)所示。而分离的细菌有两株可在PVA选择培养基上生长,如图1(B)所示。

图1 微生物在PVA选择培养基上生长
2.4 将纯化的菌种培养在以PVC(聚氯乙烯)为唯一碳源的培养基上
由图2可知,所分离的真菌1、2、3号也可在PVC选择培养基上生长,并且长势良好,无杂菌污染,形成肉眼可观察到的单菌落形态。所分离的细菌均不可在PVC选择培养基上生长。
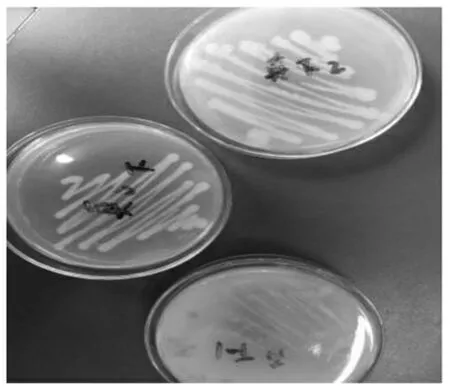
图2 真菌在PVC选择培养基上生长
2.5 菌种的液体培养以及对塑料薄膜和塑料包装袋的分解速率及测定
从图3中可以看出,与对照组(长5cm,宽5cm)相比,真菌1、2、3号具有一定的分解效果,真菌1号作用的塑料薄膜边缘皱略缩成团状(长4.5cm,宽4.5cm)并且中间有小孔,用手触摸质感不及对照组光滑;真菌2号作用的塑料薄膜(长3cm,宽3cm)边缘有部分皱缩用手触摸质感不及对照组光滑;真菌3号作用的塑料薄膜中间皱缩(长5cm,宽2cm)用手触摸质感不及对照组光滑。

图3 三株真菌对塑料薄膜作用效果图
2.6 基因组的提取与PCR的扩增
通过提取基因组作为模板,并利用PCR技术,以ITS1和ITS4作为上下游引物,扩增获得PCR产物。通过凝胶电泳成像仪拍照显示,从真菌1、2、3号中扩增出的PCR产物大小为400bp左右(如图4所示)。产物送至上海桑尼生物技术公司进行测序。
2.7 序列的分析
由图5可知,真菌1号与白地霉WLL1株拥有最高的同源性,同属于地霉属,生物体间的遗传差异数值大约为0.2个单位;真菌2号与白念珠菌培养CBS:11616和真菌CMH122拥有最高的同源性,同属于地霉属,生物体间的遗传差异数值大约为0.5个单位;真菌3号与地霉分离株M14拥有最高的同源性,也同属于地霉属,生物体间的遗传差异的数值大约为1个单位。
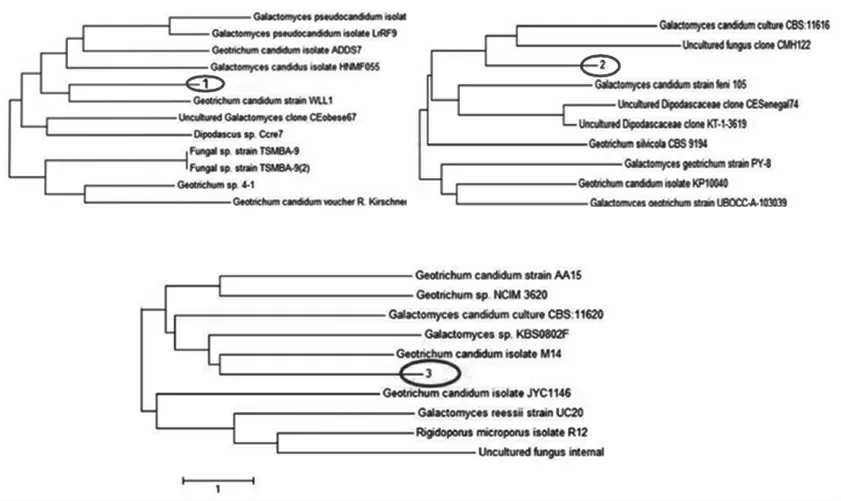
图5 真菌1、2、3号进化树分析图
3 讨论
近年来,生物降解塑料得到重视。对于中国这样一个塑料制品生产和消费大国,生物降解塑料的研发、生产与应用对塑料产业的可持续发展具有更加重要的意义,也符合中国的国情、可持续发展的战略。此实验可以实现对绿色资源的循环利用。同时,生物降解的方法也逐渐受到人们的重视,对能源的再利用也有很深远的影响。根据这种现状我们的实验项目寻找具有塑料分解能力的微生物[10],并在实验后期尝试找出其中分解能力较强的菌种,提取其关键酶[11],高表达菌株筛选并进行基因改造,大大提高了分解塑料的能力,运用到后期生产的话,可为解决塑料污染问题提供方向。
目前,利用微生物降解塑料已经成为了研究热点。宋力等[12]研究发现环境因素和微生物数量均会影响生物塑料在水生系统中的降解效果。环境因素主要是通过相应微生物产生的生物塑料降解酶影响生物塑料的降解性;海水中附着的微生物数量则通过改变塑料的形状影响生物塑料的降解性。2016年,可消化PET塑料的细菌Ideonella sakaiensis 201-F6品种被发现,相比其他的细菌酶,这种酶能更快更有效地对塑料进行分解,具有用于生物循环的潜能[13]。与此同时,某团队研究出了一种混菌体系可以高效降解塑料。他们根据细菌一种十分巧妙的代谢方式,来保持混菌系统的稳定,并且这些菌可以相互协作,更高效地完成对塑料的降解[14]。
本实验利用基因组提取技术、PCR技术对微生物进行分子生物学基础操作,通过扩增片段完成测序及运用MAGA生物软件对序列的同源性进行鉴定,推断出其种属以及同源性[15]。根据目前研究结果显示能够分解塑料的微生物分布特点以及作用强度、作用方式及微生物的类别,后续需继续大量发酵提取蛋白并对其进行纯化,通过核磁共振仪、SDS聚丙烯酰胺凝胶电泳、酵母双杂交等技术分析蛋白的结构和功能或者进行微生物分解塑料功能片段的扩增,以及过表达、基因敲除等方式对基因进行功能分析,以便于更好地解决生活中的白色污染问题[16],从而有利于促进我们处理塑料制品采用便捷的方式。
4 结束语
本文运用微生物分离、发酵、分子鉴定的技术,前期通过取土样分离微生物,随后在选择培养基(PVA、PVC)上培养观察生长状况,再运用微生物液体培养基发酵技术以及观测微生物对塑料薄模的分解能状况,进一步判断微生物的分解能力,最后利用分子鉴定技术对所分离的微生物进行种属鉴定。下一步可通过微生物培养条件的优化,以及相关酶基因的研究,更好地发挥微生物对废弃塑料的降解。
