黄药子及其制剂致药物性肝损伤病例临床分析
2021-09-23陈红高水群肖锦仁唐
陈红 高水群 肖锦仁 唐
〔摘要〕 目的 探討黄药子及其制剂所致药物性肝损伤(drug-induced liver injury, DILI)的原因、治疗及预后情况,为其临床合理用药提供参考。方法 回顾性分析成都医学院第二附属医院2015年1月至2020年10月确诊43例黄药子及其制剂致DILI 患者的住院资料,依据国际医学组织理事会制订的DILI临床分型判断标准进行分型,记录其肝功能状况及临床表现,分析临床原因,统计常规保肝治疗、黄药子解毒方联合还原型谷胱甘肽治疗及血浆置换治疗后患者的临床有效率。结果 43例DILI患者临床分型中肝细胞损伤型占20.93%,胆汁淤积型肝损伤占44.19%,混合型肝损伤占34.88%。相比于肝细胞损伤型和混合型,胆汁淤积型患者的总胆红素(TB)和直接胆红素(DB)水平均明显升高(P<0.01);胆汁淤积型患者的谷丙转氨酶(ALT)、谷草转氨酶(AST)和碱性磷酸酶(ALP)水平均明显高于混合型(P<0.01)。患者肝损伤的临床表现主要以皮肤、巩膜黄染(69.77%),发热 (62.79%),纳差、乏力(58.14%)为主;服药时间过长、服药剂量过大为引起肝损伤的主要原因。对于非重症急性肝衰竭患者,采用常规保肝治疗方案与黄药子解毒方联合还原型谷胱甘肽治疗方案的患者临床有效率分别为95.65%、100.00%,差异无统计学意义(P>0.05)。结论 临床使用该类药物时,可引起多种类型的肝损伤,应密切关注使用剂量、使用疗程及患者肝功能变化情况。
〔关键词〕 黄药子;药物性肝损伤;还原型谷胱甘肽;肝功能;回顾性研究
〔中图分类号〕R288 〔文献标志码〕B 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.09.023
Clinical Analysis of Drug-induced Liver Damage Caused by Huangyaozi
(Dioscorea bulbifera L.) and Its Preparation
CHEN Hong1, GAO Shuiqun2, XIAO Jinren3, TANG Jing2
(1. Department of Integrated Traditional Chinese and Western Medicine, The Second Affiliated Hospital of Chengdu Medical College/Nuclear Industry 416 Hospital, Chengdu, Sichuan 610057, China; 2. Department of Pharmacy, The Second Affiliated Hospital of Chengdu Medical College/Nuclear Industry 416 Hospital, Chengdu, Sichuan 610057, China; 3. Pharmacy School, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Objective To investigate the causes, treatment and prognosis of drug-induced liver injury (DILI) caused by Huangyaozi (Dioscorea bulbifera L.) and its preparations, so as to provide reference for clinical rational drug use. Methods The hospitalization data of 43 patients diagnosed with DILI caused by Huangyaozi (Dioscorea bulbifera L.) and its preparations from January 2015 to October 2020 in The Second Affiliated Hospital of Chengdu Medical College were retrospectively analyzed. The patients were classified according to the criteria for clinical classification and judgment of DILI formulated by the Council of International Medical Organizations. The liver function status and clinical manifestations were recorded, and the clinical causes were analyzed. After conventional liver protection treatment, Huangyaozi Jiedu Prescription combined with reduced glutathione treatment and plasma exchange treatment, the clinical effective rate was calculated. Results In 43 DILI patients, liver cell injury type accounted for 20.93%, cholestasis liver injury type accounted for 44.19%, and mixed liver injury type accounted for 34.88%; the levels of total bilirubin (TB) and direct bilirubin (DB) in patients with cholestasis type were significantly higher than those in patients with hepatocyte injury type and mixed type (P<0.01); the levels of alanine aminotransferase (ALT), aspartate aminotransferase (AST) and alkaline phosphatase (ALP) in patients with cholestasis type were significantly higher than those in patients with mixed type (P<0.01). The main clinical manifestations were skin and sclera yellow staining (69.77%), fever (62.79%), poor appetite and fatigue (58.14%). The main cause of liver injury was taking medicine for too long and taking too much. For non severe acute liver failure patients, the clinical effective rates of the conventional liver protection treatment and Huangyaozi Jiedu Prescription combined with reduced glutathione treatment were 95.65% and 100.00%, respectively, and there was no statistical significance (P>0.05). Conclusion The clinical use of these drugs can cause a variety of types of liver injury, and it is necessary to pay close attention to the dosage, duration of use and changes in the patient's liver function.
〔Keywords〕 Huangyaozi (Dioscorea bulbifera L.); drug-induced liver injury; reduced glutathione; liver function; retrospective study
黄药子为薯蓣科薯蓣属植物黄独(Dioscorea bulbifera Linn)的干燥块茎,首载于唐代孙思邈《千金月令》,药性苦寒,有毒,归肺、肝經,李时珍在《本草纲目》中阐述其功效为:“凉血降火,消瘿解毒”,具有凉血消瘿、解毒消肿、化痰散结等功效[1]。现代药理研究[2-5]发现,黄药子具有抗肿瘤、抗菌、抗炎、抗氧化等作用。因此,临床上常用于治疗癌症、甲状腺肿大、糖尿病等多种疾病。随着我国中医药事业的快速发展,有关黄药子及其复方制剂虽然在诸多疾病的应用治疗上效果显著,但治疗过程中不断出现的毒副作用也不容忽视,尤其以肝毒性[6-10]较为突出。本文回顾性总结分析黄药子及其制剂引起药物性肝损伤(drug-induced liver injury, DILI)的临床病例,以期为该类药物在临床上的合理使用提供依据。
1 资料与方法
1.1 研究对象
选择成都医学院第二附属医院于2015年1月至2020年10月接诊及会诊怀疑黄药子及其制剂致DILI的病例62例。根据中华医学会肝病学分会药物性肝病学组2017年制定的《药物性肝损伤诊治指南》[11],采用RUCAM因果关系评价量表对DILI进行诊断,从开始用药至发病时间、病程、危险因素(如饮酒、妊娠、年龄)、伴随用药、其他肝损伤原因、药物既往肝毒性信息、再用药反应7个方面进行评分,按照分值大小分为5级:(1)分值>8分,极可能;(2)6~8分,很可能;(3)3~5分,可能;(4)1~2分,不太可能;(5)≤0分,无关。此外,排除病毒性肝炎、免疫性肝病、酒精性肝病、遗传代谢性肝病、血吸虫性肝病等其他类型的肝损伤。
1.2 研究方法
通过回顾性分析方法,查阅可能为黄药子及其制剂致DILI患者的病历,记录其性别、年龄、基础疾病、饮酒史、吸烟史、用药史、发病时间、临床症状、体征、肝功能等实验室相关检查结果、治疗及预后等系列资料。
1.3 临床分型
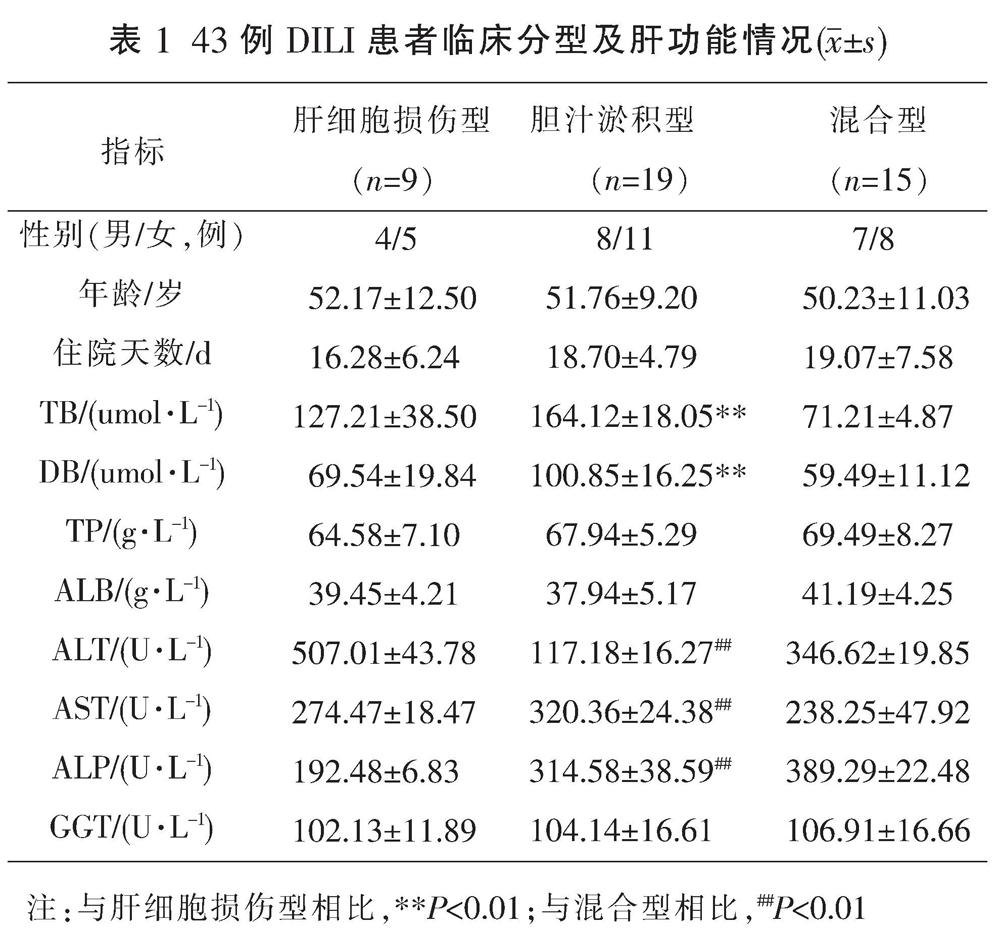
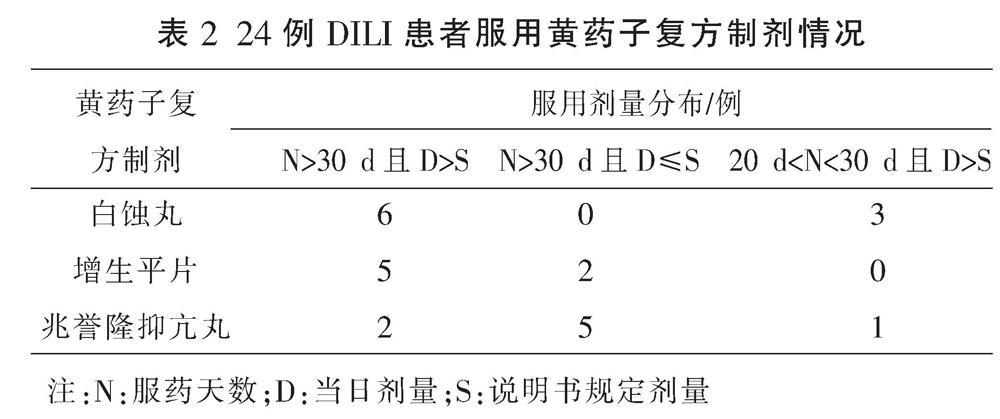
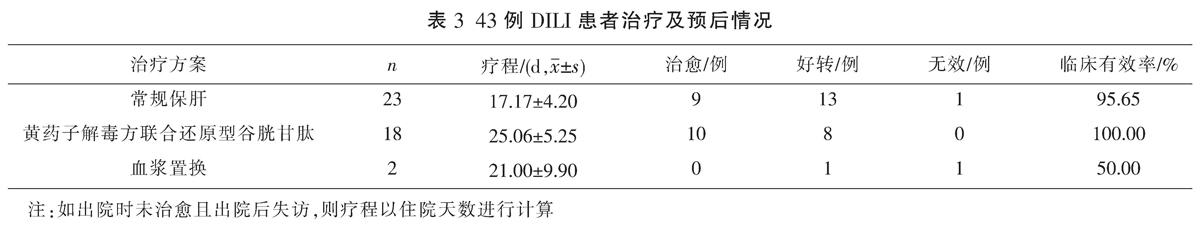
根据国际医学组织理事会制订的DILI临床分型判断标准[12-14],根据R值确定具体肝损伤类型:(1)肝细胞损伤型:谷丙转氨酶(ALT)≥3 ULN,且R≥5;(2)胆汁淤积型:碱性磷酸酶(ALP)≥2 ULN,且R≤2;(3)混合型:ALT≥3 ULN,ALP≥2 ULN,且2 1.4 疗效判断[15] (1)治愈:临床症状、体征完全消失或明显改善,肝功能基本恢复正常,凝血酶活动度(PTa)基本正常;(2)好转:临床症状好转,肝功能指标较治疗前下降50%以上,或PTa较前上升50%以上;(3)无效:症状、体征无改善,肝功能、PTa指标无明显改善或加重,其中自动出院病例判为无效。 1.5 统计学方法 采用SPSS 22.0软件对数据进行处理,计量资料以“x±s”表示,计数资料以百分率表示,临床分型及肝功能状况组间比较采用t检验,治疗及预后情况组间比较采用Fisher精确检验,P<0.05为差异有统计学意义。 2 结果 2.1 一般情况 62例患者经排查最终确定43例入组本研究。男19例(44.19%),女24例(55.81%),男女比例为1∶1.26,年龄17~87(52.30±12.20)岁。 2.2 临床分型、肝功能状况 43例DILI患者中肝细胞损伤型9例(20.93%)、胆汁淤积型19例(44.19%)及混合型15例(34.88%)。3种临床分型患者的年龄、住院天数、总蛋白(TP)、白蛋白(ALB)及r-谷氨酰转移酶(GGT)均无统计学意义(P>0.05)。与肝细胞损伤型和混合型相比,胆汁淤积型患者总胆红素(TB)和直接胆红素(DB)水平均明显升高(P<0.01);胆汁淤积型患者的ALT、谷草转氨酶(AST)和ALP水平均明显高于混合型(P<0.01)。见表1。 2.3 临床表现 43例患者中,临床最常见的症状包括皮肤、巩膜黄染(30例,69.77%),发热(27例,62.79%),纳差、乏力(25例,58.14%)及消化道症状(23例,53.49%)。此外,有少数患者同时发生了脾大(6例,13.95%)、肝大(3例,6.98%)及腹水(1例,2.33%)。 2.4 临床原因分析 43例DILI患者中,有19例患者是因误用或服用黄药子中药饮片造成肝损伤,其中,将黄药子误认为薯莨、何首乌、鬼灯擎等自行服用者6例;连续服药时间较长,服药总药量达500 g以上者8例;短期内(1周左右)每日生药量≥15 g者5例。24例患者服用了含有黄药子的复方制剂,其中,服用白蚀丸者9例(20.93%)、服用增生平片者7例(16.28%)、服用兆誉隆抑亢丸者8例(18.60%),具体见表2。 2.5 治疗及预后 所有患者DILI诊断明确后均立即停用了相关致肝损伤药物。43例患者中,采用常规保肝治疗方案(还原型谷胱甘肽、甘草甜素、注射用丁二横酸腺昔蛋氨酸)的患者23例:治愈9例、好转13例、1例无效;采用黄药子解毒方(大米炒黄,熬粥,顿服,另取金钱草、满天星、生甘草、土茯苓各30 g,煎服)联合还原型谷胱甘肽治疗的患者18例:治愈10例、好转8例;采用血浆置换(由于发生急性肝衰竭,予以血浆置换)治疗患者2例:1例好转、1例无效。常规保肝治疗方案与黄药子解毒方联合还原型谷胱甘肽治疗方案的临床有效率差异无统计学意义(P>0.05)。见表3。 3 讨论 黄药子主要化学成分可分类为茋类化合物、黄酮类化合物、甾类化合物、二萜内酯类化合物及其他类化合物,如有机酸、小分子糖或苷类衍生物等[16]。水总提取物、醇总提取物都有肝毒性相关报道[17-19],研究[20-21]发现,提取物中的二萜内酯类黄独素B(diosbulbin B, DB)是引起肝毒性的主要成分。正常状态下,DB不具有毒性,在体内经肝药酶CYP3A催化,结构中的呋喃环可代謝生成开环顺烯二醛的活性中间体,随后分别与半胱氨酸、乙酰半胱氨酸、谷胱甘肽生成相应的代谢产物而引起肝毒性[22],LI W W等[23]的研究证实呋喃环是DB肝毒性的关键官能团。 研究[24]发现,黄药子的肝毒性与用药剂量、用药时间呈正相关。既往报道[25]认为当黄药子剂量达到500 g以上时,患者可出现肝损伤症状,也有女性患者服用黄药子水煎剂15 g/d,连续6 d后即出现肝损伤症状,累积黄药子总剂量仅90 g的个案报道。本研究19例服用黄药子中药的病例中,误服者6例(13.95%);连续服药时间较长,服药总药量达500 g以上者8例(18.60%);短期内(1周左右)每日生药量≥15 g者5例(11.63%)。以上数据表明,短期内(1周左右)每日生药量≥15 g或连续服用总量达500~1500 g时,黄药子中药饮片可导致机体肝损伤的发生。 本研究中,有24例患者是由于良性前列腺增生症、甲状腺功能亢进症、慢性萎缩性胃炎、白癜风等相关疾病使用了含黄药子的复方制剂。患者既往用药史显示,有17例是未按医嘱服药,自行增加用药剂量,进而导致肝损伤的发生。服用白蚀丸、增生平片、兆誉隆抑亢丸发生肝损伤用药时长分别为(49.83±34.89)、(152.71±28.66)、(47.50±11.17) d,与临床文献[26-28]报道一致。对黄药子复方制剂成分的进一步分析,增生平片中含有白鲜皮,白鲜皮结构中的多个呋喃化合物在代谢过程中可产生亲电性反应性代谢物,这些亲电性反应性代谢物可通过叠加作用导致小鼠产生急性肝损伤[29]。因此,也不能排除复方制剂中其他成分与黄药子产生了协同毒性作用。结合本研究病例及文献报道,考虑到黄药子引起肝毒性的临床因素,在服用黄药子及其复方制剂时,应严格按照规定剂量、疗程服用,还需定期复查肝功能。 与其他文献相比[25],本研究中常规保肝治疗方案组治愈率偏低,治愈率较低的原因可能与该组患者年龄偏大、基础疾病较多有关,也与患者住院时间较短、出院失访等相关,实际上,我们的数据表明,无论是常规保肝治疗方案组还是黄药子解毒方联合还原型谷胱甘肽组,其临床有效率均较高。由此可见,黄药子及其复方制剂引起的肝损伤预后良好,大部分患者停药并经过一段时间治疗后肝功能明显恢复。 黄药子引起肝毒性的具体的作用机制包括脂质过氧化损伤、线粒体损伤、炎症反应、细胞色素P450酶系代谢异常、胆汁淤积、Ca2+浓度平衡破坏等[30-35]。研究[36-40]发现,当归、甘草、阿魏酸、半枝莲、黄芩、黄柏及五味子等可通过不同的机制来减少抗黄药子所致的肝损伤。最近研究[41]发现,当归煎汤炙和甘草煎汤炙这两种炮制均可增强黄药子的止咳功效并降低其肝毒性,其减毒机制可能与抑制肝脂质过氧化并增强抗氧化水平有关。本研究中的43例患者,有18例通过黄药子解毒方联合还原型谷胱甘肽进行治疗,3~6周后均取得较好的临床疗效,与传统西医治疗方案相比,差异无统计学意义(P>0.05)。黄药子解毒方中,大米炒黄后,淀粉被破坏殆尽,转变成活性炭,可有效加速体内黄药子毒性成分的排出,金钱草、满天星等煎服,可达到清热利湿、凉血解毒的目的。但由于目前纳入的病例数较少,扩大病例后的临床疗效及相关解毒机制还需要进一步研究。 参考文献 [1] 李 俊, 肖 瑶, 晏蔚田, 等. 黄药子肝毒性及减毒配伍研究进展[J]. 中华中医药学刊, 2020, 38(12): 100-103. [2] 潘云淼, 侯晓楠. 黄药子肝毒性研究进展[J]. 世界最新医学信息文摘(连续型电子期刊), 2020, 20(10): 46-47. [3] 杜立娟, 孟 祥, 倪 青. 黄药子不良反应及配伍减毒方法研究进展[J]. 中华中医药杂志, 2017, 32(4): 1659-1662. [4] ZHAO Y, KONGSTAD K T, LIU Y Q, et al. Unraveling the complexity of complex mixtures by combining high-resolution pharmacological, analytical and spectroscopic techniques: Antidiabetic constituents in Chinese medicinal plants[J]. Faraday Discussions, 2019, 218: 202-218. [5] ZHANG Z Y, LI H, LI W, et al. Evidence for polyamine, biogenic amine, and amino acid adduction resulting from metabolic activation of diosbulbin B[J]. Chemical Research in Toxicology, 2020, 33(7): 1761-1769. [6] 亓传旺, 咸建春. 黄药子、向天果、黑骨藤致肝损伤3例报告[J]. 临床肝胆病杂志, 2019, 35(12): 2780-2782. [7] 葛汝青, 李卫星. 黄药子复方导致药物性肝炎一例[J]. 中医临床研究, 2016, 8(29): 88. [8] 熊印华, 徐 英, 杨 莉, 等. 黄药子诱导肝损伤大鼠血清脂肪酸的代谢轮廓[J]. 药学学报, 2017, 52(5): 753-759. [9] 刘传梦, 方 静, 王元霞, 等. 中草药相关肝损伤机制研究进展[J]. 中华中医药学刊, 2020, 38(6): 177-181. [10] 潘海琳, 潘伟健, 陈楚裕, 等. 中药药效成分对肝脏毒性影响的研究进展[J]. 临床合理用药杂志, 2020, 13(27): 179-181. [11] 中华医学会肝病学分会药物性肝病学组.药物性肝损伤诊治指南[J]. 实用肝脏病杂志, 2017, 20(2): 257-274. [12] CHALASANI N P, MADDUR H, RUSSO M W, et al. ACG clinical guideline: Diagnosis and management of idiosyncratic drug-induced liver injury[J]. The American Journal of Gastroenterology, 2014, 109(7): 950-966. [13] HAYASHI P H, FONTANA R J. Clinical features, diagnosis, and natural history of drug-induced liver injury[J]. Seminars in Liver Disease, 2014, 34(2): 134-144. [14] ROBLES-DIAZ M, LUCENA M I, KAPLOWITZ N, et al. Use of hy's law and a new composite algorithm to predict acute liver failure in patients with drug-induced liver injury[J]. Gastroenterology, 2014, 147(1): 109-118. [15] 王丽苹, 何婷婷, 崔延飞, 等. 解放军总医院第五医学中心2009年-2019年老年药物性肝损伤患者的临床特征及变化趋势[J]. 临床肝胆病杂志, 2020, 36(10): 2248-2252. [16] 朱大诚, 徐丽婷, 徐笑明. 黄药子化学成分研究进展[J]. 江西中医药大学学报, 2020, 32(2): 117-121. [17] 梁玉琼, 时乐, 徐立, 等. 基于肝损伤级联反应关系的黄药子水煎液致肝损伤机制研究[J]. 中药药理与临床, 2016, 32(6): 144-149. [18] 苏钰文, 江振洲, 王欣之, 等. 黄药子水提物的肝毒性及其毒性物质基础研究[C].// 2012年中国药学大会暨第十二届中国药师周论文集. 南京: 中国药学会, 2012: 12. [19] 徐 英, 陈崇崇, 杨 莉, 等. 基于胆汁酸代谢网络分析中药黄药子的肝毒性[J]. 药学学报, 2011, 46(1): 39-44. [20] 沈雄荣, 董建勇. 不同产地黄药子中黄独乙素的含量测定[J]. 医药导报, 2015, 34(7): 935-937. [21] 谭兴起, 阮金兰, 陈海生, 等. 黄药子的肝脏毒性研究[J]. 中国中药杂志, 2003, 28(7): 661-663. [22] 巫圣乾, 张 璐, 龚梦鹃, 等. 黄独素B致小鼠急性肝损伤的代谢组学研究[J]. 中国药房, 2018, 29(22): 3046-3050. [23] LI W W, LIN D J, GAO H Y, et al. Metabolic activation of furan moiety makes Diosbulbin B hepatotoxic[J]. Archives of Toxicology, 2016, 90(4): 863-872. [24] 赵林钢, 刘若囡, 时 乐, 等. 黄药子水提物多次给药致小鼠肝脏损伤的量-时-毒关系[J]. 中药药理与临床, 2013, 29(4): 96-98. [25] 黄智锋, 华碧春, 陈小峰, 等. 黄药子及其制剂致肝损害78例临床分析[J]. 中国实验方剂学杂志, 2013, 19(23): 295-297. [26] 周克明, 施林林, 殷颖蕴. 白蚀丸引起急性黄疸型药物性肝炎1例[J]. 临床皮肤科杂志, 2006, 35(11): 737-738. [27] 张俊忠. 增生平片致肝损害[J]. 药物不良反应杂志, 2007, 9(3): 215. [28] 李 琪. 兆誉隆抑亢丸致黄疸性肝炎[J]. 药物不良反应杂志, 2006, 8(3): 216, 168. [29] 黄琳艳. 白鲜皮肝损伤化学机制研究[D]. 遵义: 遵义医科大学, 2020. [30] 王秋红, 杨 欣, 王 蒙, 等. 黄芩与黄柏协同保护黄药子致肝毒性的实验研究[J]. 中国中药杂志, 2016, 41(5): 898-903. [31] 齐 静. 黄药子水提物对小鼠肝脏毒性及其线粒体途径损伤机制的研究[D]. 大连: 辽宁师范大学, 2017. [32] 牛成伟, 陆 宾, 季莉莉, 等. 黄独素B诱导小鼠急性肝损伤及其机制[J]. 中國中药杂志, 2014, 39(7): 1290-1292. [33] 王少珍, 廖联明. 黄药子中毒导致肝损伤的机制研究[J]. 中华卫生应急电子杂志, 2018, 4(1): 33-44. [34] 盛云华, 乔靖怡, 金若敏, 等. 基于1H-核磁共振代谢组学研究黄药子乙醇提取物致肝损伤的潜在生物标志物[J]. 中国药理学与毒理学杂志, 2016, 30(4): 306-316. [35] 王加志, 刘树民, 汤青, 等. 黄药子毒性组分对肝细胞内Ca2+浓度的影响[J]. 中医药信息, 2012, 29(6): 15-16. [36] 刘树民, 崔立然, 于栋华, 等. 当归对黄药子致肝超微结构损害的保护作用[J]. 辽宁中医杂志, 2010, 37(9): 1823-1824. [37] 卓 实, 江 川, 黄玉芳, 等. 黄药子配伍甘草对LO2细胞膜通透性影响的研究[J]. 中国现代中药, 2017, 19(10): 1397-1399. [38] WANG J M, SHENG Y C, JI L L, et al. Ferulic acid prevents liver injury and increases the anti-tumor effect of diosbulbin B in vivo[J]. Journal of Zhejiang University-SCIENCE B, 2014, 15(6): 540-547. [39] 杨 辉, 李多娇, 王彦云, 等. 五味子影响黄药子肝肾毒性的实验观察[J]. 临床药物治疗杂志, 2008, 6(1): 29-34. [40] 牛成伟, 季莉莉, 王峥涛. 半枝莲对黄药子肝毒性的保护作用及其机制[J]. 药学学报, 2016, 51(3): 373-379. [41] 巫晓慧, 王君明, 刘 晨, 等. 炮制增强黄药子止咳功效并降低其毒性的研究[J]. 中国药学杂志, 2020, 55(10): 817-823.
