茯苓抗鼻咽癌的物质基础及潜在机制的网络药理学分析与验证
2021-09-23程博范婧莹刘洁苏芮周芳亮黄若茹王贤文何迎春
程博 范婧莹 刘洁 苏芮 周芳亮 黄若茹 王贤文 何迎春

〔摘要〕 目的 運用网络药理学预测和实验验证茯苓抗鼻咽癌的物质基础及潜在机制。方法 借助中药系统药理学数据库及分析平台和BATMAN-TCM数据库平台检索茯苓的化学成分和作用靶点。通过UniProt数据库查询靶点对应的基因,使用STRING构建共同靶点互作网络(PPI);进而运用Cytoscape 3.7.2软件构建茯苓活性成分-鼻咽癌-靶点互作网络图,通过R软件编程进行GO功能富集分析和 KEGG 通路富集分析,最后采用MTT和Western blot法进行验证。结果 茯苓活性成分-鼻咽癌-靶点网络包含8个活性成分,18个共同靶点,主要富集到4条通路。茯苓的主要抗鼻咽癌活性成分有茯苓酸、茯苓新酸B、常春藤皂甙等,出现频次较高的靶点有TP53、INS、ESR1、PTGS2等,这些靶点主要涉及细胞因子活性、免疫炎症系统和肿瘤细胞增殖、凋亡、迁移等生物过程,且靶点主要富集在甲状腺激素信号通路、雌激素信号通路、PI3K/AKT等信号通路。MTT结果显示,与对照组比较,茯苓酸组(2.5、5.0、10 μmol·L-1)对CNE2细胞增殖具有明显抑制作用(P<0.05或P<0.01)。Western blot结果显示,药物处理24 h后,与对照组比, 茯苓酸组(5.0 μmol·L-1)降低了CNE2细胞PI3K/AKT信号通路关键蛋白PI3K、p-AKT的表达水平(P<0.05或P<0.01),对AKT的表达无明显差异性(P>0.05)。结论 茯苓可通过多成分、多靶点和多通路影响鼻咽癌细胞的增殖。且经实验验证,茯苓抑制鼻咽癌细胞增殖的作用与抑制PI3K/AKT信号通路的活性相关。
〔关键词〕 网络药理学;茯苓;鼻咽癌;分子机制
〔中图分类号〕R273 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.09.012
Network Pharmacology Analysis and Verification of the Material Basis and Potential
Mechanism of Fuling (Poria) Against Nasopharyngeal Carcinoma
CHENG Bo1,2, FAN Jingying1,2, LIU Jie1, SU Rui1, ZHOU Fangliang1,3, HUANG Ruoru1, WANG Xianwen2,4, HE Yingchun1,2,3*
(1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Hunan Provincial Ophthalmology and Otolaryngology Diseases Prevention and Treatment with Traditional Chinese Medicine and Visual Function Protection Engineering and Technological Research Center, Changsha, Hunan 410208, China; 3. Hunan Provincial Key Laboratory for the Prevention and Treatment of Ophthalmology and Otolaryngology Diseases with Traditional Chinese Medicine, Changsha, Hunan 410208, China; 4. The First Affiliated Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Objective To verify the material basis and potential mechanism of Fuling (Poria) against nasopharyngeal carcinoma by network pharmacology prediction and experiment. Methods The chemical constituents and targets of Fuling (Poria) were searched by traditional Chinese medicine system pharmacology (TCMSP) database and BATMAN-TCM database. UniProt database was used to query the genes corresponding to the target, and STRING was used to construct the common target interaction network (PPI). The PPI of Fuling (Poria) active ingredient-nasopharyngal carcinoma-target was constructed by using Cytoscape 3.7.2 software. GO function enrichment analysis and KEGG pathway enrichment analysis were carried out by R software programming. Finally, MTT and Western blot were used to verify the results. Results Fuling (Poria) active component-nasopharyngeal carcinoma-target network contained 8 active components and 18 common targets, mainly enriched into 4 pathways. The main anti nasopharyngeal carcinoma active components Fuling (Poria) were pachymenic acid, pachymenic acid B, ivy saponins, etc. The high frequency targets were TP53, INS, ESR1, PTGS2, etc. These targets were mainly related to cytokine activity, immune inflammatory system, tumor angiogenesis, tumor cell proliferation, apoptosis, migration, etc. These targets were mainly enriched in thyroid hormone signaling pathway, estrogen signaling pathway, PI3K/AKT signaling pathway, etc. MTT results showed that compared with the control group, the proliferation of CNE2 cells was significantly inhibited in Fuling (Poria) groups (2.5, 5.0, 10 μmol·L-1) (P<0.05 or P<0.01). Western blot results showed that compared with control group, Fuling (Poria) group (5.0 μmol·L-1) decreased the expression levels of PI3K and p-AKT, the key proteins of PI3K/AKT signaling pathway in CNE2 cells after treated for 24 hours (P<0.05 or P<0.01), but there was no significant difference in the expression of AKT(P>0.05). Conclusion Fuling (Poria) can affect the proliferation of nasopharyngeal carcinoma cells through multiple components, multiple targets and multiple pathways. It was confirmed that the inhibitory effect of Fuling (Poria) on nasopharyngeal carcinoma cells proliferation was related to the inhibition of PI3K/AKT signaling pathway.
〔Keywords〕 network pharmacology; Fuling (Poria); nasopharyngeal carcinoma; molecular mechanism
鼻咽癌(nasopharyngeal carcinoma, NPC)是临床常见的头颈部恶性肿瘤之一,其恶性程度高,70%的患者被确诊时已为晚期[1-2]。以放疗和化疗相结合的综合治疗是目前治疗NPC的主要方法,但复发和远处转移仍是治疗失败的主要原因[3]。目前,中医药抗肿瘤药物日益受到关注,因其与化疗药物相比,在抑杀肿瘤细胞的同时,具有毒副作用小、不易产生耐药性等特点[4]。
中药茯苓Poria cocos (Schw.) Wolf.属多孔菌科真菌茯苓的干燥菌核[5],其主要分布在我国安徽、福建、河南、四川、云南、贵州、湖北和广东、广西等地[6]。茯苓载于《神农本草经》,其性味甘、淡、平,归心、肺、脾、肾经,具有健脾宁心、利水渗湿等功效。现代药理学研究[7]发现,茯苓的主要化学成分为三萜类和多糖类,具有抗炎、抗肿瘤、利尿、调节免疫功能等多种药理作用。课题组前期研究发现茯苓酸能抑制鼻咽癌细胞增殖,并能降低增殖相关蛋白生存素、X染色体连锁的凋亡抑制蛋白、增殖细胞核抗原的表达水平[8],但茯苓抗NPC的物质基础及分子机制尚不清楚。
因此,本研究基于网络药理学,构建了茯苓的活性成分、NPC与药物靶点之间的相互作用网络,并进行实验验证,为揭示茯苓抗NPC的物质基础和潜在分子机制提供参考。
1 材料与方法
1.1 茯苓活性成分的筛选
应用TCMSP数据库(http://lsp.nwu.edu.cn/tcmsp.php)及BATMAN-TCM数据库(http://bionet.ncpsb.org/batman-tcm/)检索茯苓的所有活性成分。根据研究结果,以口服生物利用度(oral bioavailability,OB)≥30%、类药性(Drug-likeness,DL)≥0.18为限制条件进行筛选,得到茯苓的生物活性成分。
1.2 活性成分-靶点互作网络构建
应用TCMSP数据库及BATMAN-TCM数据库平台检索茯苓所有活性成分的靶基因,并应用Perl语言程序结合UniProt数据库(https://www.uniprot.org)对茯苓活性成分的靶点进行标准化,获得标准化的靶点。通过Cytoscape 3.7.1软件(https://cytoscape.org/)构建活性成分-靶点互作网络,以探究茯苓的药理学作用机制。
1.3 鼻咽癌的疾病靶点筛选
以“nasopharynx cancer”为检索关键词,通过GeneCards数据库(https://www.genecards.org/)及OMIM 数据库(https://www.omim.org/)检索NPC的疾病靶点,并将两个数据库检索出来的疾病靶点进行合并。
1.4 活性成分与疾病的共同靶点筛选及PPI网络构建
篩选NPC的疾病靶点与茯苓活性成分的靶点之间的共同靶点,应用R软件(https://www.r-project.org/)编程进行筛选,并绘制韦恩图。应用STRING(https://string-db.org/)插件构建共同靶点互作网络(protein-protein interaction, PPI),参数保持默认设置,获得PPI网络。
1.5 活性成分-鼻咽癌-靶点互作网络构建
应用Cytoscape 3.7.1软件构建活性成分-NPC-靶点互作网络,查阅文献,基于构建的网络探讨茯苓对鼻咽癌疗效的潜在分子机制。
1.6 Gene Ontology(GO)生物功能分析和KEGG Pathway富集
应用R软件(https://www.r-project.org/)编程获得NPC与茯苓活性成分的共同靶点的entrez ID,接着对共同靶点进行GO分析和KEGG Pathway富集分析,GO分析主要用于描述基因产物的功能,KEGG Pathway富集分析主要用于分析核心通路富集程度,进一步探索茯苓抗NPC可能的生物功能及信号通路机制。
1.7 细胞实验验证
人鼻咽癌CNE2细胞购自北京北纳创联生物技术研究院,由本实验室传代培养。茯苓酸购自上海金穗生物科技有限公司;顺铂(Cisplatin),齐鲁制药有限公司(货号:H20023460)。采用不同浓度(0、2.5、5.0、10、20 μmol·L-1)的茯苓酸、阳性对照药顺铂(Cisplatin,4 mg·L-1)处理鼻咽癌细胞24、48、36 h,使用MTT法检测处理后细胞的增殖情况。用不同浓度(0、2.5、5.0 μmol·L-1)的茯苓酸干预细胞24 h,采用Western blot法检测茯苓酸对鼻咽癌细胞PI3K/AKT信号通路相关蛋白的表达水平。具体方法参考文献[9-10]进行。
1.8 统计学分析
采用SPSS 26.0统计软件处理,计量资料实验数据服从正态分布,数据以“x±s”表示。单因素设计和多组间计量资料比较采用单因素方差分析,多重比较则采用LSD法,P<0.05认为差异有统计学意义。结果分析图由GraphPad Prism 8.0软件制作完成。 2 结果
2.1 茯苓活性成分筛选
通过TCMSP、BATMAN-TCM数据库对茯苓的活性成分进行检索,并以OB≥30%和DL≥0.18为限制条件进行筛选,去掉重复成分后共得到17个生物活性成分。结果见表1。
2.2 活性成分-靶点互作网络构建
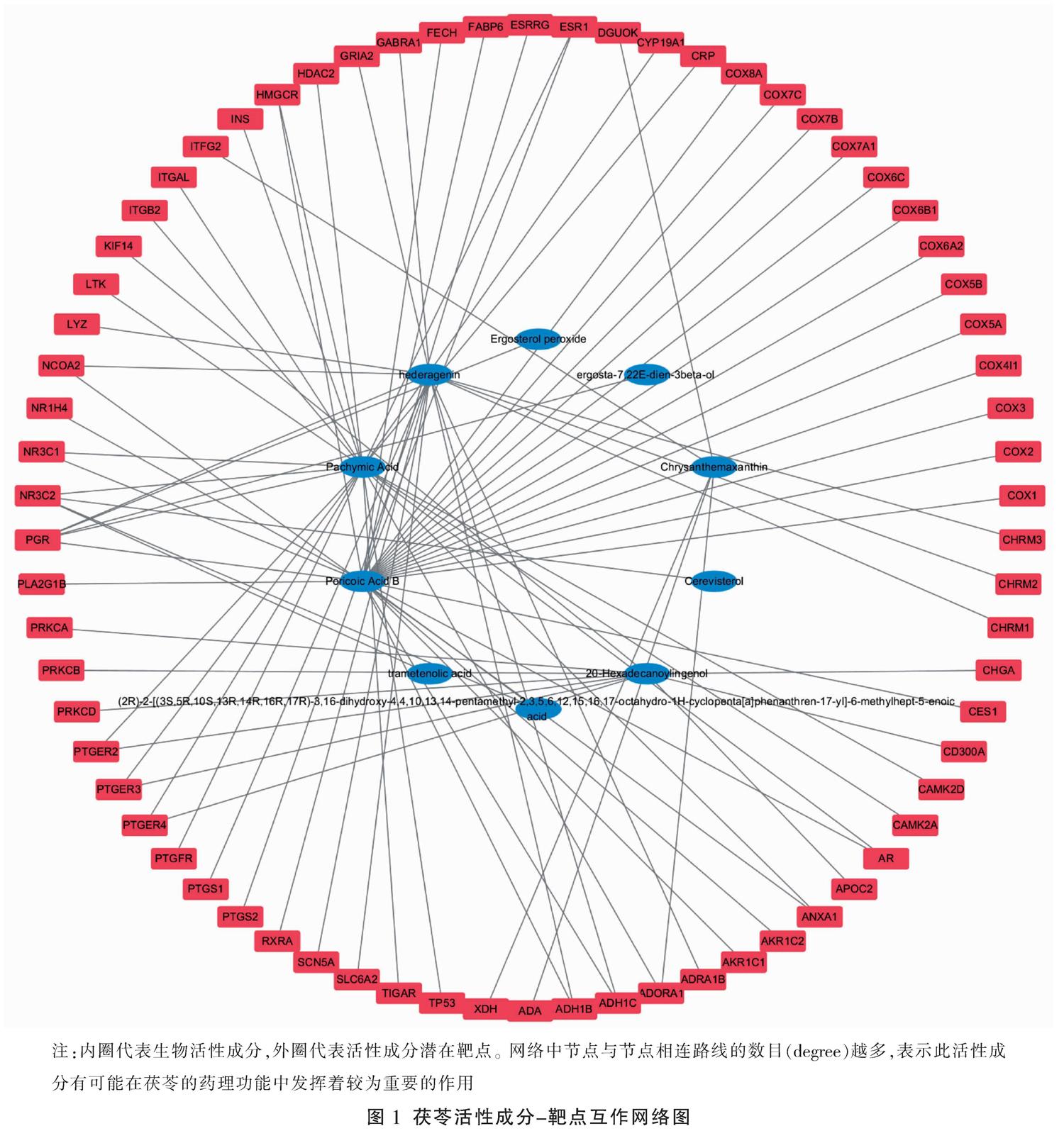
通过上述数据库筛选,由Cytoscape 3.7.1软件可获得与茯苓相关的活性成分的作用靶点共70个(不含重复),构建活性成分-靶点互作网络。其中排名前3的是:MOL000291(poricoic acid B,茯苓新酸B),其degree为29;MOL000289(pachymic acid,茯苓酸),其degree为23;MOL000296(hederagenin,常春藤皂甙元),其degree为16。见图1。
2.3 鼻咽癌的疾病靶点筛选
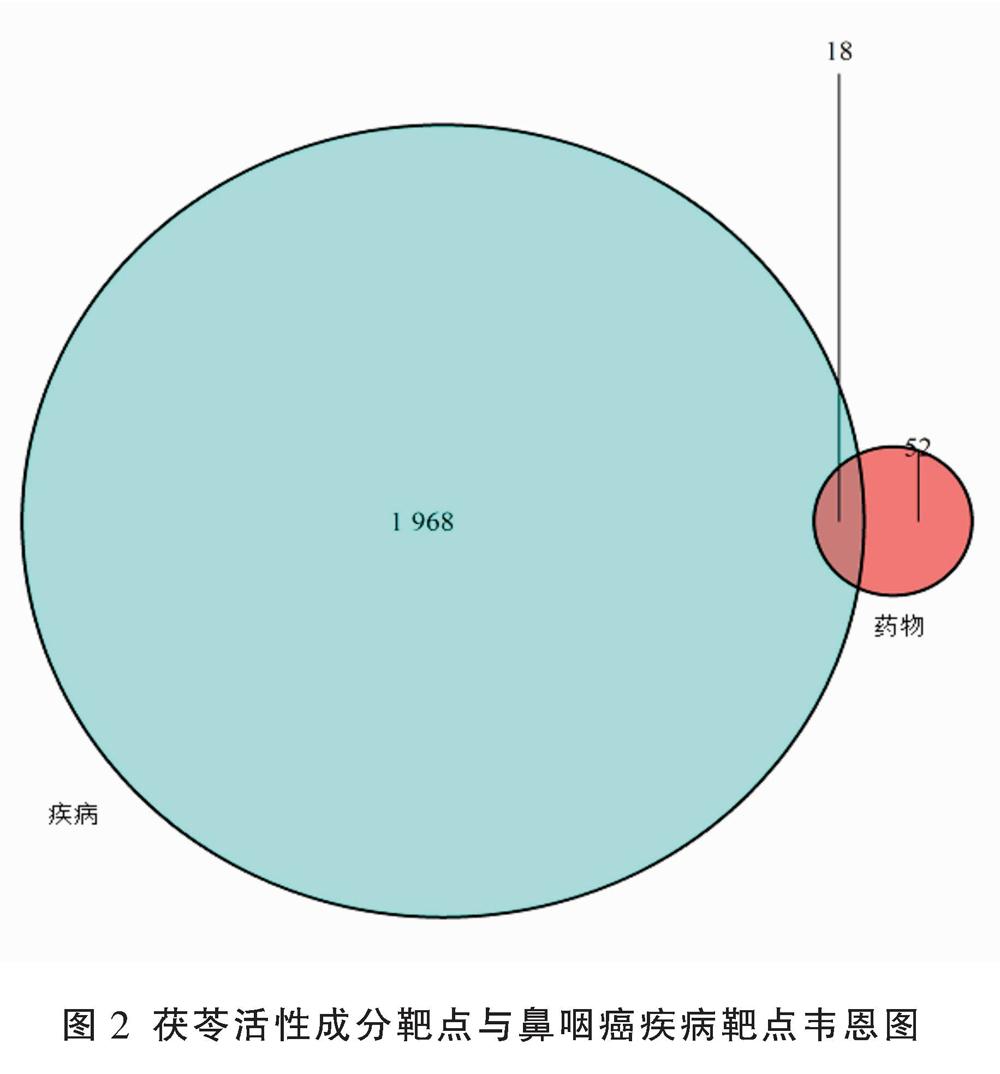
通过检索GeneCards、OMIM数据库得到NPC的疾病治疗靶点,不设置Relevance score,并删去重复靶点,共得到1 968个NPC的疾病治疗靶点。
2.4 共同靶点筛选及互作网络构建
将1 968个NPC的疾病治疗靶点与70个药物活性成分作用靶点应用R软件编程筛选出共同靶点并画出韦恩图,得到共同靶点为18个,得到的韦恩圖见图2;应用STRING数据平台输入18个共同靶点,默认设置下构建互作网络(PPI),见图3。应用R软件编程统计各靶点出现频次,出现频次较高的有TP53、INS、ESR1、PTGS2等,可作为茯苓治疗NPC的潜在靶点,见图4。
2.5 活性成分-鼻咽癌-靶点互作网络构建
采用Cytoscape 3.7.1软件在活性成分-NPC-靶点互作网络图中,共获得28个节点(靶点18个,活性成分8个,疾病和药物各1个),见图5。在图中我们可以看出排名前3的活性成分为pachymic acid(茯苓酸)、hederagenin(常春藤皂甙元)、poricoic acid B(茯苓新酸B) 。
2.6 茯苓治疗鼻咽癌的生物功能(GO)分析及核心通路筛选
并利用R软件编程对以上共同靶点进行GO功能分析得到的柱状图见图6,其靶点主要涉及细胞因子活性、免疫炎症系统和肿瘤细胞增殖、凋亡、迁移等生物过程。这体现了茯苓可能通过调控多个生物过程来治疗NPC。图7显示了茯苓作用靶点的KEGG Pathway富集分析结果,表2中列出了富集靶点数目≥4的信号通路,这表示茯苓主要通过作用于4条信号通路来治疗NPC。
2.7 实验结果
2.7.1 MTT检测茯苓酸对CNE2细胞增殖的影响
MTT结果显示,与对照组比较,不同浓度茯苓酸组(2.5、5.0、10 μmol·L-1)和顺铂4 mg·L-1组分别作用 CNE2细胞24、36、48 h后,对CNE2细胞增殖具有明显抑制作用,差异均具有统计学意义(P<0.05或P<0.01)。见图8。
2.7.2 Western blot法检测茯苓酸对鼻咽癌细胞PI3K/AKT信号通路的影响 药物处理24 h后,与对照组比,茯苓酸5.0 mol·mL-1组降低了PI3K/AKT信号通路关键蛋白PI3K、p-AKT的表达水平(P<0.05或P<0.01),对AKT的表达无明显差异性(P>0.05)。见图9。
3 讨论
NPC是一种上皮源性恶性肿瘤,是我国南方各省常见的头颈部恶性肿瘤之一,目前其主要治疗方法为放化疗[11]。茯苓以三萜类和多糖类为主要化学成分,现代药理学研究发现[7],其具有抗炎、抗肿瘤和调节免疫功能等多种药理作用。
网络药理学通过蛋白质组学、基因组学、生物信息学等数据库检索,从分子和整体水平进行中药的系统分析,获得中药的核心化学成分-蛋白靶标,明确中药的作用机制,为中药研究提供新的思路[12]。本研究基于网络药理学,通过数据库筛选,共获得茯苓17个生物活性成分,通过构建活性成分-靶点互作网络,得到与茯苓相关的活性成分的作用靶点共70个,并获得茯苓酸、茯苓新酸B和常春藤皂甙元等关键活性成分。近年来研究发现:茯苓酸可通过抑制线粒体途径来诱导胃癌细胞凋亡[13],且茯苓酸也可诱导人膀胱癌细胞T24凋亡[14]。
对茯苓与鼻咽癌的共同靶点进行PPI映射,并构建茯苓活性成分-NPC-靶点网络,发现出现频次较高的靶点有TP53、INS、ESR1、PTGS2等,这些靶点主要涉及细胞因子活性、免疫炎症系统、肿瘤新生血管形成和肿瘤细胞增殖、凋亡、迁移等,这些生物过程在鼻咽癌的发生发展中均具有重要作用。文献报道,鼻咽癌组织内存在TP53基因突变[15-16],其可通过调控Bcl-2和Bax的表达,阻滞细胞周期,诱导细胞衰老或凋亡[17]。PTGS2即为环氧合酶COX-2的别称,研究发现沉默COX-2的表达,可阻滞细胞周期,抑制鼻咽癌细胞的增殖能力[18]。KEGG通路富集分析显示靶点主要富集在甲状腺激素信号通路、雌激素信号通路、PI3K/AKT等信号通路。研究证实,PI3K/AKT信号通路在鼻咽癌、胃癌和肝癌等多种癌症发挥关键作用,该通路参与血管生成和细胞增殖、分化、迁移、凋亡等调节[19]。
最后,本研究团队的实验结果表明,茯苓酸能明显抑制鼻咽癌CNE2细胞增殖(P<0.05或P<0.01),且明显降低了PI3K/AKT信号通路关键蛋白PI3K、p-AKT的表达水平(P<0.05或P<0.01),提示茯苓酸可能是通过抑制PI3K/AKT信号通路实现抑制鼻咽癌细胞增殖的效应。综上所述,本研究系统预测了茯苓抗NPC的作用机制,证实茯苓酸是茯苓抗NPC的物质基础之一,PI3K/AKT信号通路是其发挥抗NPC作用的重要机制之一,为茯苓临床干预NPC提供了一定的理论依据。
参考文献
[1] 何文龙,吕 炎,胡云扬,等.放射联合药物治疗鼻咽癌的现状[J].实用癌症杂志,2019,34(2):346-348.
[2] PETERSSON F. Nasopharyngeal carcinoma: A review[J]. Seminars in Diagnostic Pathology, 2015, 32(1): 54-73.
[3] 邱元正,刘 超,李 果.鼻咽癌放射治疗的现状与对策[J].中国耳鼻咽喉颅底外科杂志,2015,21(6):435-438.
[4] 黄自丽,黄修燕,郑 起.中药抗肿瘤作用及其作用机制研究进展[J].医学综述,2010,16(3):386-389.
[5] 张 敏,高晓红,孙晓萌,等.茯苓的药理作用及研究进展[J].北华大学学报(自然科学版),2008,9(1):63-68.
[6] 中国药科大学.中药辞海[M].北京:中国医药科技出版社,1996:1272-1278.
[7] 金 惠,趙英博,江 维,等.茯苓药理作用及临床应用研究进展[J]. 湖北中医杂志,2008,30(4):59-61.
[8] 刘 洁,胡 晶,戴 娜,等.益气解毒方主要三萜类化合物抑制鼻咽癌 CNE2 细胞增殖效应的比较[J].湖南中医药大学学报,2019,39(11):1315-1320.
[9] ZHOU F L, HU J, DAI N, et al. Berberine and ginsenoside Rg3 act synergistically via the MAPK/ERK pathway in nasopharyngeal carcinoma cells[J]. Journal of Functional Foods, 2020, 66: 103802.
[10] 熊 雨,刘 洁,邹 攀,等.益气解毒方中苯丙素类化合物对鼻咽癌细胞增殖效应的影响[J].湖南中医药大学学报,2021,41(5):701-706.
[11] 邹 攀,刘 洁,许红淼,等.基于网络药理学探讨黄连和黄芪治疗鼻咽癌的作用机制[J].中国新药与临床杂志,2021,40(4):276-281.
[12] 刘鑫馗,吴嘉瑞,张 丹,等.基于网络药理学的参附汤作用机制分析[J].中国实验方剂学杂志,2017,23(16):211-218.
[13] LU C W, MA J, CAI D F. Pachymic acid inhibits the tumorigenicity of gastric cancer cells by the mitochondrial pathway[J]. Anti-Cancer Drugs, 2017, 28(2): 170-179.
[14] JEONG J W, BAEK J Y, KIM K D, et al. Induction of apoptosis by pachymic acid in T24 human bladder cancer cells[J]. Journal of Life Science, 2015, 25(1): 93-100.
[15] LI H, HAN W N, ZHANG L, et al. Possible reasons for TP53 accumulation in nasopharyngeal carcinoma using atlas human cancer cDNA expression array[J]. Chinese Journal of Cancer Research, 2002, 14(1): 28-32.
[16] 谢 奕,姚开泰,胡维新.鼻咽癌、宫颈癌和肺癌中p53基因突变和表达的对比研究[J].中华病理学杂志,1997,26(4):38-41.
[17] BYKOV V J N, ERIKSSON S E, BIANCHI J L, et al. Targeting mutant p53 for efficient cancer therapy[J]. Nature Reviews Cancer, 2018, 18(2): 89-102.
[18] 李 刚,李湘平,陈顺金,等.RNA干扰沉默COX-2对鼻咽癌细胞增殖、凋亡及细胞周期的影响[J].广东医学,2009,30(1):45-48.
[19] 成南南,杨萌哲,杨建宇,等.基于网络药理学探讨野菊花治疗鼻咽癌的可能作用机制[J/OL].基因组学与应用生物学:1-15[2021-09-16].
http://kns.cnki.net/kcms/detail/45.1369.q.20201207.1400.002.html.
