运动对急性TCDD暴露大鼠血清Th1/Th2细胞因子平衡的影响
2021-09-23王娟娟闫会萍杜乐宋小波陆一帆
王娟娟,闫会萍,2,杜乐,宋小波,陆一帆,2,*
1. 北京体育大学运动医学与康复学院,北京 100084 2. 国家体育总局运动应激与适应重点实验室,北京 100084 3. 华中师范大学体育学院,武汉 430079
二噁英类化合物(doxin-like compounds, DLC)是一种普遍存在的亲脂性持久性有机污染物(persistent organic pollutants, POPs),其在人体半衰期长达5~10 a(平均7 a)。因此,一次暴露,可在人体长期存在;长期暴露可导致其在体内蓄积,导致严重损害。2,3,7,8-四氯二苯并对二噁英(2,3,7,8-tetrachlorodibenzo-p-dioxin, TCDD)是二噁英中毒性最强的一种,也是目前在持久性有机污染物中研究最为广泛也是最为深入的物质[1]。研究发现,免疫系统是TCDD毒性最敏感的靶点之一[2],TCDD是已知最有效的免疫抑制化学物质之一[3]。但是TCDD的免疫毒性机制尚不完全清楚,AhR通路是介导TCDD毒性的主要途径[4]。TCDD的免疫毒性可能与TCDD诱导的免疫细胞失衡(Th细胞分化和成熟障碍,Treg细胞亚群减少等)[5]、表观遗传学改变(DNA甲基化、AhR依赖性组蛋白修饰等)等有关[6]。
运动也可以对免疫系统产生深远的影响,运动对免疫参数的影响取决于运动强度,在高水平运动中,则取决于训练的持续时间和负荷[7]。虽然高强度的运动是否独立于其他因素而抑制免疫功能尚存争议,但定期进行中到大强度的运动有益于提升免疫功能。研究表明,规律的运动可以降低传染性疾病(如细菌和病毒感染)和非传染性疾病(如癌症和慢性炎症性疾病)的发病率,提高免疫能力[8-10],还能延缓免疫衰老的发生[11]。这可能与运动降低系统性炎症水平、提升免疫调节能力以及改善免疫细胞代谢等有关。
多数研究仅针对单种因素对免疫功能的影响,而现实中免疫功能受多种因素的综合影响,因此,通过动物模型试验探究TCDD和运动对免疫功能的交互影响具有一定的意义。
Th1和Th2细胞均是辅助型T细胞的亚群。Th1/Th2平衡是机体细胞免疫与体液免疫平衡的标志,Th1和Th2型细胞因子分泌的改变是Th1/Th2平衡常用的评价依据[12]。Th1细胞分泌干扰素-γ(IFN-γ)和肿瘤坏死因子(TNF)等细胞因子,主要介导细胞免疫应答,在抗胞内病原体感染中发挥重要作用;Th2细胞分泌白细胞介素-4(IL-4)、白细胞介素-5(IL-5)、白细胞介素-10(IL-10)和白细胞介素-13(IL-13)等细胞因子,与B细胞增殖、分化和成熟及抗体的生成有关,主要增强体液免疫[12-13]。白细胞介素-12(IL-12)是刺激Th1分化和分泌功能主要细胞因子。正常情况下,Th1和Th2细胞分泌的细胞因子促进自身增殖的同时抑制对方的增殖,因此Th1和Th2处于动态平衡中,一旦Th1细胞和Th2细胞之间的平衡状态被打破,很可能造成人体细胞因子网络的动态平衡被破坏,与许多疾病如1型糖尿病、过敏、哮喘和癌症的产生和发展有关[12]。环境因素、压力、运动和某些营养物质等因素均是改变Th1/Th2平衡的因素。
研究发现,TCDD可通过激活AhR影响免疫功能,使Th1/Th2向Th2极化[14]。运动改变Th1/Th2平衡可能与运动强度有关,剧烈运动使Th1/Th2向Th2极化而抑制免疫[15-18];中等强度运动使Th1/Th2向Th1极化而增强免疫[19-22];低强度自愿转轮运动不足以影响Th1/Th2平衡[23]。但是尚未发现TCDD与运动对Th1/Th2平衡交互影响的研究。本研究以Th1/Th2平衡为切入点,研究TCDD与运动对免疫健康的交互影响,从而有助于理解运动与环境污染物对机体健康的交互影响,指导科学健身实践。
1 材料与方法(Materials and methods)
1.1 实验对象及分组
28只8周龄SPF级雄性Wistar大鼠(购自北京维通利华实验动物中心,许可证号SCXK(京)2006-00098),体重(338.32±16.74) g,进行适应性饲养1周。随后将大鼠随机分成4组:正常对照组(Normal Control, NC)、TCDD对照组(Toxic Control, TC)、运动对照组(Exercise Control, EC)、TCDD运动组(Exercise Toxic, ET),每组7只。各组大鼠分笼饲养,饲养温度22.75 ℃±1.33 ℃,湿度50.57%±7.53%,昼夜交替时间12 h,提供国家标准啮齿类动物饲养饲料,自由饮食、饮水。本研究已经通过了清华大学动物福利伦理委员会审批。
1.2 TCDD暴露及运动方案
将TCDD(购自美国Cambridge Isotope Laboratories Inc,纯度99%)溶于玉米油中,TC组和ET组大鼠以10 μg·kg-1体重的剂量腹腔注射TCDD,NC组和EC组大鼠腹腔注射等量玉米油。
EC组和ET组大鼠尾部负重5%(尾根套负重螺丝)进行游泳,每天游30 min,每周游6 d,持续4周,每天游泳时间固定,根据每周称重调整负重。游泳水桶直径150 cm,水深75 cm,水温为32 ℃±2 ℃。NC组与TC组大鼠静养。
1.3 实验取材
所有大鼠均在运动组大鼠最后一次运动结束48 h后进行取材。取材前禁食8 h,称重并记录。用20%(w/v)的乌拉坦,按照2 g·kg-1体重的剂量,腹腔注射麻醉。打开大鼠腹腔,腹主动脉取血,离心后分离血清,-20 ℃冻存备用。快速分离大鼠胸腺和脾,生理盐水浸洗,滤纸吸干,称重并记录,计算胸腺相对重量=胸腺重量/体重,脾相对重量=脾重量/体重。
1.4 血清指标测试
采用Elisa法测定大鼠血清细胞因子:TNF-α、IFN-γ、IL-12和IL-13浓度,并计算IFN-γ/IL-13和IL-12/IL-13比值。试剂盒购自美国Rapidbio公司,严格按照说明书进行操作。用英国Biochrom公司Anthos2010型酶标仪读取吸光度,计算细胞因子浓度。
1.5 统计分析

2 结果(Results)
2.1 运动对TCDD暴露大鼠胸腺和脾相对重量的影响
TCDD暴露对胸腺相对重量(F=24.373,P=0.000,偏Eta方=0.504)有主效应,可明显减小胸腺相对重量。运动对胸腺相对重量(F=2.769,P=0.109,偏Eta方=0.103)无主效应。运动和TCDD暴露对胸腺相对重量(F=0.065,P=0.801,偏Eta方=0.003)无交互主效应。两两比较发现,与NC组相比,TC组大鼠胸腺相对重量明显减小(P<0.01);与EC组相比,ET组大鼠胸腺相对重量明显减小(P<0.01),结果如图1所示。

图1 运动对2,3,7,8-四氯二苯并对二噁英(TCDD) 暴露大鼠胸腺相对重量的影响注:NC表示正常对照组,EC表示运动对照组,TC表示TCDD 对照组,ET表示TCDD运动组;第1个字母代表相同暴露 条件下不同运动干预的差异,第2个字母代表相同运动 干预条件下不同暴露的差异,不同的字母代表P<0.05。Fig. 1 The effect of exercise on the relative weight of thymus of rats exposed to 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD)Note: NC stands for normal control group; EC stands for exercise control group; TC stands for toxic control; ET stands for exercise toxic group; the first letter represents the difference between different exercise interventions under the same exposure condition, and the second letter represents the difference between different exposures under the same exercise intervention; different letters indicate significant differences at P<0.05.
TCDD暴露对脾相对重量(F=7.328,P=0.012,偏Eta方=0.234)有主效应,可明显增大脾脏相对重量。运动对脾相对重量(F=0.874,P=0.359,偏Eta方=0.035)无主效应。运动和TCDD暴露对脾相对重量(F=0.000,P=0.999,偏Eta方=0.000)无交互主效应。两两比较发现,与NC组相比,TC组大鼠脾相对重量有增大的趋势(P=0.067);与EC组相比,ET组大鼠脾相对重量有增大的趋势(P=0.068),结果如图2所示。

图2 运动对TCDD暴露大鼠脾相对重量的影响Fig. 2 The effect of exercise on the relative weight of spleen of rats exposed to TCDD
2.2 运动对TCDD暴露大鼠血清细胞因子的影响
TCDD暴露对血清TNF-α(F=9.180,P=0.006,偏Eta方=0.277)有主效应,可明显降低血清TNF-α浓度。运动对血清TNF-α(F=0.336,P=0.567,偏Eta方=0.014)浓度无主效应。运动和TCDD暴露对血清TNF-α(F=0.010,P=0.920,偏Eta方=0.000)浓度均无交互效应。两两比较发现,与NC组相比,TC组血清TNF-α浓度明显降低;与EC组相比,ET组血清TNF-α浓度明显降低,结果如图3所示。

图3 运动对TCDD暴露大鼠血清肿瘤 坏死因子-α(TNF-α)浓度的影响注:第1个字母代表相同暴露条件下不同运动干预的差异,第2个字母 代表相同运动干预条件下不同暴露的差异,不同的字母代表P<0.05。Fig. 3 The effect of exercise on the serum tumor necrosis factor-α (TNF-α) concentration of rats exposed to TCDDNote: The first letter represents the difference between different exercise interventions under the same exposure condition, and the second letter represents the difference between different exposures under the same exercise intervention; different letters indicate significant differences at P<0.05.
TCDD暴露对血清IFN-γ(F=0.187,P=0.669,偏Eta方=0.008)浓度无主效应。运动对血清IFN-γ(F=0.195,P=0.663,偏Eta方=0.0080)浓度无主效应。运动和TCDD暴露对血清IFN-γ(F=0.668,P=0.422,偏Eta方=0.027)浓度无交互效应,结果如图4所示。

图4 运动对TCDD暴露大鼠 血清干扰素-γ(IFN-γ)浓度的影响Fig. 4 The effect of exercise on the serum interferon-γ (IFN-γ) concentration of rats exposed to TCDD
TCDD暴露对血清IL-12(F=9.702,P=0.005,偏Eta方=0.288)浓度有主效应,可明显降低血清IL-12浓度。运动对血清IL-12(F=0.195,P=0.663,偏Eta方=0.0080)浓度无主效应。运动和TCDD暴露对血清IL-12(F=0.668,P=0.422,偏Eta方=0.027)浓度无交互效应。两两比较发现,与NC组相比,TC组血清IL-12浓度明显降低,结果如图5所示。

图5 运动对TCDD暴露大鼠血清白细胞 介素-12(IL-12)浓度的影响注:第1个字母代表相同暴露条件下不同运动干预的差异,第2个字母 代表相同运动干预条件下不同暴露的差异,不同的字母代表P<0.05。Fig. 5 The effect of exercise on the serum interleukin-12 (IL-12) concentration of rats exposed to TCDDNote: The first letter represents the difference between different exercise interventions under the same exposure condition, and the second letter represents the difference between different exposures under the same exercise intervention; different letters indicate significant differences at P<0.05.
运动对TCDD暴露大鼠血清Th2相关细胞因子IL-13的影响如图6所示。TCDD暴露对血清IL-13(F=2.736,P=0.111,偏Eta方=0.102)浓度无主效应。运动对血清IL-13(F=0.322,P=0.575,偏Eta方=0.013)浓度无主效应。运动和TCDD暴露对血清IL-13浓度(F=8.201,P=0.009,偏Eta方=0.255)有交互效应。无运动时,TCDD暴露对血清IL-13浓度无明显影响,有运动时TCDD暴露明显降低血清IL-13浓度;无TCDD暴露时运动明显升高血清IL-13浓度,有TCDD暴露时运动对血清IL-13浓度无明显影响。
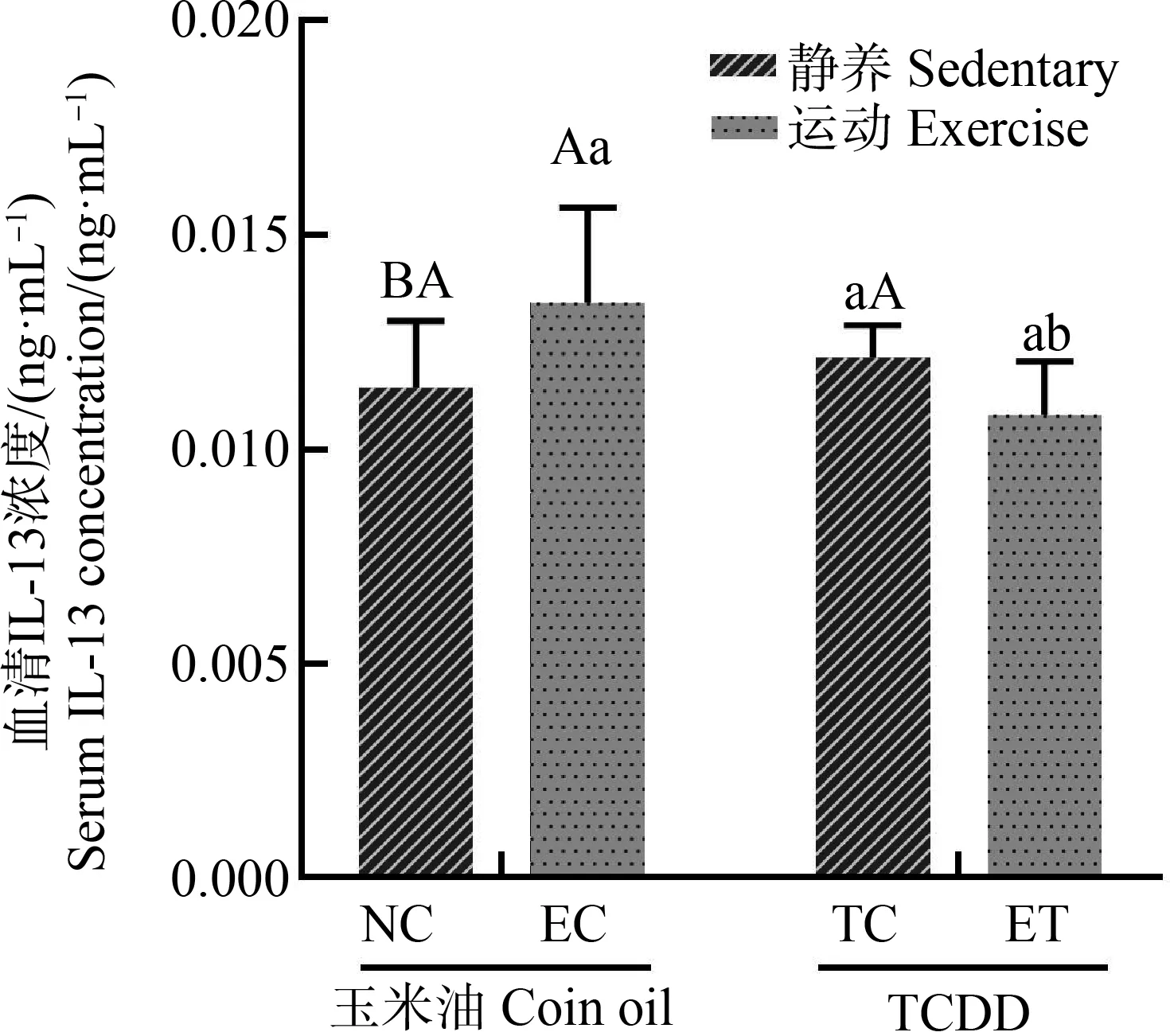
图6 运动对TCDD暴露大鼠血清白细胞 介素-13(IL-13)浓度的影响注:第1个字母代表相同暴露条件下不同运动干预的差异,第2个字母 代表相同运动干预条件下不同暴露的差异,不同的字母代表P<0.05。Fig. 6 The effect of exercise on the serum (IL-13) concentration of rats exposed to TCDDNote: The first letter represents the difference between different exercise interventions under the same exposure condition, and the second letter represents the difference between different exposures under the same exercise intervention; different letters indicate significant differences at P<0.05.
TCDD暴露对IFN-γ/IL-13比值(F=1.354,P=0.256,偏Eta方=0.053)无主效应。运动对IFN-γ/IL-13比值(F=0.014,P=0.908,偏Eta方=0.001)无主效应。运动和TCDD暴露对IFN-γ/IL-13比值(F=4.157,P=0.053,偏Eta方=0.148)无交互效应。两两比较发现,与EC组相比,ET组IFN-γ/IL-13比值明显升高,结果如图7所示。

图7 运动对TCDD暴露大鼠血清细胞 因子(IFN-γ/IL-13)的影响注:第1个字母代表相同暴露条件下不同运动 干预的差异,第2个字母代表相同运动干预条件下不同 暴露的差异,不同的字母代表P<0.05。Fig. 7 The effect of exercise on the IFN-γ/IL-13 ratio of rats exposed to TCDDNote: The first letter represents the difference between different exercise interventions under the same exposure condition, and the second letter represents the difference between different exposures under the same exercise intervention; different letters indicate significant differences at P<0.05.
TCDD暴露对IL-12/IL-13比值(F=2.944,P=0.099,偏Eta方=0.109)无主效应。运动对IL-12/IL-13比值(F=0.002,P=0.969,偏Eta方=0.000)无主效应。运动和TCDD暴露对IL-12/IL-13比值(F=15.262,P=0.001,偏Eta方=0.389)有交互效应。两两比较发现,与NC组相比,TC组和EC组IL-12/IL-13比值明显降低,与TC组相比,ET组IL-12/IL-13比值明显升高,结果如图8所示。
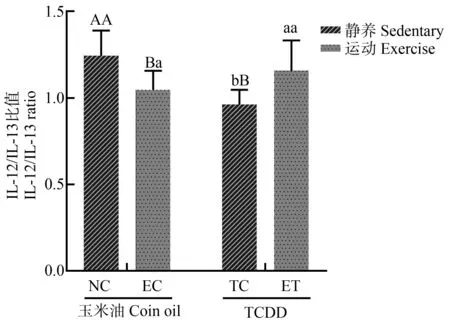
图8 运动对TCDD暴露大鼠血清细胞 因子(IL-12/IL-13)的影响注:第1个字母代表相同暴露条件下不同运动干预的差异,第2个字母 代表相同运动干预条件下不同暴露的差异,不同的字母代表P<0.05。Fig. 8 The effect of exercise on the IL-12/IL-13 ratio of rats exposed to TCDDNote: The first letter represents the difference between different exercise interventions under the same exposure condition, and the second letter represents the difference between different exposures under the same exercise intervention; different letters indicate significant differences at P<0.05.
3 讨论(Discussion)
3.1 运动对TCDD暴露大鼠胸腺相对重量的影响
几乎在所有的被研究过的物种中,TCDD暴露均以依赖AhR的方式导致免疫抑制和胸腺萎缩,但其确切的细胞和分子机制在很大程度上仍是未知的[24-27]。本研究也发现,急性TCDD暴露(10 μg·kg-1)明显减小了大鼠胸腺相对重量,导致胸腺萎缩,说明TCDD暴露抑制了免疫功能。研究发现,中等强度运动没有明显改变胸腺重量[28-29],但是剧烈运动或力竭性运动会导致胸腺萎缩[30-32]。本研究采用负重5%的游泳运动,属于中等强度运动。运动对胸腺相对重量没有主效应,说明4周游泳运动也没有改变胸腺相对重量,这与之前的研究结果一致。运动与TCDD暴露对胸腺相对重量没有交互效应,说明4周游泳运动也不能明显改善TCDD暴露导致的胸腺萎缩。
3.2 运动对TCDD暴露大鼠脾相对重量的影响
目前,关于TCDD暴露对脾相对重量影响的研究结果不一致:TCDD暴露(0.09 μg·kg-1·d-1,28 d)小鼠脾绝对重量和相对重量没有明显变化[33];TCDD暴露(2.5 μg·kg-1,24周)导致小鼠脾肿大,可能与TCDD暴露诱导AKT活化和DNA损伤破坏了脾细胞的生长调节有关[34];急性TCDD暴露(50 μg·kg-1)以AhR依赖的方式导致小鼠脾萎缩[35];围产期TCDD暴露导致子代小鼠脾绝对重量和相对重量下降[36],说明暴露剂量和方式可能是导致结果差异的关键因素。本研究发现,急性TCDD暴露(10 μg·kg-1)4周后大鼠脾相对重量明显增大。研究发现,剧烈运动或力竭性运动导致脾相对重量减小[30-31]。本研究发现,运动对脾相对重量没有主效应,说明5%负重的游泳运动(中等强度)没有改变脾相对重量。运动与TCDD暴露没有交互效应,说明4周游泳运动不能明显改善TCDD暴露所致的脾肿大。
3.3 运动对TCDD暴露大鼠血清Th1/Th2相关细胞因子的影响
之前的研究发现,TCDD可通过激活AhR,使Th1/Th2平衡向Th2极化,而抑制免疫功能[14,37]。本研究发现,急性TCDD暴露(10 μg·kg-1)4周后,血清中Th1相关细胞因子TNF-α和IL-12浓度下降,IFN-γ浓度没有明显变化;血清中Th2细胞因子IL-13浓度没有明显变化;IL-12/IL-13明显减小,说明Th2相关细胞因子相对增加,Th1/Th2向Th2极化。IL-12具有促进Th1分化和分泌细胞因子INF-γ和TNF-α的功能以及抑制Th2分化的功能[12]。在本研究中TCDD暴露导致血清IL-12浓度下降,这可能导致TNF-α分泌减少的同时,也导致对Th2的抑制减少,使IL-13分泌增加不显著。因此,TCDD使Th1/Th2向Th2极化,抑制大鼠的免疫功能。Th1/Th2向Th2极化可能增加感染的易感性[13]。
研究发现,剧烈运动使Th1/Th2向Th2极化而抑制免疫[15-18];中等强度运动使Th1/Th2向Th1极化而增强免疫[19-22];自愿转轮运动不足以影响Th1/Th2平衡[23],这说明,运动改变Th1/Th2平衡可能与运动强度有关,适宜运动才能促进机体免疫健康。因此,本研究选择中等强度运动作为干预手段。运动对血清中Th1/Th2相关的4种细胞因子浓度以及对标示Th1/Th2极化的IFN-γ/IL-13和IL-12/IL-13比值均没有主效应,提示4周游泳运动并不会导致Th1/Th2极化。这与之前的研究得出的中等强度运动使Th1/Th2向Th1极化的结果不一致,可能与实验设计和统计方法不一致有关。有交互效应分析的双因素方差分析能够排除混杂因素导致的显著性差异,本研究中TCDD暴露与否是运动效应的混杂因素。同时,本研究发现,运动和TCDD暴露对血清IL-13浓度以及IL-12/IL-13比值有交互效应,说明虽然急性TCDD暴露后运动没有明显改变血清中Th1相关的细胞因子IFN-γ和IL-12的浓度,但是明显降低了血清中Th2相关的细胞因子IL-13的浓度,从而明显升高了IL-12/IL-13比值,说明急性TCDD暴露后运动使Th1/Th2向Th1方向极化,改善了TCDD暴露大鼠的免疫水平。
综上所述,急性TCDD暴露使大鼠胸腺萎缩,脾肿胀,Th1/Th2相关细胞因子向Th2极化,破坏Th1/Th2相关细胞因子平衡而抑制免疫功能。4周游泳运动虽然不能明显减轻TCDD暴露所致的胸腺萎缩和脾肿胀,但能够在一定程度上减轻TCDD暴露所致的Th1/Th2相关细胞因子失衡而改善免疫功能。
