基于PI3K/AKT通路探究沉默TRAF6对柯萨奇病毒性心肌炎模型小鼠的干预效果
2021-09-23唐智奇杨帆卢东东杨梅苗林方迪海
唐智奇,杨帆,卢东东,杨梅,苗林,方迪海
心肌炎属于临床常见心血管疾病,主要由细菌、病毒、真菌感染或药物、毒素、全身性疾病、自身免疫失调引发。病毒性心肌炎(viral myocarditis,VMC)是由多种嗜心肌病毒引发的心肌非特异性炎性反应[1-2]。据流行病学调查显示, VMC发病率占心肌炎绝大部分,肠道病毒、柯萨奇病毒感染引起的VMC占50%以上。近年来,受社会发展、环境变化等因素影响,其发病率呈逐年上升趋势,以无明显症状的心肌局灶性炎性反应为唯一的临床表现,若未及时接受有效治疗,则会出现心律失常、心源性休克甚至猝死等表现,对患者生命健康造成严重威胁[3-4]。目前,VMC发病机制尚未完全阐明,且目前临床上仍缺乏有效治疗手段及药物[5]。为寻求安全有效的治疗方法,现建立VMC小鼠模型,通过PI3K/AKT通路分析沉默肿瘤坏死因子受体相关分子6(TRAF6)对VMC模型小鼠的干预效果,报道如下。
1 材料与方法
1.1 材料 (1) 动物:选取健康雄性SD小鼠44只,由南京君科生物工程有限公司提供。月龄6~9(7.5±1.3)月,体质量187~219(203.0±13.6)g。饲养环境保持温度(23.1±1.6)℃,相对湿度45%~55%,12 h昼夜交替照明饲养1周。给予标准鼠科动物饲料,不限制饮水、饮食。本研究获得医院伦理委员会批准。(2)试药试剂:柯萨奇病毒(CBV)已在Hela细胞上传代并反复冻融3次后测定半数组织感染剂量为10-3/L;柯萨奇病毒3(CVB3)、总DNA提取试剂盒(伯信生物公司),ago TRAF、antagoTRAF(上海恒斐生物科技有限公司);(3)仪器设备:显微镜(上海永科光学仪器有限公司生产, YKJ-660型);超声心动图仪(上海寰熙医疗器械有限公司,BK flex Focus 1202 );荧光定量PCR仪[赛默飞世尔科技(中国)有限公司,Applied BiOSystems]。
1.2 实验方法
1.2.1 VMC动物模型建立:2019年9月—2020年9月于广西柳州市工人医院实验室进行实验,随机数字表法抽取SD健康小鼠11只不做处理作为正常组。其余小鼠33只建立VMC模型,测定CVB3滴度后,按照剂量经腹腔注射病毒稀释液0.2 ml, 1次/d,连续注射3 d。建模过程中死亡5只,成功28只,将建模成功小鼠随机分为模型组9只,上调组9只,沉默组10只。上调组小鼠尾部静脉注射agoTRAF 630 mg/kg,沉默组小鼠尾部静脉注射antagoTRAF 630 mg/kg,正常组、模型组小鼠尾部静脉注射等剂量0.9%氯化钠溶液进行干预。
1.2.2 标本采集及HE染色:所有小鼠干预1周后取静脉血3 ml,离心获取上层血清,置于-70℃环境下保存。最后一次干预后24 h后断头处死小鼠,分离心脏取心肌组织行常规石蜡包埋及3 μm连续切片。切片烤干后行脱蜡处理,后顺序置于不同浓度酒精中复水3 min;苏木精染色15 min后清洗3次,盐酸酒精分化处理30 s,充分清洗后以1%伊红染色,使用酒精脱水处理后脱蜡包埋,封片后于显微镜下观察。
1.3 观察指标与方法
1.3.1 小鼠心功能检查:小鼠腹腔注射水合氯醛麻醉,胸部备皮,呈左侧卧位,以超声心动图采用标准胸骨旁左心室长轴及短轴二维切面,监测左心室收缩末期内径(LVESD)、左心室舒张末期内径(LVEDD),并计算左心室射血分数(LVEF)。
1.3.2 小鼠血清CK-MB、cTnT、IL-6、TNF-α、IFN-γ、SOD、MDA水平检测:采用酶联免疫吸附法检测。将血清置于室温后,标记酶标板,制作标准品,然后取出试剂盒,以1∶2稀释液稀释样品;在反应孔上依次加入稀释好的待测血清和标准品100 μl/孔,放置37 ℃恒温孵育箱中湿育2 h;然后用专用洗涤液将反应板清洗3次后,再加入抗体工作液(1∶100稀释)100 μl/孔,放于37 ℃恒温孵育箱中湿育45 min;继续清洗反应板4次后,在反应孔内加入肌酸激酶同工酶(CK-MB)、心肌肌钙蛋白(cTnT)、白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)、超氧化物歧化酶(SOD)、丙二醛(MDA)溶液100 μl /孔,置于37℃恒温孵育箱中湿育45 min后在反应孔内加入终止液100 μl /孔终止反应,于酶标测试仪(美国Bio-Tek公司)450 nm处读数,计算CK-MB、cTnT、IL-6、TNF-α、IFN-γ、SOD、MDA水平。
1.3.3 小鼠心肌PI3K、AKT蛋白表达:采用Western-blot法检测。取出小鼠待检心肌组织,用蛋白裂解液及裂解细胞低温离心后取上清,BCA进行蛋白定量检测,在2×SDS凝胶缓冲液中加入蛋白50 μg,在100℃环境中蛋白变性5 min。凝胶电泳、转膜/取膜,置于5%脱脂牛奶中固定、封闭处理1 h,将一抗使用0.05%~0.1% TBST稀释(PPAR-γ、NFAT-4一抗为1∶1 000),4 ℃过夜孵育保存,后使用0.05%~0.1% TBST重复洗膜3次,5 min/次,二抗0.05%~0.1% TBST稀释(1∶10 000),摇动孵育 1 h,再次采用TBST连续洗膜3次,处理5 min。DAB显色,定量分析蛋白表达情况。
1.3.4 小鼠心肌TRAF6 mRNA基因表达检测:使用RT-PCR检测TRAF6 mRNA表达。取出待检心肌组织,提取心肌组织中 TRAF6细胞总RNA,对其纯度、含量进行检测,随后逆转录获得cDNA,使用Primer5.0软件设计引物,引物序列如下,上游引物:5'-GCCGAAATGGAAGCACAG-3';下游引物:5'-GGGCTATGGATGACAACAGG-3',内参U6。设置反转录反应条件:25℃ 10 min,40 ℃ 60 min,85 ℃ 5 min;扩增条件:94 ℃ 20 s、72℃ 30 s、60℃ 30 s,35个循环,采用2-△△Ct方法计算TRAF6 mRNA表达量。

2 结 果
2.1 各组小鼠心肌组织病理比较 正常组心肌纤维排列整齐,细胞间隙清晰;模型组心肌纤维排列紊乱,部分间质纤维化伴断裂,局灶性炎性细胞浸润;上调组心肌细胞排列紊乱、稀疏,间质纤维化,部分出现断裂,局灶性炎性细胞浸润;沉默组心肌纤维排列整齐,部分断裂,细胞间隙正常,见图1。
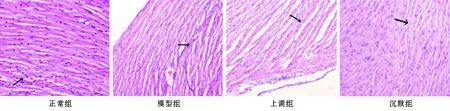
图1 各组小鼠心肌组织病理变化(HE染色,×400)
2.2 各组小鼠心功能比较 与正常组比较,模型组LVESD、LVEDD升高,LVEF降低(P<0.05);与模型组比较,上调组LVESD、LVEDD升高,LVEF降低(P<0.05),沉默组LVESD、LVEDD降低,LVEF升高; 与上调组比较, 沉默组LVESD、LVEDD降低,LVEF升高(P<0.05),见表1。
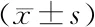
表1 各组小鼠心功能指标比较
2.3 各组小鼠心肌损伤标志物水平比较 与正常组比较,模型组小鼠CK-MB、cTnT水平升高(P<0.05);与模型组比较,上调组CK-MB、cTnT水平升高(P<0.05),沉默组CK-MB、cTnT水平降低;与上调组比较,沉默组CK-MB、cTnT水平降低(P<0.05),见表2。
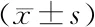
表2 各组小鼠心肌损伤标志物水平比较
2.4 各组小鼠血清炎性因子水平比较 与正常组比较,模型组IL-6、TNF-α、IFN-γ水平升高(P<0.05);与模型组比较,上调组IL-6、TNF-α、IFN-γ水平升高(P<0.05),沉默组IL-6、TNF-α、IFN-γ水平降低;与上调组比较,沉默组CK-MB、cTnT水平降低(P<0.05),见表3。
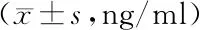
表3 各组小鼠血清炎性因子水平比较
2.5 各组小鼠血清氧化应激指标水平比较 与正常组比较,模型组SOD水平降低,MDA水平升高(P<0.05);与模型组比较,上调组SOD水平降低,MDA水平升高(P<0.05),沉默组SOD水平升高,MDA水平降低;与上调组比较,沉默组SOD水平升高,MDA水平降低(P<0.05),见表4。
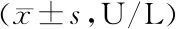
表4 各组小鼠血清氧化应激水平比较
2.6 各组小鼠心肌PI3K、AKT蛋白和TRAF6 mRNA表达比较 与正常组比较,模型组PI3K、AKT蛋白、TRAF6 mRNA表达升高 (P<0.05);与模型组比较,上调组PI3K、AKT蛋白、TRAF6 mRNA表达升高,沉默组PI3K、AKT蛋白、TRAF6 mRNA表达降低(P<0.05);与上调组比较,沉默组PI3K、AKT蛋白、TRAF6 mRNA表达降低 (P<0.05),见表5、图2。
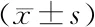
表5 各组小鼠PI3K、AKT蛋白和TRAF6 mRNA表达比较

图2 各组小鼠PI3K、AKT蛋白表达比较
3 讨 论
VMC作为临床常见心血管疾病,病理改变以病毒感染所致心肌细胞变性坏死、间质炎性细胞浸润等为主,进而引发不同程度心功能障碍及全身症状[6]。据流行病学数据显示,在病毒流行感染期间,约有5%患者患有心肌炎,以不同程度的发热、咳嗽、全身酸痛等症状为主要临床表现,也有少数患者出现心力衰竭、心源性休克、猝死等,对患者生命安全造成严重威胁[7-8]。相关资料显示,多种病毒均会导致心肌炎的发生,常见病毒包括肠道病毒、脊髓灰质炎病毒及柯萨奇病毒等。临床证实柯萨奇病毒感染是导致VMC患者突发心脏病并致死的主要原因[9-10]。
相关研究显示,CVB3作为最重要的病原体,在进入机体后其快速复制导致病毒血症发生,进而对心肌间质造成损伤,导致炎性因子大量释放,促进病情发展。目前,VMC发病机制尚不清楚,相关研究显示,病毒侵入刺激的免疫反应在VMC发生发展过程中发挥重要作用[11-12]。通过对小鼠VMC模型研究发现,心肌细胞表面具有特异性CVB3受体,接种CVB3病毒后心肌炎发生可达100%;另有研究显示,在小鼠注射CVB3病毒后,其心肌组织发生明显炎性浸润反应[13-14]。
当心肌损伤发生后胞浆中游离的心肌损伤标志物呈现异常表达。CK-MB、cTnT是临床常见心肌损伤标志物。相关研究显示,在心肌损伤后CK-MB、cTnT迅速升高至原水平的5~10倍,具有极高的敏感度,在临床VMC诊断中对其水平检测具有重要意义[15-16]。
相关研究显示,心肌炎病变的发生发展与炎性因子水平具有密切联系,炎性细胞浸润及心肌损伤是VMC主要病理特点[17-19]。临床常见炎性因子包括IL-6、TNF-α、IFN-γ,在VMC感染初期IL-6水平呈快速上升,产生防御作用。同时,在VMC感染初期TNF-α可被病毒识别作为抗原激活巨噬细胞,高表达TNF-α通过作用相关蛋白导致心肌损伤[20-21]。相关资料显示,正常心肌组织代谢会产生SOD活性氧,在心肌组织受到病毒攻击时大量氧自由基生成,进而消耗SOD清除自由基,使机体内SOD水平降低。同时细胞中氧化自由基数量升高,与不饱和脂肪酸结合生产MDA。由此认定通过对SOD、MDA水平检测能够有效反映细胞损伤程度[22]。
相关研究显示,TRAF6表达具有一定变化规律,且TRAF6 mRNA和蛋白表达与心肌病变病理呈显著正相关。另有研究显示,在健康小鼠心肌组织中TRF6 mRNA蛋白表达量较少,可能通过ERK、PI3K、P38MAPK等信号通路,与生存、分化、增殖及凋亡等多种生物学过程具有密切联系。由此证明在VMC发生发展中TRAF6参与其中,并在CVB3致VMC发病机制中发挥重要作用[23-24]。
综上所述,通过PI3K/AKT通路沉默TRAF6对柯萨奇VMC模型小鼠进行干预,可有效降低炎性反应,减轻心肌损伤程度及提高心功能,为临床治疗柯萨奇VMC提供参考依据。
利益冲突:所有作者声明无利益冲突
作者贡献声明
唐智奇、杨帆、卢东东:设计研究方案、实施研究过程,论文撰写;杨梅、苗林:提出研究思路,分析试验数据,论文审核;方迪海:进行统计学分析
