黄芪注射液中次生成分作用于白细胞减少症模型小鼠的代谢组学研究
2021-09-22曲婷丽刘腾郑茜卢晓林赵正保李震宇
曲婷丽 刘腾 郑茜 卢晓林 赵正保 李震宇
中圖分类号 R285.5 文献标志码 A 文章编号 1001-0408(2021)17-2091-06
DOI 10.6039/j.issn.1001-0408.2021.17.08
摘 要 目的:研究黄芪注射液中次生成分作用于白细胞减少症模型小鼠的代谢组学。方法:将小鼠分为正常组、模型组、黄芪注射液组(0.004 mL/g)及其次生成分低、中、高剂量组(0.004、0.008、0.016 mL/g),每组7只。除正常组外,其余各组小鼠均腹腔注射环磷酰胺(80 mg/kg)以复制白细胞减少症模型。造模成功后,各给药组小鼠腹腔注射相应药物,正常组和模型组小鼠腹腔注射等体积无菌注射用水,每天1次,连续7 d。实验期间,每隔2 d测定小鼠的体质量变化。末次给药后,采用动物血液分析仪检测小鼠的血常规指标[白细胞(WBC)、中性粒细胞(NE)、淋巴细胞(LY)、单核细胞(MO)计数],采用超高效液相色谱-四极杆/静电场轨道阱高分辨质谱法,结合多元统计分析方法,对小鼠血清进行代谢组学分析。结果:与模型组比较,次生成分低剂量组小鼠体质量在给药第4、8天时均显著增加(P<0.05),次生成分各剂量组小鼠血清中WBC、NE、LY、MO计数均显著升高(P<0.05或P<0.01)。经代谢组学分析显示,黄芪注射液中次生成分可显著回调白细胞减少症模型小鼠血清中亚精胺、尿酸、柠檬酸、烟酰胺、二十碳五烯酸、亚油酸、芥酰胺、1-磷酸鞘氨醇等8个差异代谢物的含量,其作用涉及亚油酸代谢途径、烟酸和烟酰胺代谢途径、三羧酸循环途径。结论:黄芪注射液中次生成分具有升高白细胞减少症模型小鼠白细胞的作用,其作用机制可能与干预亚油酸代谢途径、烟酸和烟酰胺代谢途径、三羧酸循环途径有关。
关键词 黄芪注射液;次生成分;代谢组学;白细胞减少症
Metabonomics Study on the Effects of Secondary Components of Astragalus membranaceus Injection on Leukopenia Model Mice
QU Tingli1,LIU Teng1,ZHENG Qian1,LU Xiaolin1,ZHAO Zhengbao1,LI Zhenyu2(1. School of Pharmacy, Shanxi Medical University, Taiyuan 030001, China; 2. Modern Research Center of TCM, Shanxi University, Taiyuan 030006, China)
ABSTRACT OBJECTIVE: To study metabonomics of secondary components of Astragalus membranaceus injection on leukopenia model mice. METHODS: The mice were divided into normal group, model group, A. membranaceus injection group (0.004 mL/g), secondary components low-dose, medium-dose and high-dose groups (0.004, 0.008, 0.016 mL/g), with 7 mice in each group. Except for normal group, other groups were given cyclophosphamide (80 mg/kg) intraperitoneally to induce leukopenia model. After modeling, administration groups were given relevant medicine intraperitoneally, and normal group and model group were given constant volume of sterile water for injection intraperitoneally, once a day, for consecutive 7 days. During the experiment, the changes of body weight of mice were measured every 2 days. After the last administration, the blood routine indexes [white blood cell (WBC), neutrophil (NE), lymphocyte (LY) and monocyte (MO) counts] of mice were detected by animal blood analyzer. UPLC-Q Exactive Orbitrap-HRMS combined with multivariate statistical analysis were used to analyze the metabonomics of mice serum. RESULTS: Compared with model group, body weight of mice in the secondary component low-dose group increased significantly on the 4th and 8th day of administration (P<0.05), and the counts of WBC, NE, LY and MO in serum of mice in secondary component groups increased significantly (P<0.05 or P<0.01). Metabonomic analysis showed that the secondary components of A. membranaceus injection could significantly regulate the contents of 8 endogenous metabolites in serum, including spermidine, uric acid, citric acid, nicotinamide, eicosapentaenoic acid, linoleic acid, erucamide and sphingosine-1-phosphate. Their effects involved linoleic acid metabolism pathway, nicotinic acid and nicotinamide metabolism pathway and tricarboxylic acid cycle pathway. CONCLUSIONS: The secondary components of A. membranaceus injection possess the effect of increasing white blood cells in leukopenia model mice, the mechanism of which may be related to intervention of linoleic acid metabolism pathway, nicotinic acid and nicotinamide metabolism pathway, and tricarboxylic acid cycle pathway.
KEYWORDS Astragalus membranaceus injection; Secondary components; Metabolomics; Leukopenia
黄芪注射液是由黄芪药材经水提醇沉法制备而成,收载于《卫生部药品标准·中药成方制剂(第17册)》(WS3-B-3335-98),具有益气养元、扶正祛邪、养心通脉、健脾利湿等功效[1]。黄芪注射液中的化学成分主要包括初生成分和次生成分:初生成分为通过初级代谢活动所产生的植物体自身生长、发育、繁殖等所必需的物质,如糖类、氨基酸类、有机酸类、核苷类成分等;次生成分是植物次生代谢所产生的一类植物体细胞生命活动和生长发育非必需的少量小分子有机化合物,如生物碱类、皂苷类、黄酮类、萜类成分等[2-11]。临床研究报道,黄芪注射液具有升高患者体内白细胞的作用[12-17],但具体是黄芪注射液中哪类成分发挥的升高白细胞的作用尚不明确。基于此,本课题组采用大孔树脂吸附法,分离黄芪注射液中的次生成分,并采用分析速度快、灵敏度高、分辨率高的超高效液相色谱-四极杆/静电场轨道阱高分辨质谱法(UPLC-Q Exactive Orbitrap-HRMS)[18],研究黄芪注射液中次生成分作用于白细胞减少症模型小鼠的代谢组学,以期为寻找黄芪注射液中具有升高白细胞作用的化学成分奠定基础。
1 材料
1.1 主要仪器与软件
本研究所用主要仪器和软件有:Q Exactive Orbitrap型高分辨液质联用仪(美国Thermo Scientific Q Exactive公司),KDC-149HR型离心机(安徽中科中佳科学仪器有限公司),HEMAVET 950FS型动物血液分析仪(美国Drew Scientific公司),Xcalibur 3.2软件、Compound Discoverer 3.0软件(美国Thermo Fisher Scientific公司),Simca-P 13.0软件(瑞典Umetrics公司)。
1.2 主要药品与试剂
本研究所用主要药品与试剂有:黄芪注射液(正大青春宝药业有限公司,批号1807163,规格10 mL/支),注射用环磷酰胺(德国Baxter Oncology GmbH 公司,批号8J270A,规格 0.2 g),D101大孔吸附树脂(成都市科隆化学品有限公司,批号20190613),柠檬酸合成酶试剂盒(北京索莱宝科技有限公司,批号BC1060);乙腈、甲醇均为色谱纯,其余试剂均为分析纯,水为去离子水。
1.3 动物
本研究所用动物为SPF级昆明种小鼠,体质量18~22 g,购自山西医科大学实验动物中心,动物生产许可证号为SCXK(晋)2019-0001。所有小鼠均自由摄食、饮水,适应性喂养1周后进行实验。
2 方法与结果
2.1 黄芪注射液中次生成分的制备
取黄芪注射液20 mL,加入预处理过的D101大孔吸附树脂柱中,以30倍柱体积的水洗脱后,再以10倍柱体积的70%乙醇洗脱;收集70%乙醇洗脱液,减压浓缩,即得黄芪注射液中次生成分(得率为10.0%)。临用时,将该次生成分以无菌注射用水稀释至20 mL(与原黄芪注射液中次生成分的浓度一致),备用。
2.2 黄芪注射液中次生成分的药效作用研究
2.2.1 分组、造模与给药 将小鼠分为正常组、模型组、黄芪注射液组(0.004 mL/g,剂量根据本课题组前期研究结果设置[19-20])和次生成分低、中、高剂量组(0.004、0.008、0.016 mL/g,剂量根据预实验结果设置),每组7只。除正常组小鼠腹腔注射等体积无菌注射用水外,其余各组小鼠均腹腔注射环磷酰胺(80 mg/kg),连续3 d。当模型组和各给药组小鼠的血常规指标[白细胞(WBC)、中性粒细胞(NE)、淋巴细胞(LY)、单核细胞(MO)计数]与正常组小鼠上述指标相比差异有统计学意义时,则表明白细胞减少症模型复制成功[21]。造模成功后,各给药组小鼠腹腔注射相应药物,正常组和模型组小鼠腹腔注射等体积无菌注射用水,每天1次,连续7 d。实验过程中,每隔2 d称定小鼠体质量,并根据小鼠体质量调整给药剂量。
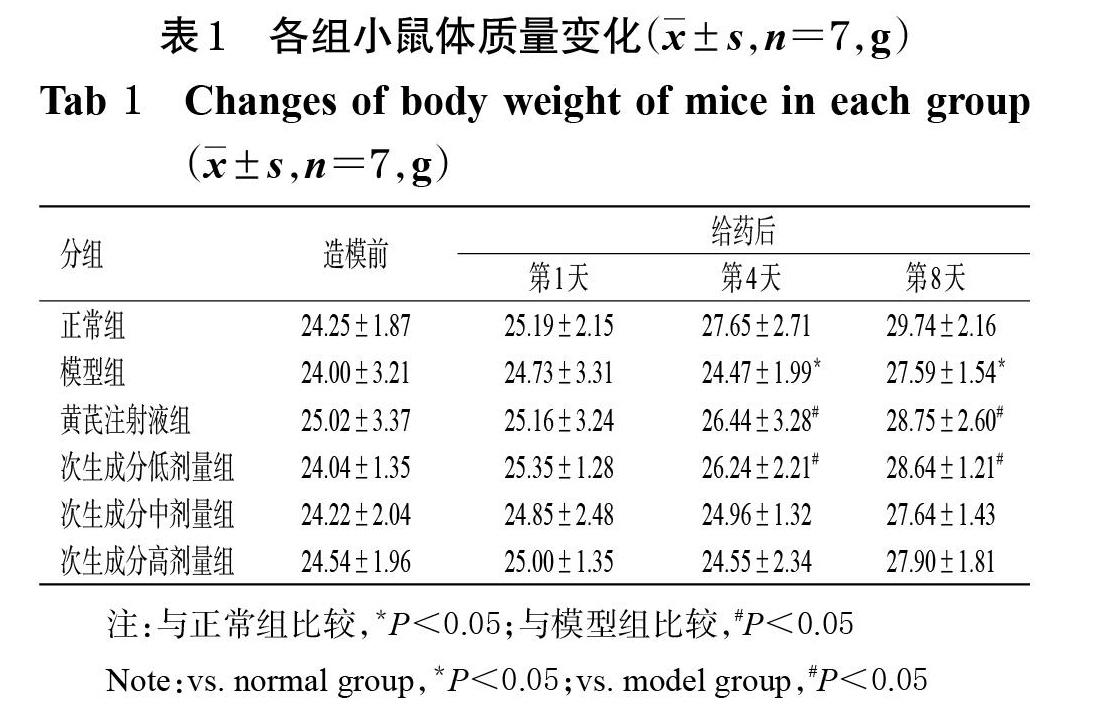
2.2.2 小鼠体质量变化考察 对“2.2.1”项下测得的各组小鼠体质量,采用SPSS 21.0 软件进行统计分析。数据以x±s表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,检验水准α=0.05。结果显示,造模前各组小鼠体质量差异无统计学意义(P>0.05);给药后第4、8天,模型组小鼠体质量均较正常组显著降低(P<0.05),黄芪注射液组和次生成分低剂量组小鼠体质量均较模型组显著升高(P<0.05),详见表1。
2.2.3 样本采集 末次给药后,各小鼠均禁食禁水,次日进行眼眶取血,置于含抗凝剂乙二胺四乙酸二钾(EDTA-K2)的EP 管中,以全血进行血常规指标检测;同法取血,不抗凝,于4 ℃条件下以3 500 r/min离心15 min,取上层血清于-80 ℃条件下保存,用于UPLC-Q Exactive Orbitrap-HRMS代谢组学分析。
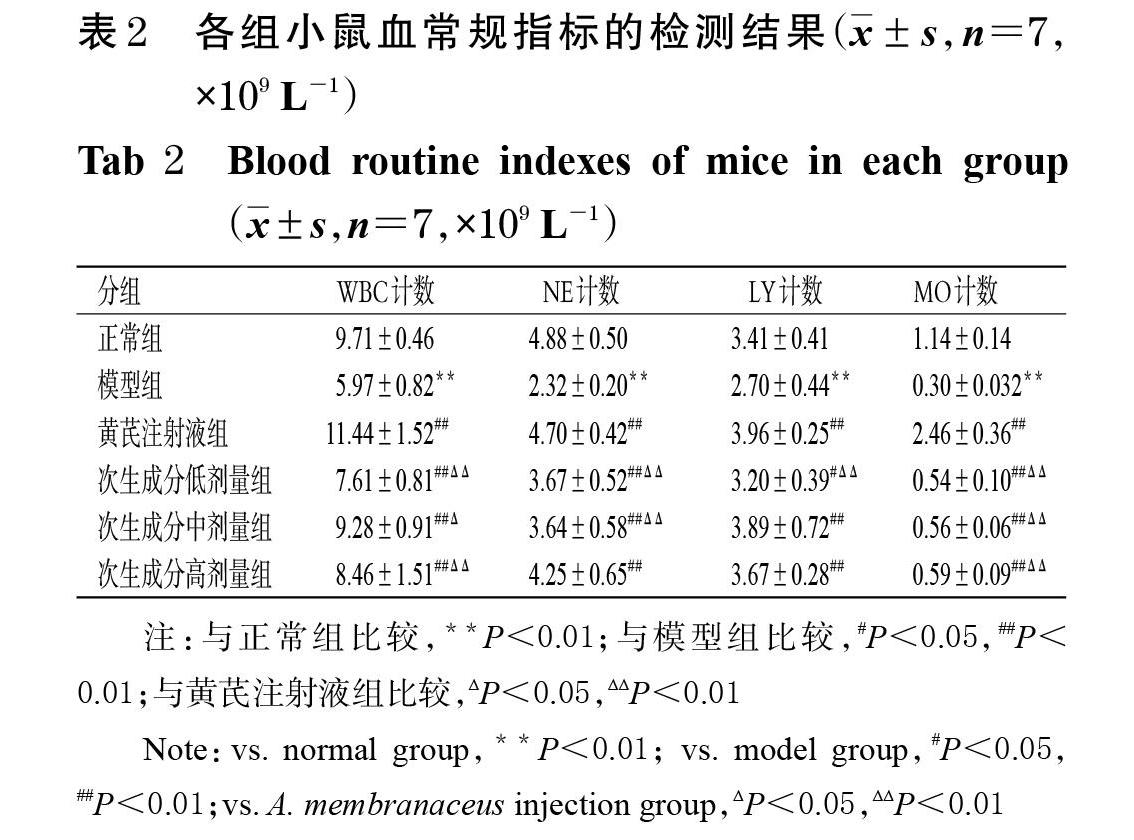
2.2.4 小鼠血常规指标检测 取“2.2.3”项下经抗凝处理后的各组小鼠全血样品,采用动物血液分析仪检测血常规指标。与正常组比较,模型组小鼠血清中WBC、NE、LY、MO计数均显著降低(P<0.01);与模型组比较,黄芪注射液组和次生成分各剂量组小鼠血清中上述指标均显著升高(P<0.05或P<0.01);与黄芪注射液组比较,次生成分低剂量组小鼠血清中上述指标均显著降低(P<0.01),次生成分中劑量组小鼠血清中WBC、NE、MO计数均显著降低(P<0.05或P<0.01),次生成分高剂量组小鼠血清中WBC、MO计数均显著降低(P<0.01),详见表2。
2.3 小鼠血清样品的代谢组学分析
参考文献[20,22],以UPLC-Q Exactive Orbitrap- HRMS法进行血清代谢组学分析。
2.3.1 血清样本的处理 取“2.2.3”项下正常组、模型组、黄芪注射液组、次生成分低剂量组小鼠的冻存血清样本100 μL于EP管中,加入甲醇225 μL和乙腈75 μL,涡旋2 min;再于4 ℃条件下以13 000 r/min离心15 min,取上清液,待测。另从上述各组待测上清液中分别取10 μL混合,作为质控(QC)样本。
2.3.2 UPLC-Q Exactive Orbitrap-HRMS条件 (1)色谱条件:色谱柱为ACQUITYUPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 μm);流动相为0.1%甲酸溶液(A)- 0.1%甲酸乙腈溶液(B),梯度洗脱(0~2 min,2%B;2~3 min,2%B→35% B;3~15 min,35%B→70%B;15~18 min,70%B;18~29 min,70%B→98%B;29~31 min,98%B;31~33 min,98%B→2%B;33~35 min,2%B);流速为0.2 mL/min;进样量为5 μL;柱温为40 ℃。(2)质谱条件:采用加热电喷雾离子源(HESI),喷雾电压正极为3 500 V、负极为2 500 V,毛细管温度为320 ℃,鞘气流速为35 Arb,辅气流速为10 Arb;采用正负离子切换采集模式,扫描模式为Full Scan/dd-MS2,Full MS分辨率设定为MS Full Scan 3500 FWHM和MS/MS 17500 FWHM,扫描范围为质荷比(m/z)100→1 500。
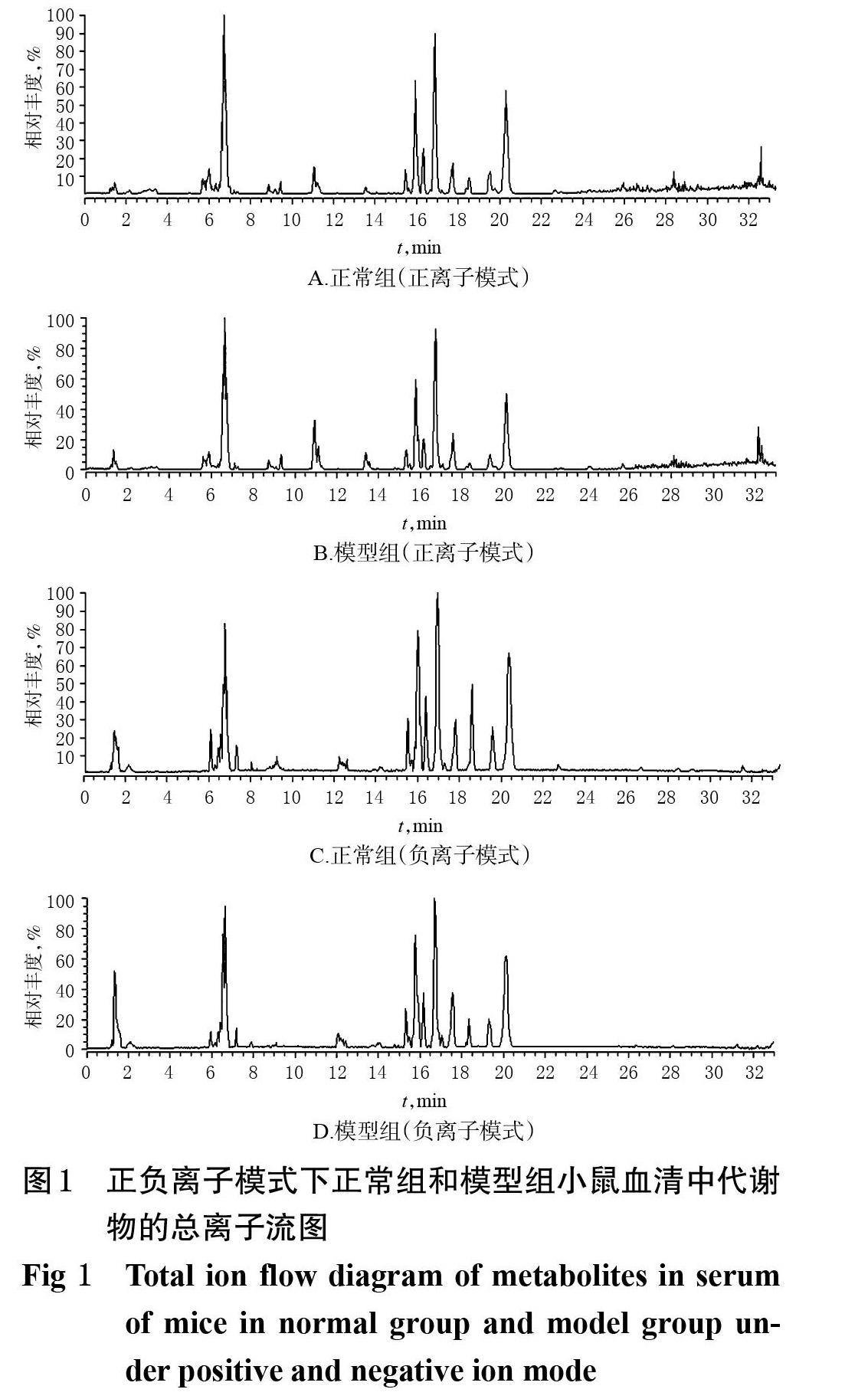
2.3.3 代谢物分析 将“2.3.1”项下的正常组、模型組、黄芪注射液组、次生成分低剂量组处理后的血清待测样本及QC样本,按“2.3.2”项下色谱与质谱条件进行分析,于正负离子模式下,采集总离子流图,详见图1(除正常组和模型组之外的其余组总离子流图略)。由图1可知,正常组和模型组小鼠血清中各代谢物色谱峰分离良好;在正负离子模式下,正常组和模型组小鼠的血清代谢物的种类和含量不同,说明两组间的血清代谢物存在差异。基于此,笔者继续采用多元统计分析法,进一步分析正常组和模型组之间血清代谢物的差异。
2.3.4 多元统计分析 将“2.3.3”项下所得的正常组和模型组血清代谢物原始质谱数据的“.raw”格式文件导入Compound Discover 3.0软件进行提取和预处理,再将处理后的数据导入Excel 2010软件中进行面积归一化处理;采用Simca-P 13.0软件对经面积归一化处理后的数据进行多元统计分析,根据正交偏最小二乘法-判别分析(OPLS-DA)模型所得的变量投影重要度(VIP)值(VIP>1.0),并结合t检验(P<0.05),寻找差异代谢物[19]。通过查询HMDB(http://www.hmdb.ca/)、METLIN(http://enigma.lbl.gov/metlin/)、KEGG(https://www.kegg.jp/kegg/pathway.html)等数据库,指认两组间的差异代谢物。结果显示,共指认出21个差异代谢物,分别为脯氨酰胺、L-脯氨酸、甜菜碱、柠檬酸、L-异亮氨酸、乙酰肉碱、1-磷酸鞘氨醇、烟酰胺、L-苯丙氨酸、1-硬脂酰基-sn-甘油-3-磷酸乙醇、D-鞘氨醇、1-十七烷酰基-sn-甘油-3-磷酸胆碱、溶血磷脂酰肌醇、亚精胺、邻苯二甲酸酐、二十碳五烯酸、亚油酸、葡萄糖、邻苯二甲酸二丁酯、尿酸、芥酰胺。
基于上述方法,将正常组、模型组、黄芪注射液组和次生成分低剂量组的血清代谢物原始质谱数据进行多元统计分析,得到OPLS-DA得分图(图2)。由图2可知,QC样本数据聚在一起,说明本研究采用的UPLC-Q Exactive Orbitrap-HRMS法用于代谢组学分析具有良好的稳定性和可靠性。黄芪注射液组数据比次生成分低剂量组数据距离正常组更近,说明黄芪注射液升高白细胞的作用强于其次生成分。进一步分析发现,与模型组比较,次生成分低剂量组小鼠血清中亚精胺、尿酸、芥酰胺的相对含量均显著升高(P<0.05或P<0.01),柠檬酸、烟酰胺、二十碳五烯酸、亚油酸、1-磷酸鞘氨醇的相对含量均显著降低(P<0.01),表明黄芪注射液中次生成分可明显回调小鼠血清中上述8个差异代谢物的相对含量,详见图3。
2.3.5 代谢通路分析 将小鼠血清中可被黄芪注射液中次生成分回调的8个差异代谢物名称导入MetPA数据库(http://www. Metaboanalyst.ca)进行分析。结果显示,黄芪注射液中次生成分治疗白细胞减少症可能与亚油酸代谢途径、烟酸和烟酰胺代谢途径、三羧酸循环途径有关,详见图4。
2.3.6 柠檬酸合酶的检测 柠檬酸合酶是三羧酸循环中的关键酶[23],基于此,本研究通过测定正常组、模型组、次生成分低剂量组小鼠心肌组织中柠檬酸合酶的活性,以验证黄芪注射液中次生成分对三羧酸循环途径的影响。具体方法如下:取血完成后,将各组小鼠处死,取其心肌组织适量,加10倍量(mL/g)生理盐水进行匀浆处理,于4 ℃条件下以3 000 r/min离心10 min;取上清液,按相应试剂盒说明书方法操作,检测柠檬酸合酶的活性。结果,与正常组[(59.11±0.75) mmol/(min·mg)]比较,模型组小鼠心肌组织中柠檬酸合酶活性[(49.51±0.94) mmol/(min·mg)]显著降低(P<0.01);与模型组比较,次生成分低剂量组小鼠心肌组织中柠檬酸合酶活性[(57.68±0.60) mmol/(min·mg)]显著升高(P<0.01)。
3 讨论
3.1 黄芪注射液中次生成分对白细胞减少症模型小鼠体质量和白细胞的影响
动物体质量的稳定增长,可从侧面反映药物的疗效,若给药后动物的体质量一直下降,说明药物无治疗作用或治疗作用较小,且毒副作用可能较大,因此在药效学实验中常将动物的体质量变化作为考察的指标[24]。白细胞减少症是一种外周血WBC数量持续低于4.0×109 L-1的疾病,而WBC主要包括NE、LY、MO[19],因此通过测定WBC、LY、MO、NE计数的变化,可反映药物是否具有升高白细胞的作用。本研究发现,黄芪注射液中次生成分可升高白细胞减少症模型小鼠的体质量以及血清中的白细胞计数。
3.2 黄芪注射液中次生成分升高白细胞的代谢通路分析
黄芪注射液中次生成分治疗白细胞减少症可能与亚油酸代谢途径、烟酸和烟酰胺代谢途径、三羧酸循环途径有关;且本研究通过测定小鼠心肌组织中柠檬酸合酶的活性,也验证了黄芪注射液中次生成分可通过作用于三羧酸循环,发挥升高白细胞的作用。
3.2.1 作用于亚油酸代谢途径 黄芪注射液中次生成分作用于亚油酸代谢途径与黄芪注射液一致[20]。环磷酰胺可升高白细胞减少症模型小鼠血清中亚油酸的含量[25-27],说明其可能通过作用于亚油酸代谢途径引起白细胞减少。本研究发现,经黄芪注射液中次生成分干预后,白细胞减少症模型小鼠血清中亚油酸的相对含量显著降低,由此说明,黄芪注射液次生成分可能通过作用于亚油酸代谢途径发挥治疗白细胞减少症的作用。
3.2.2 作用于烟酸和烟酰胺代谢途径 烟酰胺是辅酶还原型烟酰胺腺嘌呤二核苷酸(NADH)和还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的组成部分,参与了包括腺嘌呤核苷三磷酸(ATP)形成在内的200多种酶反应[28]。烟酸是一种维生素,由烟酸腺苷转移酶转化为NAD+并参与细胞能量的代谢[29];其也可在体内转化为烟酰胺,抑制sirt1酶和parp1酶,并能调控细胞的乙酰化和糖基化[30]。本研究发现,经环磷酰胺作用后,白细胞减少症模型小鼠血清中烟酰胺相对含量显著升高;经黄芪注射液中次生成分干预后,模型小鼠血清中烟酰胺相对含量显著降低。由此说明,黄芪注射液中次生成分可能通过作用于烟酸和烟酰胺代谢途径发挥治疗白细胞减少症的作用。
3.2.3 作用于三羧酸循环途径 柠檬酸是三羧酸循环的重要中间代谢物[23]。本研究发现,经环磷酰胺作用后,白细胞减少症模型小鼠血清中柠檬酸相对含量显著升高,说明环磷酰胺影响了模型小鼠血清中柠檬酸的代谢;经黄芪注射液中次生成分干预后,模型小鼠血清中柠檬酸相对含量显著降低,且柠檬酸合酶的活性显著升高。由此说明,黄芪注射液中次生成分可通过影响三羧酸循环发挥治疗白细胞减少症的作用。
综上所述,黄芪注射液中次生成分对白细胞减少症模型小鼠具有明显的治疗作用,其作用机制与干预亚油酸代谢、烟酸和烟酰胺代谢、三羧酸循环有关。次生成分为黄芪注射液中具有升高白细胞作用的有效成分,但次生成分的种类较多,具体是何种成分发挥作用有待进一步研究。此外,由于UPLC-Q Exactive Orbitrap-HRMS技术的检测缺陷性,较难检测到极性小的代谢物[18],因此仅通过UPLC-Q Exactive Orbitrap-HRMS技术分析黄芪注射液中次生成分治疗白细胞減少症的作用机制不够全面;后续可采用核磁共振氢谱(1H-NMR)代谢组学技术、气相色谱-质谱(GC-MS)代谢组学技术等对黄芪注射液中次生成分治疗白细胞减少症的作用机制的研究进行完善。
参考文献
[ 1 ] 卫生部.卫生部药品标准:中药成方制剂:第17册 [S]. 北京:人民卫生出版社,1998:256.
[ 2 ] 陈琪.应用代谢组学研究长春花响应机械损伤的代谢基础[D]. 哈尔滨:东北林业大学,2018.
[ 3 ] 窦辉,付铁军,张帆,等.黄芪注射液的化学成分[J].天然产物研究与开发,2002,14(6):14-17.
[ 4 ] 张纲,胡雪娇,姜国志,等.液质联用分析黄芪注射液中的有机小分子化学成分[J].中国现代中药,2016,18(4):410-414,430.
[ 5 ] 陈燕燕,李晓男,王跃飞,等.解卷积定量核磁共振法测定黄芪注射液中8种初生代谢成分[J].分析化学,2015,43(8):1210-1217.
[ 6 ] ZHANG W N,LI A P,QI Y S,et al. Metabolomics coupled with system pharmacology reveal the protective effect of total flavonoids of Astragali Radix against adriamycin-induced rat nephropathy model[J]. J Pharmaceut Biomed,2018,158:128-136.
[ 7 ] HUANG J,CHEN H Y,LI C Y,et al. Screening and identification of the metabolites of water extracts of raw and honey-processed astragalus in rat urine based on UHPLC/ESI-Q-TOF-MS and multivariate statistical analysis[J]. J Am Soc Mass Spectrom,2018,29(9):1919-1935.
[ 8 ] ZHANG Y P,NIE M K,SHI S Y,et al. Integration of magnetic solid phase fishing and off-line two-dimensional high-performance liquid chromatography-diode array detector-mass spectrometry for screening and identification of human serum albumin binders from Radix Astragali[J].Food Chem,2014,146:56-64.
[ 9 ] WANG Y M,LIU L,MA Y K,et al. Chemical discrimination of Astragalus mongholicus and Astragalus membranaceus based on metabolomics using UHPLC-ESI-Q-TOF- MS/MS approach[J]. Molecules,2019,24:4064.
[10] LIU P P,SHAN G S,ZHANG F,et al. Metabolomics ana- lysis and rapid identification of changes in chemical ingredients in crude and processed Astragali Radix by UPLC- QTOF-MS combined with novel informatics UNIFI platform[J]. Chin J Nat Medicines,2018,16(9):714-720.
[11] MEI X D,WANG Y Q,LIU Z H,et al. The chemical transformations for Radix Astragali via different alkaline wash conditions by quantitative and qualitative analyses[J]. J Pharmaceut Biomed,2020,185:113164.
[12] 张友山,闻后钧,刘雪银.黄芪注射液治疗白细胞减少症112例临床观察[J].时珍国医国药,2000,11(10):935.
[13] ZHANG C S,ZHU C T,LING Y,et al. The clinical value of Huangqi injection in the treatment of leucopenia:a meta-analysis of clinical controlled trials[J]. PLoS One,2013,8(12):e83123.
[14] 曾小红.黄芪注射液治疗甲巯咪唑引起甲亢患者白细胞减少症评价[J].辽宁中医药大学学报,2014,12(16):176-178.
[15] 张扶莉,杨利生.升白方与黄芪注射液治疗化疗后白细胞减少症疗效观察[J].陕西中医,2011,32(8):1023-1024.
[16] 章奇法,葛丹枫,陈晓波,等.穴位注射联合补益生血中药治疗白细胞减少症56例疗效观察[J].健康研究,2015,35(3):313-314.
[17] 高永盛,李燕,符发年.直肠癌新辅助化疗前应用黄芪注射液预防白细胞减少的效果观察[J].中国肛肠病杂志,2018,38(5):17-19.
[18] SUN Z,ZUO L H,SUN T W,et al. Chemical profiling and quantification of XueBiJing injection,a systematic quality control strategy using UHPLC-Q exactive hybrid quadrupole-orbitrap high-resolution mass spectrometry[J]. Sci Rep,2017,7 (1):16921-16936.
[19] QU T L,LI Z Y,ZHAO S J,et al. A metabonomic analysis reveals novel regulatory mechanism of Huangqi injection on leucopenia mice[J]. Immunopharm Immunot,2016,38(2):113-123.
[20] 刘腾,许晋芳,卢晓林,等.基于LC-MS代谢组学研究黄芪注射液对白细胞减少症模型小鼠的干预作用[J].中国药房,2020,31(21):2627-2633.
[21] 曲婷丽,王二兵,李震宇,等.黄芪注射液乙酸乙酯萃取物对小鼠白细胞减少症作用的代谢组学研究[J].中成药,2017,39(3):455-461.
[22] 宫文霞.当归及其活性成分的抗抑郁作用及机制研究[D].太原:山西大学,2019.
[23] CRUMBLEY C,WANG Y J,BANERJEE S,et al. Regulation of expression of citrate synthase by the retinoic acid receptor-related orphan receptor α (RORα)[J]. PLoS One,2012,7(4):e33804.
[24] 姜清芳,黄敏怡,游春香,等.三七总皂苷和多烯磷脂酰胆碱调控大鼠非酒精性脂肪肝的药效学比较[J].中国医药科学,2020,10(21):23-26.
[25] 师萱,阳勇,秦伟瀚,等.环磷酰胺对小鼠免疫抑制作用过程中代谢通路变化的代谢组学研究[J].中国实验动物学报,2017,25(5):539-543.
[26] 陈婧,刘云霞,徐叶峰,等.代谢组学法分析骨髓抑制模型小鼠血清小分子代谢产物[J].色谱,2017,35(12):1312- 1316.
[27] JI P,WEI Y M,HUA Y L,et al. A novel approach using metabolomics coupled with hematological and biochemical parameters to explain the enriching-blood effect and mechanism of unprocessed Angelica sinensis and its 4 kinds of processed products[J]. J Ethnopharmacol,2018,211:101-116.
[28] MS J P,KHAN S,MPHIL G J. Nicotinamide attenuates cyclophosphamide-induced hepatotoxicity in SD rats by reducing oxidative stress and apoptosis[J]. J Biochem Mol Toxicol,2020,34(10):e22558.
[29] WANG S F,SUN M,YU L,et al. Niacin inhibits apoptosis and rescues premature ovarian failure[J]. Cell Physiol Biochem,2018,50:2060-2070.
[30] BITTERMAN K J,ANDERSON R M,COHEN H Y, et al. Inhibition of silencing and accelerated aging by nicotinamide,a putative negative regulator of yeast sir2 and human SIRT1[J]. J Biol Chem,2002,277:45099-45107.
(收稿日期:2021-03-23 修回日期:2021-06-09)
(編辑:唐晓莲)
