基于深度学习分割前列腺多参数MRI图像中的骨质结构
2021-09-22刘想韩超张耀峰张大斗张晓东王霄英
刘想,韩超,张耀峰,张大斗,张晓东,王霄英*
1.北京大学第一医院医学影像科,北京 100034;2.北京赛迈特锐医学科技有限公司,北京 100011;*通信作者 王霄英wangxiaoying@bjmu.edu.cn
前列腺癌是老年男性常见肿瘤之一[1]。由于我国前列腺癌筛查和早期诊断尚未普及,大约50%的患者初诊时已发生骨转移[2-4]。前列腺癌骨转移好发于骨盆、脊柱和股骨[5]。骨转移会引起病理性骨折及脊髓压迫等不良骨性事件,及时准确地检出前列腺癌骨转移病灶对于减少骨并发症的发生具有重要意义。
多参数磁共振成像(multiparametric MRI,mpMRI)对骨转移的诊断有较高的敏感度和特异度,能准确显示转移灶及周围软组织受侵犯情况。前列腺癌转移报告和数据系统(METastasis Reporting and Data System for Prostate cancer,MET-RADS-P)推荐将扩散加权成像(DWI)+表观扩散系数(ADC)用于评估骨转移[6-9]。
本研究拟训练3D U-Net模型,自动分割前列腺mpMRI中DWI和ADC图像中的骨质结构,并找出分割性能最佳的输入序列组合,以期为后续骨转移病灶的自动检出提供定位信息。
1 资料与方法
本研究获得本院伦理审查委员会的批准(批件号:〔2017(1382)〕),按照本单位人工智能(artificial intelligence,AI)模型训练规范执行研究方案。
1.1 研究数据 从本院PACS系统回顾性收集2019年1月—2020年1月181例前列腺癌患者的盆腔mpMRI图像。病例纳入和排除标准见图1,最终105例患者用于模型的训练。盆腔mpMRI扫描设备采用3.0T GE(Discovery HD 750),DWI采集参数:b=0、800 s/mm2;TR 3 000 ms,TE 60 ms,层数25,层厚4 mm;ADC图像由设备工作站处理生成。

图1 病例纳入流程
1.2 数据标注 将DWI相关序列[DWI低(b=0 s/mm2)、DWI高(b=800 s/mm2)、ADC]的DICOM格式图像转换为Nifty格式。由1名低年资放射科医师(阅片经验2年)在ITK-SNAP 3.6.0上标注3个序列的图像,手工调整窗宽、窗位。标注的骨质结构包括腰椎、骶尾骨、双侧髂骨、双侧髋臼、双侧耻骨、双侧坐骨、双侧股骨头、双侧股骨颈。由1名放射科专家(阅片经验≥15年)对标注进行修改确认。
1.3 训练分割模型 图像预处理参数:大小=64×160×240(z、y、x轴),自动窗宽、窗位。本研究的3D U-Net输入为1~6种序列组合,分别为DWI低+DWI高+ADC、DWI低+DWI高、DWI高+ADC、DWI低+ADC、DWI高、ADC组合,其中每一个图像序列设为一个单独的输入通道。在6个模型中所有的数据均按照8∶1∶1随机分为训练集83例、调优集11例和测试集11例。模型训练使用的硬件为GPU NVIDIA Tesla P100 16G,软件为Python3.6、Pytorch 0.4.1、Opencv、Numpy、SimpleITK等,Adam为训练优化器,批量大小=1,学习率=0.000 1,学习周期=300。
1.4 模型评价
1.4.1 定量指标 使用DICE系数评估U-Net的分割性能,计算公式:DICE(A,B)=2|A∩B|/|A|+|B|,其中A是手工标注的体素数,B是模型预测的体素数。首先计算每个骨质区域的DICE值,再计算全部8个标签的平均DICE值。计算不同模型预测所得各骨质区域的体积值(图2),并与人工标注比较。
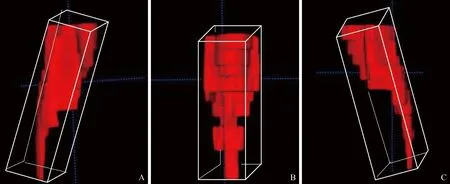
图2 最小体积包围盒算法。用最小体积包围盒算法测量骶骨体积。A~C分别为手工标注骶骨左侧面、正面和右侧面,其余骨质结构体积测量方法与骶骨相同
1.4.2 定性指标 主观评分关注模型预测区域是否满足临床需求,在标签层面、序列层面、模型层面分别评价。由另一位高年资放射科医师(15年以上阅片经验)对比模型预测结果和人工标注结果对模型的分割性能打分。
模型分割情况见图3。根据不同的分割情况,对模型的分割效能打分(表1),单个标签的评分为0~10分。序列层面的评分为该序列中所有标签的平均值,以>6分为达标(无相应标签时则不计算该标签)。模型层面的评价标准为计算测试集中全部序列的达标率,>80%为符合临床应用需求。

表1 模型预测结果的主观评分标准(标签层面)
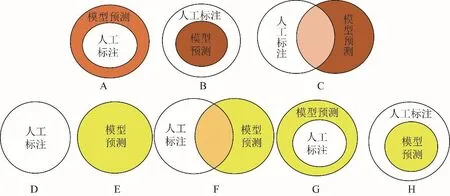
图3 模型分割可能情况。A~C为情况Ⅰ,模型预测标签与人工标注标签定位一致,且模型预测范围大于(A)或小于(B)人工标注范围,或与人工标注范围部分重合(C);D~H为情况Ⅱ,模型预测标签与人工标注标签定位不一致,包括人工标注标签未被预测(D),模型预测为未被标注的非骨质结构(E),错误的模型预测标签与人工标注标签部分重合(F),或大于(G)或小于(H)人工标注范围。白色标签为人工标注标签,有颜色的标签为模型预测标签
1.5 统计学方法 应用SPSS 23.0软件,不同数据集的年龄以±s表示,并应用方差分析比较训练集、调优集和测试集之间的年龄差异,3组间前列腺特异抗原水平和6个模型间的DICE值、模型预测与人工标注体积值的差异以M(Qr)表示,采用Kruskal-WallisH检验进行比较。不同模型达标率比较采用χ2检验(Fisher确切概率法)。P<0.05为差异有统计学意义。
2 结果
2.1 患者基线数据 训练集、调优集和测试集各组患者年龄分别为(69±8)岁、(70±6)岁、(66±7)岁,差异无统计学意义(F=0.961,P>0.05);前列腺特异抗原水平分别为11.83(2.66~15.6)ng/ml、7.69(4.18~17.01)ng/ml和12.41(6.18~30.07)ng/ml,差异无统计学意义(H=2.226,P>0.05)。
2.2 模型定量评估
2.2.1 DICE值 测试集中各模型的DICE值均在0.7以上,且各模型预测结果的平均DICE值差异无统计学意义(HDWI高=2.978,PDWI高>0.05;HADC=1.140,PADC>0.05)。DWI高和ADC图像上的髂骨、骶尾骨、股骨头、股骨颈的平均DICE值均大于其他骨质(P<0.001),见表2。图4为模型1中DICE值为0.85的DWI高模型预测与人工标注重合图。

图4 DWI图像上各骨质结构分割结果。白色标签为人工标注标签,有颜色的标签为模型预测标签。A.腰椎、髂骨重合图;B.髋臼、股骨颈重合图;C.股骨颈、坐骨、耻骨重合图。各骨质结构的DICE值均在0.8以上
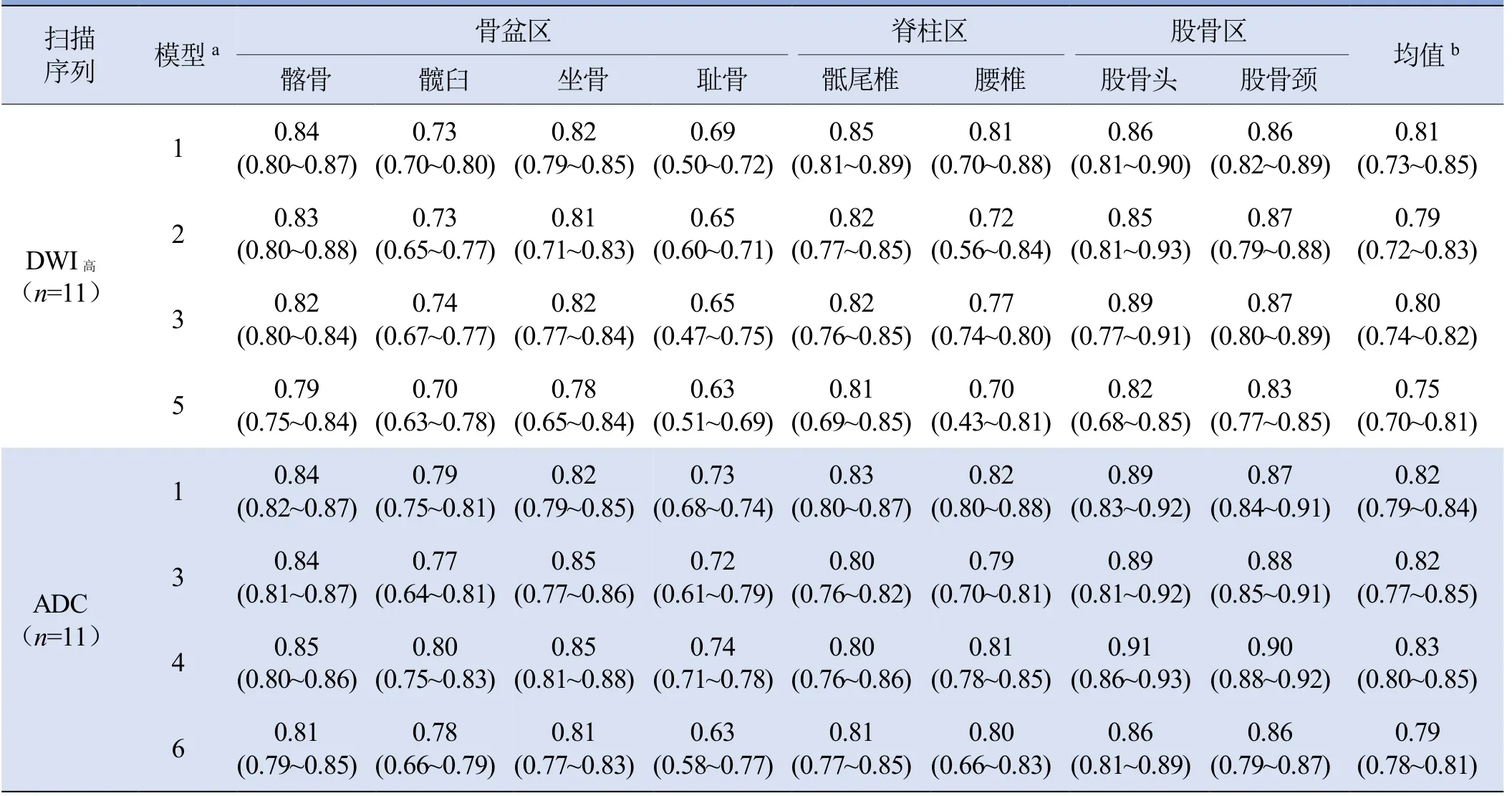
表2 不同模型预测各标签的DICE 值[M(Qr)]
2.2.2 体积差值 计算测试集中不同模型预测标签体积与人工标注体积差值百分比V差值=(|模型预测体积值-人工标注体积值|/标签人工标注平均体积值)×100%,模型1的体积预测值与人工标注值差异最小,但各模型间体积差值差异无统计学意义(HDWI高=2.900,PDWI高>0.05;HADC=2.236,PADC>0.05),见表3。

表3 不同模型预测各标签体积与人工标注体积差[M(Qr)]
2.3 模型定性评估 模型1在DWI高和ADC的图像分割中达标率均最高(82%,91%),且显著高于单序列模型(DWI高:模型1比模型5,P=0.040;ADC:模型1比模型6,P=0.012)。模型1和模型3的达标率均>80%,且在DWI高和ADC的图像分割中差异均无统计学意义(DWI高:模型1比模型3,P>0.05;ADC:模型1比模型3,P>0.05),均符合临床应用需求,见表4。

表4 模型层面主观评分结果
3 讨论
mpMRI广泛应用于诊断前列腺癌,其中DWI不仅可用于检出腺体内肿瘤,也常用于检出盆腔淋巴结和骨转移病灶[10-12],可进一步用于评价全身肿瘤负荷和疗效[6]。基于DWI影像表现既可以对转移病灶进行定性诊断,也可在ADC图上进行定量测量,ADC值的大小可以直接影响前列腺癌患者的RAC分类[13-14]。本研究中训练了3D U-Net模型分割盆腔DWI和ADC图像上的正常骨质结构,并比较不同输入序列的组合对分割性能的影响,以期找出最佳MR序列组合用于盆腔骨质的分割,为后续检出骨转移病灶打下基础。
本研究结果发现,不同模型分割性能的定量指标(DICE值、体积差值)均无显著差异,但在主观评价时可见不同模型的分割效果有一定差异,模型1达标率最高,模型3也显示出较好的性能,与模型1相比无显著差异,均符合临床应用需求。为了兼顾效率和准确性,本研究推荐使用模型3的双序列(DWI高+ADC)为3D U-Net分割盆腔骨质结构的最佳组合序列。
本研究使用主观评价和客观评价确定模型的临床应用价值。通常客观评价指标在不同技术研究之间具有横向可比性,但在面对临床研究提出的不同临床问题时,针对性的主观评价则更为重要,这也是本领域基础研究和临床研究的重要不同之处。以本研究中对骨质分割的评价为例,因不同骨质区域分别命名为不同的标签,属于语义分割的范畴,因此客观评价指标使用单标签的DICE值、预测标签与人工标签的体积差以及连通域比较等。但鉴于髂骨与髋臼,髋臼与耻骨、坐骨,股骨头与股骨颈之间无明确的分界标志,对于放射科医师及临床医师而言,这些区域模型分割出来即可达标,与相邻区域的定位偏差可以接受,不影响这些区域骨转移瘤的检出,因此主观评价结果与临床应用价值的一致性更强。
对于较复杂的临床任务,将其解析为不同的模型训练任务,每个步骤均可观察到模型输出结果,既能提高模型的可解释性,又能节省训练资源,是临床医师参与模型训练路径设计的价值所在。本研究采用深度学习方法检出前列腺癌骨转移的序贯任务之一,即先完成骨盆区域的骨质定位,后续研究中在这些区域再检出骨转移瘤病灶,从而实现对前列腺癌骨转移的自动分割。将来进一步可将相关前列腺mpMRI模型整合在一起,包括前列腺体积分割、前列腺癌检测、前列腺癌周围侵犯、前列腺癌淋巴结转移等模型[15],在模型准确率较高时,可以自动生成结构化报告,提高临床诊断的准确性和效率[16]。
本研究的局限性:①本研究所收集的盆腔DWI图像虽然扫描层数一致,但扫描范围不一致,部分患者缺少含有耻骨结构的层面,且耻骨本身所占图像的体素小,导致模型所能学习到的有效的耻骨体素量少,从而使得模型对其分割难度较大,DICE值较低。②本研究不同骨质的结构是基于影像专家的临床经验及解剖知识进行标注,髂骨、腰椎标注的一致性很强,但是股骨头与股骨颈的分界、髋臼与髂骨的分界、坐骨与耻骨的分界则有一定的主观偏差。③本研究收集的数据均来自同一类型设备,未比较不同类型设备生成的图像对于各模型分割性能的影响,将来应获取更多不同来源的数据进行训练,以提高模型的适用性。
总之,多个序列的输入对于3D U-Net网络进行盆腔范围内骨质结构的分割性能有显著提升,DWI高+ADC可作为前列腺mpMRI检查盆腔骨质结构分割的最佳组合序列。
