2G型肢带肌营养不良症斑马鱼疾病模型的构建
2021-09-22李丽萍钟静牛玉娟孙源超吴传鸿李美航周建峰丁永和
李丽萍 钟静 牛玉娟 孙源超 吴传鸿 李美航 周建峰 丁永和
(青岛大学,山东 青岛 266071 1 基础医学院生物化学与分子生物学系; 2 生物医学研究院)
2型肢带肌营养不良症(LGMD2)是一类具有肢带肌无力、肌肉萎缩临床表现的常染色体隐性遗传的家族性疾病[1],根据致病基因的不同可分为不同的亚型,其中LGMD2G是LGMD2的亚型之一,是由定位于17q12区域的编码Telethonin蛋白的TCAP基因突变导致的[2],在中国、印度和欧洲等国家人群中均有发现[2,3-7]。LGMD2G的主要临床特征是远端肢体肌无力,患者在20岁左右开始出现下肢无力症状,约40%的患者在40岁左右失去了独立行走的能力[8],生活质量受到严重影响。鉴于LGMD2G发病机制尚不明确,目前临床上尚没有针对LGMD2G的有效治疗手段。
由于人类遗传学研究的限制,LGMD2G疾病相关分子机制的研究主要依赖于动物模型。斑马鱼用于科学研究已有80多年的历史[9],因具有体积小、繁殖能力强、易于基因改造的优点,目前广泛应用于药物的筛选[10],在动物疾病模型的构建中也显示出了其特有的优势,然而目前LGMD2G斑马鱼疾病模型的构建及致病机制的研究还处于初步探索阶段。本研究利用CRISPR/Cas9基因编辑技术致斑马鱼tcap基因突变来构建LGMD2G的活体动物模型,并进一步利用该模型初步探讨tcap基因在LGMD2G中的功能以及潜在作用机制,旨在为进一步研究LGMD2G的致病机制以及进行治疗药物的筛选奠定基础。
1 材料与方法
1.1 动物和材料
Tübingen 品系斑马鱼由中国海洋大学分子医学生物学实验室提供,人工养殖于自动水循环系统中。T7核酸内切酶、胚胎牛血清(FBS)、T7体外转录试剂盒、DNase Ⅰ(美国Thermo 公司),异丙醇、20×SSC 缓冲液、氯仿-异戊醇等(上海生工生物工程股份有限公司),KOD(plus)和KOD F(x)DNA聚合酶(日本TOYOBO 公司),反转录试剂盒、实时荧光定量PCR(RT-qPCR)试剂盒(加拿大ABMgood公司),酚红、多聚甲醛(美国Sigma 公司),苏木精-伊红(HE)染色试剂盒(北京索莱宝科技有限公司),地高辛(DIG) 抗体、DIG 标记的 NTP(瑞士Roche 公司)。
1.2 实验方法
1.2.1小向导RNA(sgRNA)合成和显微注射 依据从美国国家生物技术信息中心(NCBI)网站下载的斑马鱼tcap基因序列设计CRISPR/Cas9靶点,靶点的序列为5′-ATTGATGCTGCGCCAGTCAG-
3′。根据靶点序列设计sgRNA合成所需引物,以pT7-gRNA质粒为模板进行PCR扩增,用酚-氯仿抽提法抽提PCR产物,利用T7体外转录试剂盒合成sgRNA,用体积分数为0.01的琼脂糖胶进行核酸电泳,检测sgRNA是否制备成功。sgRNA制备成功后用酚红将sgRNA稀释为400 mg/L,将Cas9蛋白与400 mg/L的sgRNA各取1 μL混匀,将sgRNA稀释为终浓度200 mg/L,将1 nL上述稀释液于显微镜下注射至野生型(WT)斑马鱼胚胎卵黄(发育时期为1细胞期)中,然后胚胎置于培养液中于28.5 ℃恒温培养箱中培养。
1.2.2tcap基因纯合突变斑马鱼筛选 将于显微镜下注射后的斑马鱼胚胎培养2~3 d,然后进行基因组提取。通过Prime 5.0软件设计筛选tcap基因突变斑马鱼的引物序列如下:F-5′-GTTTGGATA-TGTGGGTG-3′,R-5′-AAATGTAGCCTACTGG-TG-3′;PCR扩增以后进行T7核酸内切酶酶切,选择能切开的PCR产物进行DNA测序,筛选获得F0代tcap基因突变斑马鱼。成年后将其与WT斑马鱼交配获得F1代tcap基因突变斑马鱼。对成年后的F1代tcap基因突变斑马鱼进行筛选并确定突变类型,将相同突变类型的F1代tcap基因突变雌雄斑马鱼交配后,再次筛选获得F2代tcap基因突变斑马鱼,即为tcap基因纯合突变斑马鱼。然后通过GENEDOC软件分析tcap基因纯合突变斑马鱼的tcap基因所编码的telethonin蛋白氨基酸序列的变化情况。
1.2.3斑马鱼骨骼肌组织石蜡切片以及HE染色成年WT和tcap基因纯合突变斑马鱼安乐死后切取骨骼肌组织,置于体积分数为0.04的多聚甲醛溶液中固定,经水洗、梯度脱水、透明、透蜡后进行石蜡包埋和切片;将切片后的组织进行脱蜡和梯度复水,以蒸馏水冲洗组织切片5 min后用苏木精染料染色3 min;然后经含体积分数0.01的盐酸乙醇溶液冲洗后再以蒸馏水冲洗12 min,伊红染料染色30 s;经乙醇和二甲苯处理后封片,置于显微镜下观察并拍照。
1.2.4斑马鱼最大游泳速度检测 选取体长(BL)和体质量相近的成年WT斑马鱼(A组)和tcap基因纯合突变斑马鱼(B组),每组10条,禁食24 h,后使用新一代斑马鱼专用游泳速度测试系统(Loligo系统,丹麦),参照相关文献[11],测量A组和B组斑马鱼的最大游泳速度,为了减少斑马鱼不同个体间BL差异所产生的误差,将最大游泳速度单位换算为BL/s。
1.2.5斑马鱼胚胎的分组及其处理 依据文献[12]对受精后24 h(24hpf)的原基-5期和受精后72 h(72hpf)的突口期斑马鱼胚胎进行区分,同时依据处理方式不同,将WT斑马鱼胚胎分为空白对照组(C组)、漂白剂处理组(D组)、剪切损伤处理组(E组)和加兰他敏处理组(F组)。再将WT斑马鱼胚胎和M1型tcap基因纯合突变斑马鱼胚胎分为WT斑马鱼胚胎空白对照组(G组)、WT斑马鱼胚胎加兰他敏处理组(H组)、M1型tcap基因纯合突变斑马鱼胚胎空白对照组(I组)和M1型tcap基因纯合突变斑马鱼胚胎加兰他敏处理组(J组),每组30枚胚胎。C、G和I组对72hpf的WT斑马鱼胚胎或者tcap基因纯合突变斑马鱼胚胎进行正常培养,没有进行任何处理;D组用含体积分数0.022 5的漂白剂溶液处理24hpf的WT斑马鱼胚胎2 min,正常培养至72hpf收集胚胎;E组用刀片在显微镜下损伤72hpf的WT斑马鱼胚胎尾部骨骼肌组织,3 h后收集胚胎;F组、H组和J组用浓度为0.5 mmol/L的加兰他敏溶液处理24hpf的WT斑马鱼胚胎或者tcap基因纯合突变斑马鱼胚胎48 h后,收集胚胎。
1.2.6斑马鱼整胚原位杂交及RT-qPCR实验 参照RONG等[13]报道的方法进行原位杂交,检测C~F组WT斑马鱼胚胎中tcapmRNA显色情况;对于C~J组斑马鱼胚胎进行RT-qPCR检测:将斑马鱼胚胎于200 μL Trizol试剂中碾碎,然后依次加入Trizol试剂、氯仿、异丙醇、体积分数0.75乙醇溶液,分离并提取总的RNA;采用5×All-In-One-RT-MasterMix反转录试剂盒进行反转录获得cDNA,以此cDNA为模板采用SYBR Green Master Mix试剂盒进行RT-qPCR反应,以β-actin作为内参照,检测斑马鱼胚胎中tcap、p53和p21 mRNA的表达水平。RT-qPCR引物序列见表1。

表1 RT-qPCR引物名称及其序列
1.3 统计学处理
使用GraphPad Prism 8.0软件进行数据统计分析,计量资料以均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 tcap基因纯合突变斑马鱼筛选结果
对设计合成的sgRNA进行核酸电泳,显示为一条长约100 bp的单一核酸条带,表明成功合成了斑马鱼tcap基因编辑所需的sgRNA;于显微镜下注射sgRNA与Cas9蛋白复合物对WT斑马鱼胚胎tcap基因进行编辑,并最终筛选获得了两种基因型不同的tcap基因纯合突变斑马鱼,分别为缺失碱基GCGCCAGTC和增加碱基TCTATCTATCT的M1型以及缺失碱基CTGCGCCAGT的M2型(图1);通过GENEDOC软件分析发现,这两种tcap基因纯合突变斑马鱼都会产生telethonin截短蛋白,从而导致tcap基因功能丧失。由于M1型tcap基因纯合突变斑马鱼所编码的telethonin截短蛋白氨基酸个数最少,因此后续均使用M1型tcap基因纯合突变斑马鱼进行实验。
2.2 WT与M1型tcap基因纯合突变斑马鱼骨骼肌组织HE染色结果
HE染色实验结果显示,成年WT斑马鱼的骨骼肌肌原纤维排列规则(图2A),而成年M1型tcap基因纯合突变斑马鱼的骨骼肌肌原纤维排列明显紊乱(图2B)。
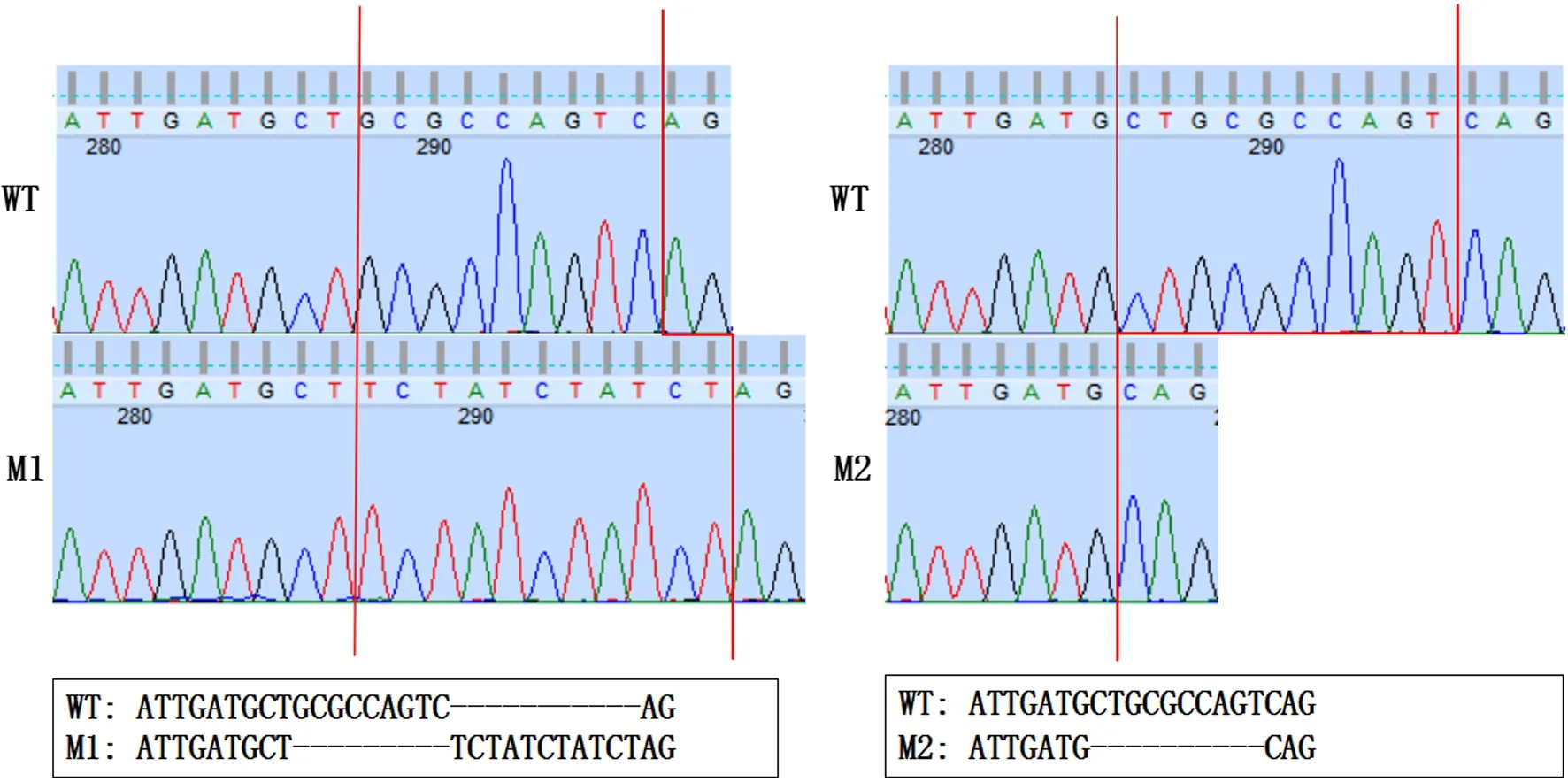
红色线条标记突变区
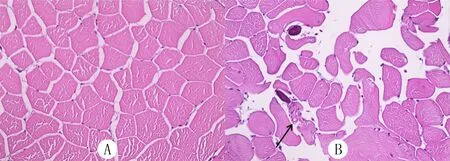
A:WT斑马鱼,B:M1型tcap基因纯合突变斑马鱼,箭头指向紊乱的肌原纤维,HE染色,400倍
2.3 WT与M1型tcap基因纯合突变斑马鱼最大游泳速度检测结果
检测结果显示,A组和B组斑马鱼的最大游泳速度分别为(22.78±2.25)、(18.67±2.95)BL/s,两组比较差异具有显著性(t=3.32,P<0.05)。
2.4 不同处理方式下WT斑马鱼胚胎中tcap mRNA表达情况
原位杂交实验结果显示,与C组比较,D~F组WT斑马鱼胚胎中tcapmRNA的紫色显色区域明显增加(图3)。RT-qPCR实验结果显示,C~F组WT斑马鱼胚胎中tcapmRNA的相对表达量分别为1.00±0.00、9.64±0.42、8.20±2.52、9.88±1.78,组间比较差异具有显著性(F=21.70,P<0.05),其中与C组相比,D~F组tcapmRNA相对表达量明显升高(t=4.95~35.44,P<0.05)。
2.5 各组斑马鱼胚胎中p53、p21 mRNA相对表达量比较结果
RT-qPCR实验结果显示,G~J组斑马鱼胚胎中p53 mRNA的相对表达量分别为1.00±0.00、1.03±0.27、0.75±0.11、0.46±0.11,p21 mRNA相对表达量分别为1.00±0.01、0.82±0.15、0.73±0.04、0.36±0.06,组间比较差异均具有显著性(F=8.45、33.04,P<0.05);H组与G组比较,斑马鱼胚胎中p53和p21 mRNA相对表达量均无显著差异(P>0.05);J组与H、I组比较,斑马鱼胚胎中p53、p21 mRNA相对表达量明显下降(t=3.24~8.94,P<0.05)。
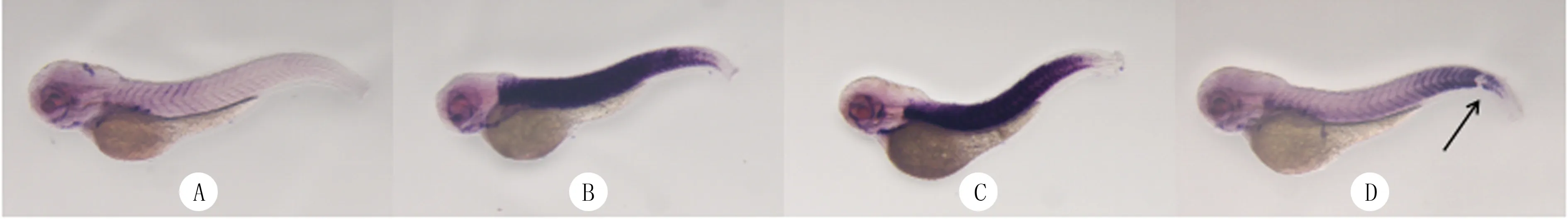
A、B、C、D分别对应C、D、E、F组,箭头指示剪切位点,原位杂交,40倍
3 讨 论
在基因编辑过程中,一般先通过基因编辑工具诱导染色体DNA形成一个断裂缺口,然后细胞启动DNA修复;此时DNA断裂的地方会在修复过程中插入或者删去碱基,进而导致靶基因产生移码或缺失突变[14]。CRISPR系统最早在大肠杆菌中被发现[15]。经CRISPR系统改造而来的CRISPR/Cas9基因编辑技术,具有效率高、能对基因组进行精确编辑等优势,从而广泛应用于动物模型的构建[14]。本研究将CRISPR/Cas9基因编辑技术应用于斑马鱼活体动物模型,成功获得了tcap基因功能缺失的纯合突变斑马鱼。
人类的TCAP基因定位于17号常染色体,其编码的Telthonin蛋白共由167个氨基酸组成,相对分子质量为19 000。该蛋白具有独特的β-折叠结构,存在于肌节Z盘[16-17]。Telethonin蛋白存在于骨骼肌、心肌和肠胃道平滑肌中,其主要功能是维持肌组织的结构稳定性。TCAP的隐性无义或缺失突变会导致LGMD2G。LGMD2G患者会出现远端肢体肌肉力量逐渐减弱的情况,最终失去行动能力[2,8]。本研究HE染色实验结果显示,在tcap基因纯合突变斑马鱼中能检测到明显的骨骼肌肌原纤维紊乱表型,提示tcap基因的功能丧失直接影响了斑马鱼骨骼肌功能,从而支持tcap维持骨骼肌肌肉结构稳定性的理论。本研究中斑马鱼最大游泳速度测试结果显示,tcap基因功能缺失纯合突变斑马鱼的运动能力显著降低。这些表型与在LGMD2G患者中出现的肌肉萎缩和肌肉力量减弱或缺失的症状是基本一致的[6],提示本研究成功构建了斑马鱼LGMD2G模型。
根据文献报道,漂白剂处理导致的机械刺激会使斑马鱼胚胎骨骼肌组织机械压力过载,从而导致tcap基因相对表达量增加[18]。加兰他敏是一种乙酰胆碱酯酶抑制剂,能够使肌肉组织受到生物刺激;剪切损伤处理会使斑马鱼胚胎骨骼肌组织产生损伤应激反应。为了进一步探讨tcap基因突变导致斑马鱼LGMD2G的致病机制,本研究检测了WT斑马鱼的tcap基因在以上处理方式下的表达情况,原位杂交和RT-qPCR实验结果显示,除漂白剂处理外,加兰他敏处理和剪切损伤处理也会诱导WT斑马鱼胚胎tcapmRNA相对表达量增加。MDM2蛋白既能降解P53蛋白又能降解Telethonin蛋白[19-20],提示Telethonin蛋白可能参与了P53信号通路的调控。本研究的RT-qPCR实验结果显示,tcap基因纯合突变斑马鱼胚胎经加兰他敏处理后,其骨骼肌中p53以及p21 mRNA相对表达量明显降低,提示斑马鱼LGMD2G的发病机制很可能与tcap基因缺失后肌组织营养不良导致p53信号通路异常有关。
研究发现,Telethonin能与肌LIM蛋白(MLP)进行相互作用,而小鼠MLP蛋白表达降低会诱发肥厚型心肌病和心力衰竭[21]。TCAP基因缺失是否会影响MLP蛋白功能导致骨骼肌功能异常,从而诱发LGMD2G还有待进一步研究。除此之外,多种信号通路相关蛋白如肌联蛋白、骨形态发生蛋白10和离子通道蛋白Nav1.5等都能与Telethonin蛋白等进行相互作用[22-25],这些蛋白是否也参与了LGDM2G的发生发展目前尚无研究报道,表明LGMD2G的致病机制研究还处于初步探索阶段。
总之,本研究首次成功构建了LGMD2G的斑马鱼疾病模型,并初步发现tcap基因功能缺失导致p53基因下调可能是斑马鱼LGMD2G的致病机制之一。但是关于斑马鱼tcap基因通过p53基因如何调控下游相关信号通路进而导致LGMD2G还有待进一步研究。本研究为LGMD2G治疗药物的筛选提供了一定的理论基础。
