大承气汤抑制高迁移率族蛋白1- Toll样受体4信号通路减轻炎症反应改善重症胰腺炎大鼠肾损伤
2021-09-22王艻,王佳
王 艻,王 佳
(1.华中科技大学同济医学院附属同济医院肾内科,湖北 武汉 443000;2.四川省医学科学院·四川省人民医院全科,四川 成都 610072)
重症急性胰腺炎(SAP)是临床常见的急腹症,占急性胰腺炎的10%~20%。具有发病快、进展快、并发症多、预后差的特点[1]。此外,早期还可引起全身炎症反应综合征(SIRS)和多器官功能障碍综合征(MODS),死亡率为10%~30%[1]。Devani 等[2]研究显示SAP并发肾脏损伤时死亡率高达14.5%。相关研究证实炎症反应与SAP诱发的肾损伤发生发展密切相关[3],而大承气汤可通过抑制炎症反应减轻SAP[4]。本研究拟探讨大承气汤对重症急性胰腺炎大鼠肾损伤的保护作用及作用机制。
1 材料与方法
1.1 实验动物2018年1月至2020年12月在四川省人民医院开展本研究。SPF级雄性SD大鼠60只,体重为(210±20) g,购买于武汉大学实验动物中心,动物许可证号:SCXL (鄂) 2013-012。
1.2 实验试剂血清淀粉酶(amylase,AMS)、脂肪酶(LIS)、肌酐(Cr),高迁移率族蛋白1(HMGB1)和尿素氮(BUN)活性以及白介素-6(IL-6),单核细胞趋化蛋白-1(MCP-1)和肿瘤坏死因子-α(TNF-α)试剂盒均买于南京建成生物研究所。牛磺胆酸钠(Sigma,USA),大承气汤(厚朴 24 g,大黄 12 g,芒硝 6 g,枳实 12 g)购自于上海雷允公司,利用水提醇沉法制作大承气汤冻干粉),浓缩至生药量为(1.2 g/ml)。重组HMGB1(r-HMGB1)购买于Sigma 公司,Acetyl-HMGB1,HMGB1,TLR-4,Myd88,p-p65 和p65 一抗均购买于美国Abgent 公司。HE染色试剂由四川省人民医院病理实验室提供。水合氯醛(武汉谷歌),实时荧光定量PCR相关试剂盒购自TOYOBO 公司。
1.3 实验分组和模型构建60只SD大鼠采用随机数字表法分为假手术组(Sham)、重症急性胰腺炎组(SAP)、大承气汤治疗组(DCQD)和r-HMGB1组各15只。SAP组,DCQD组和r-HMGB1组通过十二指肠壁经胰胆管逆行注射牛磺胆酸钠构建重症急性胰腺炎模型[4],Sham组操作同上,但不注射牛磺胆酸钠。DCQD组在术前2 h灌胃给药(12 g/kg),r-HMGB1组在术前2 h灌胃给药(12 g/kg)和r-HMGB1,SAP和Sham组术后1 h腹腔注射相同生理盐水[4,5]。术后12 h通过水合氯醛麻醉处死大鼠,收集血清和肾脏。部分肾组织经甲醛固定,脱水,包埋成蜡块
1.4 生化指标测定利用酶联免疫吸附(ELISA)检测血清和肾组织匀浆中AMS、LIS、Cr,HMGB1和BUN的活性以及IL-6、MCP-1 和TNF-α表达水平,具体步骤参考试剂说明书。
1.5 肾脏病理形态检测取肾脏蜡块4 μm切片,脱蜡,透明,后行PAS染色,在显微镜下评估形态,损伤评分标准参考文献[8]。
1.6 肾组织IL-6、MCP-1 和TNF-α mRNA表达测定应用(PE Biosystems)软件设计引物序列,严格参照说明书提取肾组织总RNA,利用逆转录生成 cDNA,然后以 cDNA 做、作为模板进行Q-PCR。以20 μl 作为反应体系,SYBGreen qPCRMix为 10 μl,下游引物(10 μmol/L)为0.4 μl,上游引物(10 μmol/L)为0.4 μl,模板为5 μl,ROX reference dye为0.4 μl 并加入3.8 μl灭菌蒸馏水。扩增条件:预热 50 ℃ (2 min),预变性 95 ℃ (10 min),变性 95 ℃ (15 s),退火 60 ℃ (30 s),延伸 72 ℃ (30 s),总共 35 个循环;并以2-△△Ct 值代表目标基因IL-6、MCP-1 和TNF-α mRNA。
1.7 Western blotting检测Acetyl-HMGB1,HMGB1,TLR-4,MyD88,p-NF-κB和 NF-κ B表达将肾组织在磷酸酶抑制剂和RIPA作用下冰上匀浆,提取肾组织总蛋白,利用BCA法检测蛋白浓度,经上样,电泳,转膜,封闭,洗涤,加入一抗Acetyl-HMGB1 (1∶500)、HMGB1 (1∶1000)、TLR-4(1∶400)、Myd88(1∶400)、p-NF-κBp65(1∶500)、p65(1∶1000)和β-actin(1∶3000),4 ℃孵育过夜,洗涤,二抗IgG(1∶400),37 ℃孵育1 h。洗涤,显影显色,利用Image G进行图像分析检测蛋白表达量(β-actin为内参条带)。
1.8 统计学方法采用SPSS12.0统计学软件分析数据。计量资料以均数±标准差表示,采用单因素方差分析,两两比较采用t检验。P< 0.05为差异有统计意义
2 结果
2.1 各组大鼠血清AMS、LIS、Cr和BUN含量的比较与Sham组比较,SAP组血清AMS、LIS、Cr和BUN含量增高;与SAP组比较,DCQD组血清AMS、LIS、Cr和BUN含量降低(P<0.05);与DCQD组比较,r-HMGB1组血清AMS、LIS、Cr和BUN含量增高(P<0.05)。见表1。
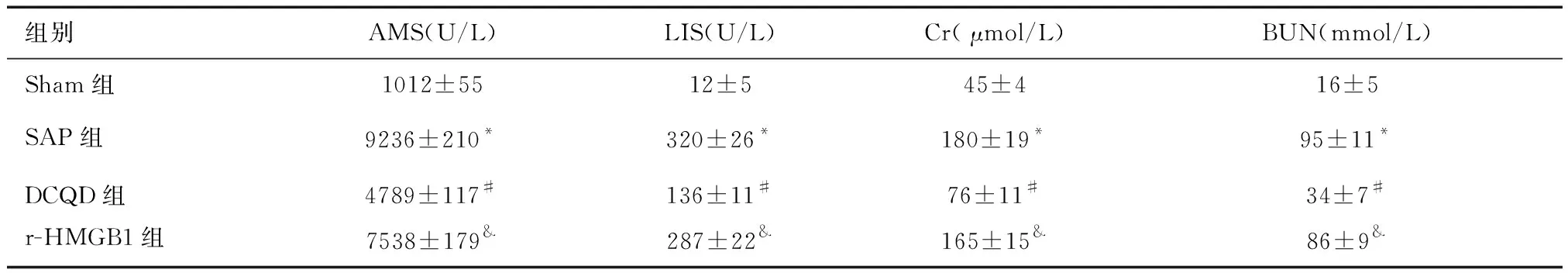
表1 各组大鼠血清AMS、LIS、Cr和BUN含量的比较
2.2 各组大鼠肾脏病理形态的比较如图1所示,Sham组肾小管细胞形态大小正常;SAP组可见肾小管刷状缘缺失,管腔扩张或塌陷,细胞脱离管状基底膜,炎症细胞浸润及肾脏病理损伤较Sham组明显增高。与SAP组相比,DCQD组肾小管刷状缘缺失,管腔扩张或塌陷,细胞脱离管状基底膜,炎症细胞浸润及肾脏病理损伤评分均减轻。与DCQD组相比,r-HMGB1组肾小管刷状缘缺失,管腔扩张或塌陷,细胞脱离管状基底膜,炎症细胞浸润及肾脏病理损伤评分均明显加重。
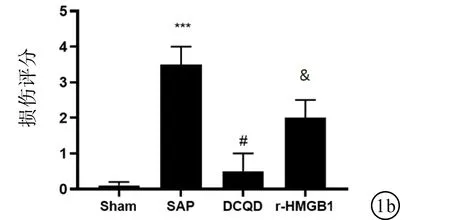
图1 PAS染色检测DCQD对肾组织病理损伤影响 a:PAS检测DCQD对肾组织病理结构的影响(200×); b:肾脏病理损伤评分。***与Sham组比较,P<0.001;#与SAP组比较,P<0.05;&与DCQD组比较,P<0.05
2.3 各组肾脏Acetyl-HMGB1,HMGB1以及血清中HMGB1蛋白表达水平比较与Sham组相比,SAP组肾脏Acetyl-HMGB1和血清中HMGB1表达升高,肾脏HMGB1表达量降低(P<0.05);与SAP组相比,DCQD组、SAP组肾脏Acetyl-HMGB1和血清HMGB1表达降低,肾脏HMGB1表达量增高(P<0.05);与DCQD组相比,r-HMGB1组、SAP组肾脏Acetyl-HMGB1和血清HMGB1表达升高,肾脏HMGB1表达量降低(P<0.05)。见图2。

图2 Western blotting和ELISA检测DCQD对肾脏Acetyl-HMGB1,HMGB1表达以及血清中HMGB1含量的影响 a:Western blotting检测Acetyl-HMGB1和HMGB1表达;b:半定量评估Acetyl-HMGB1和HMGB1表达;c:ELISA检测血清中HMGB1活性。***与Sham组比较,P<0.001;#与SAP组比较,P<0.05;&与DCQD组比较,P<0.05
2.4 各组肾脏TLR-4、MyD88、p-p65和 p65蛋白表达水平比较与Sham组相比,SAP组TLR-4、MyD88、p-p65蛋白表达量增高(P<0.05);与SAP组相比,DCQD组TLR-4、MyD88、p-p65蛋白表达量降低(P<0.05);与DCQD组相比,r-HMGB1组TLR-4、MyD88、p-p65蛋白表达量增高(P<0.05),各组p65蛋白表达量比较,差异无统计学意义(P>0.05)。见图3。
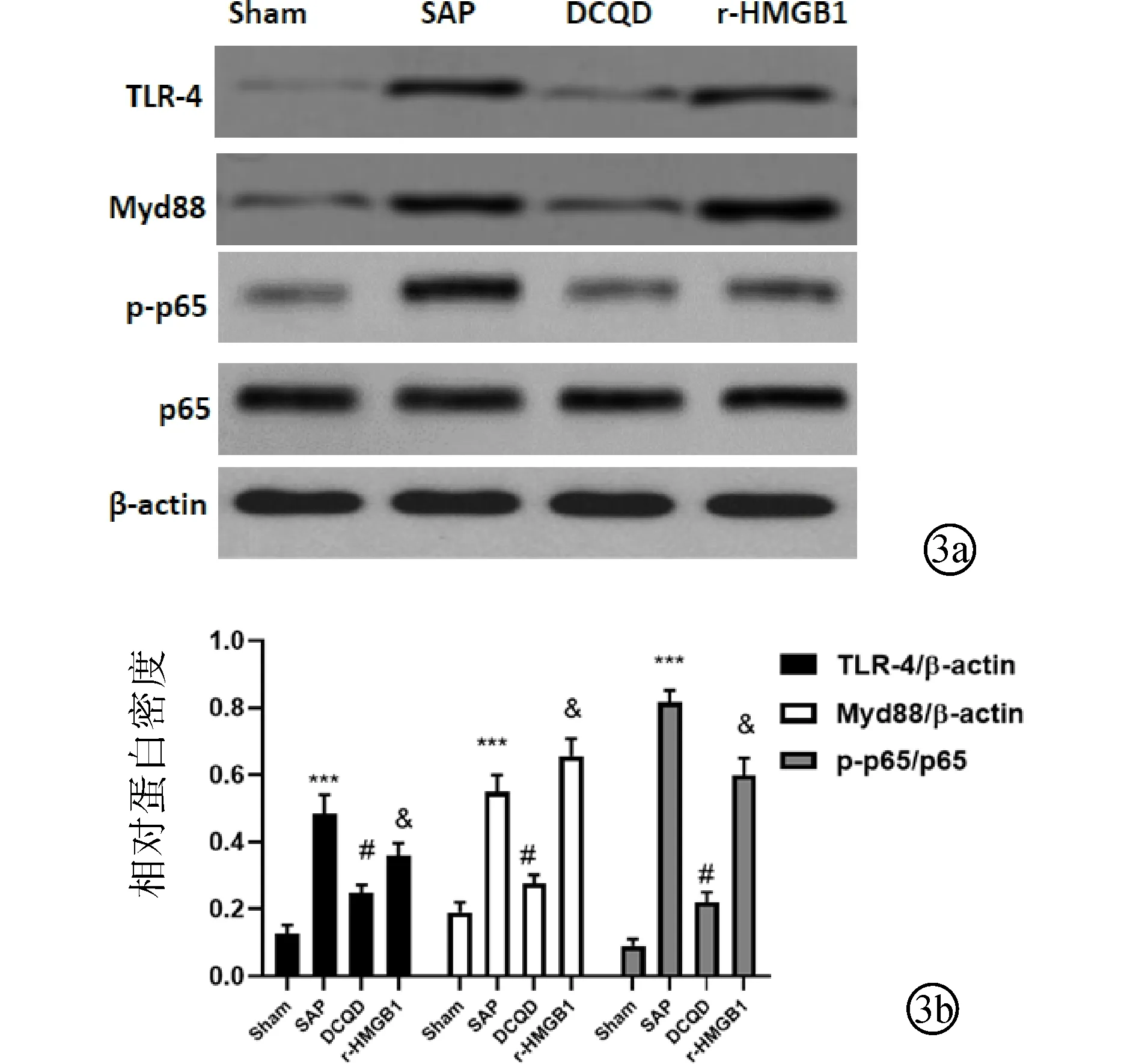
图3 Western blotting检测DCQD对肾脏TLR-4、MyD88、p-p65和 p65蛋白表达影响 a:Western blotting检测TLR-4、MyD88、p-p65和p65蛋白表达;b:半定量评估TLR-4,MyD88,p-p65和 p65蛋白表达。***与Sham组比较,P<0.001;#与SAP组比较,P<0.05;&与DCQD组比较,P<0.05
2.5 各组肾脏中IL-6、MCP-1 和TNF-α mRNA的比较与Sham组相比,SAP组肾脏中IL-6、MCP-1 和TNF-α mRNA表达水平增高(P<0.05);与SAP组相比,DCQD组肾脏中IL-6、MCP-1 和TNF-α mRNA表达水平降低(P<0.05);与DCQD组相比,r-HMGB1组肾脏中IL-6、MCP-1 和TNF-α mRNA表达水平增高(P<0.05)。见表2。

表2 各组肾脏中IL-6、MCP-1 和TNF-α mRNA的比较
2.6 各组血清中IL-6、MCP-1 和TNF-α 含量比较
与Sham组相比,SAP组血清中IL-6、MCP-1 和TNF-α 含量增高(P<0.05);与SAP组相比,DCQD组血清中IL-6、MCP-1 和TNF-α 含量降低(P<0.05);与DCQD组相比,r-HMGB1组血清中IL-6、MCP-1 和TNF-α含量增高(P<0.05)。见表3。

表3 各组血清中IL-6、MCP-1 和TNF-α 含量比较 (pg/ml)
2.7 各组肾组织IL-6、MCP-1 和TNF-α 含量比较
与Sham组相比,SAP组肾组织中IL-6、MCP-1和TNF-α含量增高(P<0.05);DCQD组与SAP组相比,肾组织中IL-6、MCP-1 和TNF-α 含量降低(P<0.05);与DCQD组相比,r-HMGB1组肾脏中IL-6,MCP-1和TNF-α含量增高(P<0.05)。见表4。

表4 各组肾组织IL-6、MCP-1 和TNF-α 含量比较 (pg/ml)
3 讨论
继发性肾损伤是SAP最常见,最凶险的胰腺外并发症,是导致SAP患者死亡的重要原因之一。既往研究证实继发的肾脏受损程度与SAP的危重程度呈正相关,而肾脏受损程度会严重影响SAP患者的病程和预后。因此研究SAP并发肾损伤的发病机制具有重大意义[2,3]。
本研究通过胰胆管在大鼠逆行注射牛磺胆酸钠构建SAP模型,结果显示血清中AMS、LIS、ALT和AST含量以及肾脏病理损伤均明显增高,这与既往研究报道相一致,提示重症胰腺炎诱导肾脏损伤模型构建成功,并进一步证实了SAP可继发严重的肾脏损害[3,4]。大承气汤的主要成分包括厚朴、大黄、芒硝和枳实,其中大黄等多种成分研究发现具有抑制炎症和调节免疫等功效评[4]。而HMGB-TLR-4介导的炎症通路在重症胰腺炎的发生发展中起着重要作用,但对SAP继发的肾脏损伤作用机制尚不清楚[3-5]。结果显示大承气汤治疗可明显减轻血清中AMS、LIS、Cr和BUN活性以及肾脏病理损伤,提示大承气汤可减轻SAP诱发的肾脏损害。r-HMGB1可明显增加血清中AMS、LIS、Cr和BUN活性以及肾脏病理损伤,提示r-HMGB1可抑制大承气汤对SAP诱发的肾脏损害有保护作用。
既往研究显示炎症反应在SAP诱发肾脏损害中起重要作用[3]。IL-6、MCP-1和TNF-α是SAP诱发肾脏损害中最受关注的炎症因子[3]。IL-6由巨噬细胞、T细胞和T 淋巴细胞分泌,可调节机体免疫反应[6];MCP-1是趋化因子之一,可启动炎症级联反应,调节炎症因子的分泌和组织损伤[7]。TNF-α是炎症的始动因子,可调节多种炎症因子释放如 IL-6,还可促进氧自由基和一氧化氮的生成以及白细胞的趋化和黏附[7]。结果显示IL-6、MCP-1和TNF-α在血清和肾脏均明显增高,进一步证实了炎症反应在SAP诱发肾脏损害中的关键作用,大承气汤治疗可明显减少血清和肾脏中IL-6、MCP-1和TNF-α的表达,提示大承气汤可通过抑制炎症反应减轻SAP诱发的肾损伤。而r-HMGB1可明显增加血清和肾脏中IL-6、MCP-1和TNF-α的表达,提示r-HMGB1可减轻大承气汤对炎症反应的抑制作用HMGB1-TLR4/NF-κB 信号通路在肾脏炎症反应中起着关键的枢纽作用[8]。高迁移率族蛋白1是真核细胞核中的一种非DNA结合蛋白,是损伤相关模式分子的典型代表[8]。当实质细胞坏死或受损,以及免疫细胞激活时,核内的HMGB1可由于乙酰化修饰导致结构的改变而释放至胞外,作为内源性的“危险信号分子”被天然免疫系统识别,在早期启动免疫反应,募集免疫效应细胞,“瀑布式”放大免疫反应,导致炎症和免疫损伤,成为激活免疫炎症损伤的“扳机点[8]。既往研究显示HMGB1可通过激活广泛分布在肾脏细胞表面的模式识别受体TLR4在SAP合并器官损伤的发生及发展过程中起重要作用[9]。激活的TLR4 可通过激活MYD88引起NF-κB上游的IκB蛋白磷酸化降解以及NF-κBp65 的磷酸化激活,然后促使IL-6、MCP-1和TNF-α等炎症因子的表达[9]。结果显示,DCQD治疗可明显减轻SAP诱导的肾脏HMGB1乙酰化的修饰,减少HMGB1的分泌以及肾脏TLR-4、MyD88,p-p65蛋白的表达,而r-HMGB1可减轻DCQD对HMGB1乙酰化修饰抑制作用以及促进HMGB1-TLR4/NF-κB 信号通路的激活,提示DCQD可通过抑制HMGB1乙酰化修饰,继而抑制HMGB1-TLR-4/NF-κB信号途径介导的炎症反应。
