茶碱缓释片的制备及与参比制剂的体外溶出相似性评价
2021-09-22黎德南韦伟宁
黎德南 韦伟宁

[摘要]目的阐述茶碱缓释片的制备方法及与参比制剂的释放度相似性评价。方法本研究以茶碱为原料,以羟乙基纤维素为骨架材料、十六十八醇为阻滞剂、聚维酮 K30为粘合剂,滑石粉、硬脂酸镁为润滑剂,采用湿法制粒后压片的工艺,制得茶碱缓释片。参照 JP 中茶碱缓释片溶出度项下的检测方法,分别以4种溶出介质,检测自研制剂与参比制剂的释放度,以评价其体外溶出相似性。结果自研制剂的体外释放速度恒定,与参比制剂比较,溶出曲线相似因子 f2>50,具有体外溶出相似性。结论自研制剂处方、工艺对确保茶碱缓释片与参比制剂生物等效有重大意义,可提高茶碱缓释片临床用药的安全性与有效性。
[关键词]茶碱;缓释片;参比制剂;释放度;生物等效性
[中图分类号] R284.1 [文献标识码] A [文章编号]2095-0616(2021)23-0082-04
Preparation of theophylline extended -release tablets and evaluation of in vitro dissolution similarity with the reference preparation
LI De'nan WEI Weining
1. College of Pharmacy, Guilin Life and Health Career Technical College, Guangxi, Guilin 541100, China;2. Guangxi Hongshantang Biotechnology Co., Ltd., Guangxi, Nanning 530000, China
[Abstract] Objective To describe the preparation method of theophylline extended-release tablets and the evaluation of dissolution similarity with the reference preparation. Methods This research described that the theophylline extended-release tablets were prepared by taking theophylline as raw material, hydroxyethyl cellulose as the backbone material, cetostearyl alcohol as the blocking agent, povidone K30 as the binder, talc and magnesium stearate as the lubricant, and adopting the process of wet granulation followed by tablet compression. With reference to the testing method under the Dissolution of theophylline extended-release tablets in JP, the in vitro dissolution similarity was evaluated by testing the dissolution rate of the self-made preparation and the reference preparation using four dissolution media, respectively. Results The in vitro dissolution rate of the self-made preparation remains constant. The dissolution curve similarity factor f2 between the reference preparation and the self-made preparation was more than 50, with similar in vitro dissolution. Conclusion The prescription and process of the self-made preparation are of great significance to ensure the bioequivalence of theophylline extended-release tablets and the reference preparation, and can improve the safety and effectiveness of clinical medication of theophylline extended-release tablets.
[Key words] Theophylline; Extended-release tablets; Reference preparation; Dissolution rate; Bioequivalence
茶堿(theophylline)是一种平滑肌松弛药。临床上主要用于治疗哮喘和哮喘性支气管炎。成人用药后半衰期为5~6 h,儿童平均为3.5 h。茶碱治疗血药浓度较窄(5~20μg/ml),个体差异较大,清除率和半衰期也因人而异。普通茶碱片给药后血药浓度容易出现“峰谷”现象,引起头痛、恶心、失眠、抽筋及过敏等毒副作用,茶碱缓释片可减少给药次数,有效避免血药浓度的“峰谷”现象,减轻给药后的毒副作用[1]。
部分已上市口服固体仿制制剂安全无效[2-3],甚至有的制剂发生安全事件,故2016年3月国家正式开启仿制药质量与疗效一致性评价工作[4]。目前,上市的国产茶碱缓释片仿制药的批准文号有40个[5],均有待进行一致性评价。本研究参照 JP 中茶碱缓释片释放度项下的检测方法,主要以溶出曲线相似度 f2>50[6]为指标,开展制备工艺的研究,以评价自制产品与参比制剂体外溶出的等效性。
1仪器与试药
1.1仪器
AUW220D 型电子天平(日本岛津株式会社),电子分析天平(宁波市鄞州华丰电子仪器厂), Yk-60型摇摆式颗粒机(常州市润邦干燥设备科技有限公司),DHG-9070A 型鼓风干燥箱(上海一恒科学仪器有限公司),CT-C-O 型热风循环烘箱(常州市润邦干燥设备科技有限公司),SHB-30型柱式混合机(常州市润邦干燥设备科技有限公司),ZP-9B 型旋转式压片机(广州市德工机械设备有限公司);RC12AD 溶出试验仪(天津天大天发科技有限公司),UV-2401型紫外可见分光光度计(日本岛津仪器有限公司)。
1.2试药
茶碱(石药集团新诺制药股份有限公司,批号:201606626)、羟乙基纤维素(ASHLAND LNC,批号: M2104)、十六十八醇(湖南尔康制药股份有限公司,批号:105320170501)、聚维酮 K30(博爱新开源制药股份有限公司,批号:P170529009)、滑石粉(广西龙胜华美滑石开发有限公司,批号:1709124)、硬脂酸镁(石药集团新诺制药股份有限公司,批号:201606626);茶碱缓释片参比制剂(日本日医工株式会社生产,规格:100 mg/片,批号:C00100);茶碱对照品(中国食品药品检定研究院,批号100121-201104;含量:按100%计)。
2方法与结果
2.1释放度的测定方法
参照 JP 方法,以水900 ml 为溶出介质,采用桨法,转速为100 r/min,在1、3、4、6、8、24 h 分别取溶液5 ml 滤过,并即时补充相同温度、相同体积的溶出介质;分别精密量取续滤液适量,各用纯化水定量稀释制成每1 ml 中约含无水茶碱7μg 的溶液,照紫外可见分光光度法(通则0401[7])在271 nm 处测定吸光度;另取茶碱对照品适量,精密称定,加水溶解并定量稀释制成每1 ml 中约含无水茶碱7μg 的溶液作为对照品溶液,同法测定吸光度,分别计算每片在不同时间点的累积溶出量。
2.2處方、工艺的研究
国家药品监督管理局规定茶碱缓释片一致性评价中,参比制剂为原研厂家——日本日医工株式会社生产的制剂[8]。通过参考参比制剂说明书[9]、参比制剂 IF 资料[10],日本橙皮书[11]溶出曲线等文献资料,设计多个处方,按不同处方制备样品,通过测定样品溶出曲线,并与参比制剂比较,优选最佳组方。茶碱缓释片的处方、工艺研究如下。
2.2.1处方的拟定以羟乙基纤维素为骨架材料,十六十八醇为阻滞剂,聚维酮 K30为粘合剂,滑石粉、硬脂酸镁为润滑剂,采用单因素考察法进行处方筛选,处方中各组分占处方量(处方量以1000片计)见表1。
2.2.2试验中拟采取的工艺
2.2.2.1处方1~2的样品制备工艺按处方量称取茶碱、羟乙基纤维素、聚维酮 K30预混合均匀,加入60%乙醇120 ml 制软材,过16目筛制粒,于60℃~65℃下干燥,整粒,与硬脂酸镁混匀,压片,即得。2.2.2.2处方3~6的样品制备工艺按照处方量称取茶碱、羟乙基纤维素、聚维酮 K30预混合均匀;十六十八醇加入60%乙醇120 ml 溶解后作为润湿剂制软材,过16目筛制粒,于60℃~65℃下干燥,整粒、压片,即得。
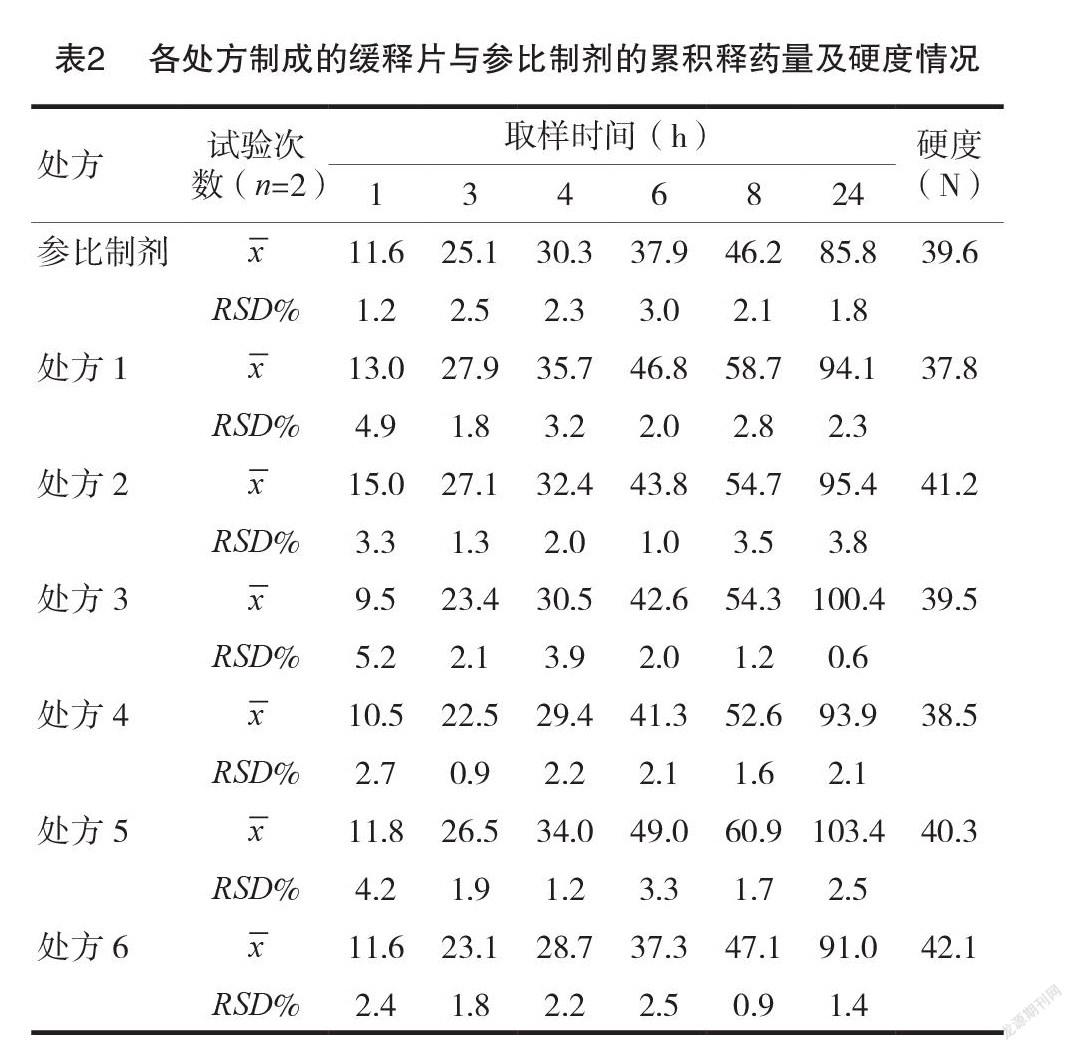
2.2.3实验结果取按以上2.2.1、2.2.2中的处方、工艺制得的6个茶碱缓释片样品及一批参比制剂,按照 JP 的测定方法分别测定溶出曲线,结果见表2和图1。实验结果表明,处方6制成的缓释片溶出曲线与参比制剂最相似,为最优处方。
2.2.4考察乙醇浓度与用量对自制制剂的影响照以上处方6的配比称取茶碱、羟乙基纤维素、聚维酮 K30混合均匀,备用;处方量的十六十八醇分别采用①70%乙醇150 ml、②60%乙醇120 ml、③60%乙醇150 ml、④60%乙醇180 ml 溶解,作为润湿剂制软材,过16目筛制粒,干燥2 h,整粒,与处方量的滑石粉、硬脂酸镁混匀,压片,即得。制备过程中考察制粒情况,片剂的硬度,片面情况,并对制得的各样品照以上2.1中的方法测溶出曲线,并计算与参比制剂的溶出相似度。结果见表3~4。
以上试验结果表明,用60%乙醇150 ml 溶解处方量的十六十八醇为最佳方法,制得的样品与参比制剂的溶出曲线相似度 f2最大,为71.8>50;制粒的过程中软材黏性适中,可顺利通过16目筛,制得的颗粒软硬适中,可压性好,压得的片剂完整光洁,硬度符合要求,能满足大生产的需求。
2.2.5优选出的处方、工艺照最优处方(处方6),将处方量的茶碱、羟乙基纤维素、聚维酮 K30预混合均匀,加入十六十八醇的60%乙醇溶液(处方量的十六十八醇用60%乙醇150 ml 溶解,即得),作为润湿剂,制软材,过16目筛制粒,湿颗粒置干燥箱中,于60℃干燥2 h,整粒;颗粒与滑石粉、硬脂酸镁混匀后压片(硬度控制在40~45 N)。
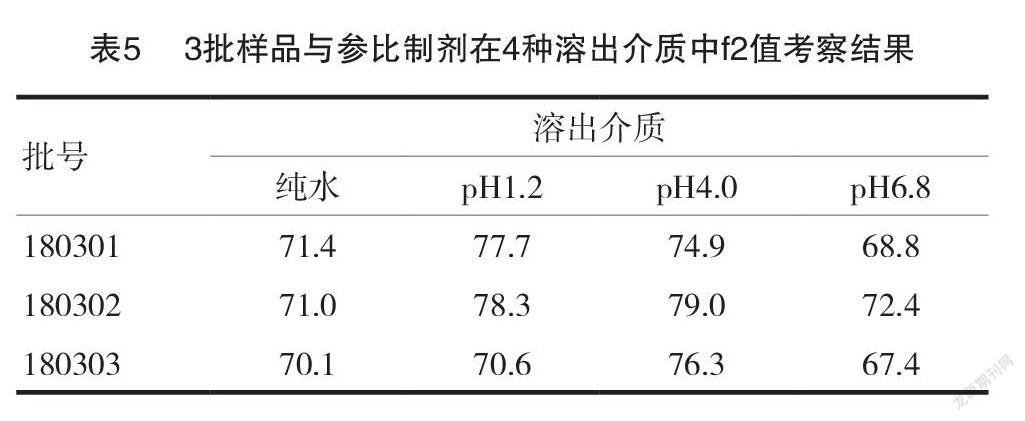
2.3工艺放大自制样品与参比制剂的体外溶出相似性评价
取3批工艺放大的样品(180301~180303),及1批参比制剂分别以纯水、pH1.2盐酸溶液、 pH4.0柠檬酸盐缓冲液、pH6.8磷酸盐缓冲液为溶出介质,照以上2.1中溶出度测定方法测定,计算每片在各时间点的累计溶出量,考察自制样品与参比制剂的溶出曲线 f2值,见表5。结论:3批工艺放大样品与参比制剂比较,在4种不同溶出介质中溶出曲线的 f2值均>50,说明自制样品与参比制剂体外溶出具有相似性。
3讨论
3.1处方中各辅料的作用
本处方中,茶碱为原料,以羟乙基纤维素为骨架材料,十六十八醇为阻滞剂、聚维酮 K30为粘合剂,滑石粉、硬脂酸镁为润滑剂,采用湿法制粒后压片制得茶碱缓释片。处方中羟乙基纤维素与十六十八醇的配比对释放度控制起到关键的作用;另外,聚维酮 K30在处方中,不仅起到粘合剂的作用,还起到致孔剂的作用,能促进药物的溶出,需严格控制聚维酮 K30的用量,才能保证片剂完整、光洁,硬度及释放度符合要求符。
3.2润湿剂对制剂的影响
乙醇溶液的浓度以及用量,对自制片剂的释放度产生一定的影响,当乙醇溶液浓度增大或使用量减少时,制得的样品释放速度加快。造成这影响的主要原因是润湿剂的浓度与用量的变化引起颗粒的堆密度、粒度、硬度及可压性的差异。
3.3自研制剂的缓释机制及影响因素
十六十八醇熔点为49~56℃,易溶于乙醇[12-13],用高浓度的乙醇有利于十六十八醇的溶解,但制粒时制得的颗粒松散,细粉较多,使制得的样品与参比制剂比较,溶出曲线相似因子 f2降低;当用60%乙醇溶解时,于50℃水浴中保温能促进十六十八醇的溶解。制粒过程中十六十八醇被均匀地涂布在颗粒表面,形成一层具备一定孔隙率的水不溶性薄膜,协同羟乙基纤维素形成的水溶性凝胶性骨架,构成一个综合的缓释系统。当缓释片在胃肠道中遇到消化液时,片剂表面的颗粒首先被润湿,随着聚维酮 K30的溶解,消化液进入片剂外层颗粒的内部,羟乙基纤维素随之润湿形成凝胶层,药物从羟乙基纤维素形成的凝胶层中溶解,并从十六十八醇涂膜上的致孔腔道扩散至消化道中;缓释片表面逐渐被溶蚀,消化液逐层往内润湿颗粒的表面,使茶碱根据一定的速率释放;药物的释放过程,就是颗粒被润湿,羟乙基纤维素骨架与十六十八醇涂膜逐渐被溶蚀,药物溶解、缓慢扩散的过程。故制得的颗粒的均匀性、软硬度以及片剂的硬度均会对样品中药物的释放产生影响。
3.4溶出曲线的评价意义
针对仿制药,通过与原研药比较 pH1.0~7.0溶出介质的溶出行为,只要体外溶出行为与参比制剂一致,则出现生物不等效的概率是极低的,即溶出一致≈疗效一致[14-15],故本文有针对性地对制备的茶碱缓释片与参比制剂的体外的多条溶出曲线[16-18]溶出相似性进行对比研究,并以此评价制备工艺的可行性。研究表明,自研的制剂在4种溶出介质中的溶出速率相近,说明胃肠道中消化液 pH 值对自制的缓释片的药物释放过程影响较小;与参比制剂比较,在4种溶出介质中溶出曲线的 f2值均>50,具有体外溶出相似性。本研究为茶碱缓释片生物等效性试验的可行性提供依据,并对茶碱缓释片工业化生产具有指导意义。
[参考文献]
[1]雷筱平,李卫平.茶碱缓释片药物释放影响因素研究[J].中国现代应用药学杂志,1998,15(6):31-32.
[2]国务院.国务院关于印发国家药品安全“十二五”规划的通知[EB/OL].北京:国务院,2012(2012-1-20)[2018-1-20].https://www.nmpa.gov.cn/zwgk/ghcw/ ghjh/20120120120001213.html.
[3]黄滔,孔祥生,张方.一致性评价品种选择及评价方式[J].中国医药科学,2017,7(2):194-196.
[4]国务院.国务院办公厅关于开展仿制药质量和疗效一致性评价的意见(国办发〔2016〕8号)[EB/OL].北京:国务院,2016(2016-3-5)[2018.1.20].http://www.gov.cn/zhengce/ content/2016-03/05/content5049364.htm.
[5]国家药品监督管理局.数据查询(药品)[DB/OL].北京:国家药品监督管理局.[2018-1-17].http://app1.nmpa.gov. cn/data_nmpa/face3/base.jsp?tableId=25&tableName=TABLE25&title=%E5%9B%BD%E4%BA%A7%E8%8D%AF%E5%93%81&bcId=152904713761213296322795806604.
[6]夏锦辉,刘昌孝.固体药物制剂的体外溶出度的统计学评价分析[J].中国药学杂志,2000,35(2):130-131.
[7]中国药典委员会编.中国药典(2015年版第四部)[S].北京:中国医药科技出版社,2015:38-40.
[8]国家食品药品监督管理总局.总局关于发布仿制药参比制剂目录(第七批)的通告(2017年第115号)[EB/OL].北京:国家药品监督管理局,2017(2017-7-21)[2018-1-17]. http://www.cde.org.cn/news.do?method=viewInfoCommon&id=7d7f244e72fcfa8a.
[9]日本日医工株式会社.茶碱缓释片日文版说明书[DB/ OL].日本东京:PMDA.2002(2012-12)[2018-1-17]. https://www.pmda.go.jp/PmdaSearch/iyakuDetail/Result DataSetPDF/530169_2251001G1025_1_17.
[10]日本日医工株式会社.茶碱释片 IF 文件(日本标准产品分类号:872251)[DB/OL].日本东京: PMDA.2002(2012-12)[2018-1-17].https://www. pmda.go.jp/PmdaSearch/iyakuDetail/ResultDataSetPDF/530169_2251001G1025_1_17.
[11]日本厚生省.日本橙皮書[DB/OL].日本:日本厚生省医药安全局.1998(1998-7-15)[2018-1-17].http:// www.jp-orangebook.gr.jp/english/data/qualityReevaluration/NotifiedNo/20/DissolutionTest/detail.
[12]RC 罗, PJ 舍斯基, PJ 韦勒.药用辅料手册[M].北京:化学工业出版社,2005:148-149.
[13]中国药典委员会编.中国药典(2015年版第四部)[S].北京:中国医药科技出版社,2015:458.
[14]青柳伸男.如何为临床提供优良的、性价比高的仿制药[J].医疗,2002,56(8):457-460.
[15]谢沐风.BE 维新:如何提升试验成功率[N].医药经济报,2015-11-18(7).
[16]谢沐风.国外药政部门采用溶出曲线评价口服固体制剂内在品质情况简介[J].中国药事,2008,22(3):257-261.
[17]谢沐风.改进溶出度评价方法,提高固体药物制剂水平—论如何提高我国口服固体制剂的内在品质(溶出度研究系列二)[J].中国药品标准,2006,7(1):43-47.
[18]张启明,谢沐风,宁保明,等.采用多条溶出曲线评价口服固体制剂的内在质量[J].中国医药工业杂志,2009,40(12):946-955.
(收稿日期:2021-04-17)
