高效催化水解纤维素的固体酸特性及其影响因素的研究进展
2021-09-21黎鹏飞薛俊程董翠华庞志强
黎鹏飞 薛俊程 董翠华 庞志强

摘要:本文综述了固体酸催化水解纤维素的最新研究进展。基于固体酸的酸性位点和孔隙结构,研磨预处理和均匀水解可以作为提高固体酸水解纤维素效率的方法,分析了纤维素与固体酸之间的相互作用,对固体酸水解纤维素的发展前景进行了展望。
关键词:固体酸;催化剂;纤维素;水解
中图分类号:TQ352.78 文献标识码:A DOI:10.11980/j. issn.0254-508X.2021.12.013
Research Progress on Properties and Influence Factors of Solid Acids with High Catalytic Activity on Cellulose Hydrolysis
LI Pengfei1 XUE Juncheng1 DONG Cuihua1,2 PANG Zhiqiang1,*
(1. State Key Lab ofBio-based Material and Green Papermaking,Qilu University of Technology (Shandong Academy of Sciences),Jinan, Shandong Province,250353;2. School ofLight Industry Science and Engineering,Qilu University of Technology(Shandong Academy of Sciences),Jinan,Shandong Province,250353)
(*E-mail :zhiqiang8505@126. com)
Abstract :The latest research advances on catalytic hydrolysis of cellulose using solid acid were reviewed in this paper . Based on the acidic site and pore structure of solid acids,the cellulose hydrolysis effiency could be improved by the abrasive pre-treatment and uniform hydroly? sis. The interactions between cellulose and solid acids were analyzed,and the prospects of cellulose hydrolysis using solid acids were dis ? cussed.
Key words :solid acids;catalyst;cellulose;hydrolysis
随着社会发展,化石能源短缺问题日益突出,基于可再生木质纤维素的燃料和生物化学品的发展有望减少人类对传统化石资源的依赖和温室气体的排放,并提高能源安全[1]。木质纤维中的纤维素可水解为葡萄糖,进一步转化为有价值的下游化学品(如糠醛、5-羟甲基糠醛、乙酰丙酸)和可再生生物燃料(如生物乙醇、生物丁醇和碳氢化合物)[2]。
纤维素通过酸或酶(纤维素酶)的催化水解作用裂解糖单元之间的β-1,4糖苷键以生产葡萄糖[3-4]。然而,纤维素的晶体结构和纤维素分子间致密的氢键网络(如图1所示)使之不溶于水和大多数有机溶剂,化学反应性差[5]。此外,纤维素被半纤维素和木质素包裹在木质纤维中,进一步降低了反应可及性。因此,通过经济有效地方法水解木质纤维素中的纤维素以生产葡萄糖是具有挑战性的,也是基于糖平台的生物精炼的工业化技术瓶颈[6]。
酶(纤维素酶)和均相Br?nsted酸(如硫酸和盐酸)是水解纤维素最常用的催化剂[7]。然而,纤维素酶生产成本高且难回收,且酶水解需要进行高能耗和高成本的预处理以消除其结构顽固性[1];硫酸和盐酸虽然成本较低,但存在不良降解、糖酸分离、设备腐蚀、酸回收和废水处理困难等问题。因此,用于纤维素水解的固体酸催化剂受到越来越多的关注。
近20年来,人们在高性能固体酸催化剂合成、催化机理、提高纤维素水解的水热稳定性和可回收性等方面取得了许多成就[8]。然而在成功应用于纤维素水解之前,固体酸仍有许多未知问题。用于催化的固体酸酸性位点、孔隙结构和与纤维素的相互作用是固体酸的关键结构特征和性质,对其水解纤维素的性能有重要影响。本文总结了固体酸高效催化纤维素水解的研究进展,分析了纤维素与固体酸之间的相互作用,并对固体酸水解纤维素的发展前景进行了展望。
1 固体酸分类及制备方法
1.1 固体酸分类
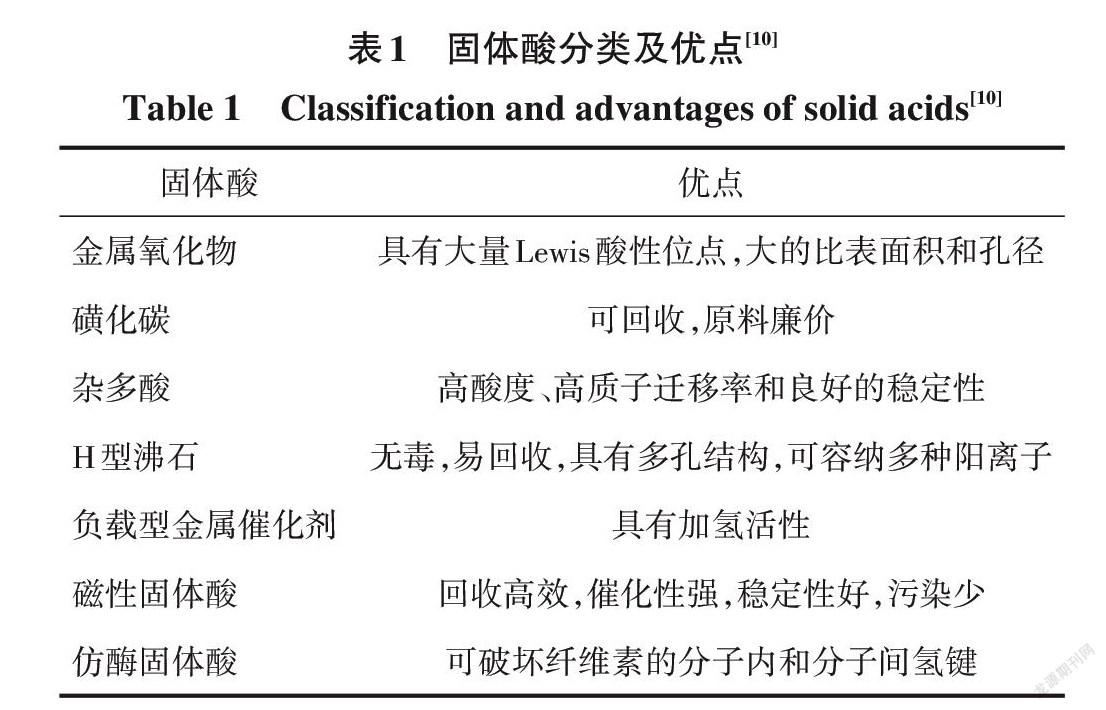
固体酸是带有表面酸性位点( Lewis 酸或Br?nst? ed 酸位点)的固体框架结构酸,可用于纤维素的催化水解。固体酸具有可回收、腐蚀性小和对环境友好等优势[9]。固体酸主要包括类型如表1所示[10]。
1.2 制备方法
固体酸传统制备方法有沉淀法、浸渍法、离子交换法、混合法及热熔融法。沉淀法主要用于制备高含量的非贵金属、金属氧化物或催化剂载体;混合法是将多种组分在机械作用下混合制备成多组分催化剂;离子交换法是将活性组分(通常是阳离子)与载体表面可交换的离子进行置换,再经洗涤、焙烧等处理得到金属负载型催化剂,多用于制备低含量、高利用率的贵金属催化剂。
随着对固体酸研究的不断深入,也演变和发展了一些新的制备方法,比如化学气相沉积法、溶胶-凝胶法和微乳液法等。
2 固体酸的酸解机理
纤维素是由 D-葡萄糖以β-1,4糖苷键连接而成的长链多糖化合物,聚合度通常在100~20000之间,聚合度越高,β-1,4葡聚糖链之间的氢键作用越强,溶解性越差。酸解过程是将纤维素水解为寡糖或单糖,固体酸水解纤维素的原理与其他酸类似。首先,固体酸表面的酸性基团产生质子,质子随机攻击纤维素中的β-1,4糖苷键,纤维素发生水解生成纤维二糖;然后酸性基团使纤维二糖的β-1,4糖苷键发生断裂,水解成葡萄糖[11]。不同固体酸的具体水解机理也不相同,以碳基固体酸水解纤维素为例: Kitano 等人[12]发现,一系列具有单一基团强Br?nsted固体酸催化剂不能成功水解水溶性β-1,4-葡聚糖,这是由于固体酸酸性位点不能分解葡聚糖的氢键和β-1,4-糖苷键。与之相反,无定形碳催化剂含有高密度的磺酸基、羧基和羟基,能有效水解长链β-1,4-葡聚糖,这归因于磺酸基的强Br?nsted酸性位点、羟基和羧基提供有效吸附位点和无定形碳高可及性三者形成的协同效应。因此,碳基催化剂可随机攻击纤维素β-1,4-糖苷键产生葡萄糖,且没有5-羟甲基糠醛和乙酰丙酸等副产物生成。其他催化剂如负载型金属催化剂,在固体酸的质子将纤维素水解为糖以后,在 H2存在下金属催化剂还将其进一步转化為糖醇。杂多酸在催化水解纤维素时,除了 H+参与水解反应切断糖苷外,杂多阴离子可与中间体形成稳定配合物,降低反应活化能,提高反应效率,且其特殊的空间结构能促进纤维素无定形区选择性水解。因此,固体酸的水解效率受到固体酸酸性位点及催化活性、吸附性能、孔隙结构和反应条件等因素的影响。
3催化纤维素水解固体酸的酸性位点
固体酸将纤维素水解为葡萄糖需要酸性位点。大多数固体酸带有Br?nsted酸基团,如强磺酸( SO3H)或弱羧酸( COOH)。还有一些固体酸,如 H 型沸石和金属氧化物,不仅具有强的Br?nsted酸性,而且有 Lewis酸性[13]。
3.1 SO3H基团和催化活性
SO3H 作为一种强酸基团,能在纤维素水解过程中为β-1,4糖苷键提供质子,聚合物基固体酸、无机固体酸和碳基固体酸都可使用 SO3H 作为强Br?nsted酸性位点[14]。Pang 等人[15]制备的磺化碳催化剂具有2.39 mmol/g 的总酸密度( SO3H 密度0.63 mmol/g),能够在150℃下、24 h 内将球磨纤维素水解成葡萄糖,水解效率为74.5%。固体酸的水解性能主要受2个方面影响:①SO3H 酸性位点越多,催化活性越高;② SO3H 基团的分布和位置会影响表面酸性位点活跃程度,内部 SO3H基团的可及性易受碳催化剂碳化条件的影响[16]。然而, SO3H 基团的强酸性可以催化葡萄糖脱水成5-羟甲基糠醛,并进一步分解成乙酰丙酸和甲酸。
3.2弱酸位基团和催化活性
仅含 COOH等弱酸位基团的固体酸和纤维素酶的弱酸基团都能催化水解纤维素的糖苷键。To等人[16]用羧酸、酚羟基和内酯基团官能化得到的中孔碳(总酸度2.2 mmol/g)显示出水解 Avicel 纤维的良好能力,葡萄糖产率67.2%。此外,弱酸位还在纤维素底物对固体酸的吸附中起关键作用,这对于纤维素的有效水解是必不可少的,且含碳固体酸上的酚羟基与纤维素水解的葡萄糖产率间成非正比的相关性。
3.3 Br?nsted酸性位点的催化机理
与催化剂类型无关,β-1,4糖苷键的分解基本上是由酸(质子)催化的。例如,来自均质酸电离产生的质子或纤维素酶催化域中的弱酸位点都能够催化纤维素水解。以纤维二糖为例,固体酸催化水解纤维素的机理如下[8]。
首先,固体酸接近并与纤维二糖碰撞,表面酸性位点攻击β-1,4糖苷键的氧原子,形成共轭酸。随后 C—O键断裂,共轭酸分解释放葡萄糖,形成氧碳离子中间体。快速结合水分子后,另一个葡萄糖和一个自由质子被释放出来。水解液中的游离质子和固体酸继续水解纤维素的β-1,4糖苷键。固体酸从分子链末端和任意位置随机攻击糖苷键,导致纤维素水解。固体酸和纤维素之间的初始接触、分子间的亲和力和水的存在对纤维素的有效水解是不可缺少的。
苯酚羟基(pKa=9.9)等弱酸位点的酸性不足以直接水解纤维素时,他们及含氧基团(如酮和内酯结构)的存在通过氢键提高固体酸对纤维素和低聚葡聚糖的亲和力,在纤维素水解中表现协同效应[17],从而对纤维素进行水解。弱酸位点与含氧基团并列相邻时,协同效应更明显,因为官能团可与β-1,4糖苷键的氧原子形成氢键,并增加相邻 COOH 或 SO3H 酸性基团攻击β-1,4糖苷键的能力。
3.4固体酸的其他催化位点
除了Br?nsted酸位点,研究了 Lewis酸位点对纤维素水解的影响。例如,镧(Ⅲ)离子可以在水溶液中保持 Lewis 酸性。Seri 等人[18]报道氯化镧(Ⅲ)在250℃有效催化纤维素水解,总水溶性产物在150 s 时达到最大产率(54.2%),但葡萄糖产率仅为5.8%,主要降解产物为5-羟甲基-2-呋喃甲醛(产率19.2%)。
固体酸的 Lewis酸位点也能够裂解β-1,4糖苷键。因此,将 Lewis酸位点结合到固体酸增加总酸度以有效水解纤维素。Lewis 酸位点水解纤维素的潜在机理及其与Br?nsted酸位点在纤维素水解中的协同作用是未来研究的重点。
4固体酸的孔隙结构
4.1与水解性能的关系
固体酸水解纤维素的性能不仅与功能性酸位点有关,还与比表面积和多孔结构有关。研究发现,含 SO3H 的传统 Amberlyst-15树脂中虽然 SO3H 密度高达4.8 mmol/g,但对纤维素的水解性能却比 SO3H密度为1.9 mmol/g 的碳材料差。其中一个重要原因是 Amber? lyst-15的比表面积仅为50 m2/g,主要为外部大孔。由于许多由天然聚合物碳化和磺化制备的碳固体酸(如糖、纤维素、淀粉和木质纤维素生物质)无孔结构, BET 比表面积低(通常小于5 m2/g),纤维素的催化水解性能效果较差[19-21]。相比之下,比表面积大的固体酸在纤维素水解中具有较高的催化活性[22-24]。Zhang等人[24]报道了酸密度相对较低( SO3H密度0.44 mmol/g),但 BET 比表面积较高(762 m2/g)的磺化活性炭在150℃下、水解24 h 时获得葡萄糖,产率为62.6%,优于酸密度高但比表面积低的纤维素衍生碳。
4.2 介孔和微孔的作用
固体酸的多孔结构对纤维素大分子的催化水解起关键作用[25]。研究表明,固体酸介孔比微孔具有更高的催化活性,这可能与介孔的大比表面积和孔内酸性位點有关,更易与纤维素底物接触,反应物和产物易于传质[26-27]。Zhong 等人[27]发现介孔碳纳米颗粒可以吸附高达30%的可溶性长链β-1,4葡聚糖,而缺乏内部介孔的石墨烯型碳纳米粉末在类似条件下仅吸附不到1%的葡聚糖。后续研究进一步证实了介孔碳材料的内部孔隙对葡聚糖吸附的重要性,且葡聚糖吸附能力随着暴露的碳介孔比表面积和中孔尺寸增大而增加,直径5~8 ? 的微孔不易吸附葡聚糖[28]。
可溶性长链β-1,4葡聚糖可以快速吸附到沸石模板碳( ZTC )催化剂的直径为10~15? 的微孔中,达 ZTC 质量的80%,并在180℃下处理3 h 后,吸附的葡聚糖水解率较高(73%)[29-30]。ZTC 表面引入的 COOH 可以使纤维素水解效率高达87%。尽管β-1,4葡聚糖的回转半径比微孔直径大几倍,但葡聚糖吸附发生在 ZTC 内部微孔内,而不是外表面。在扩散中观察到类似的现象,柔性聚合物链通过构象变化进入多孔膜。与上述观察相反的是,在多孔碳催化剂吸附和解聚葡聚糖方面,微孔可能比中孔具有功能优势,这为设计和制造用于纤维素水解和转化的多孔固体酸打开了新的途径。
5 提高固体酸水解纤维素效率
尽管已经做了大量努力来提高固体酸对纤维素水解的催化活性,但大多数现有固体酸的性能仍不能与液体酸和纤维素酶相比。其原因在于固体酸对纤维素的亲和力差和受限于纤维素的结晶结构[26]。
5.1 固体酸对底物和中间产物的吸附特性
固体酸对底物和中间产物的吸附效果是不同的。Yabushita等人[29]在研究中发现碳和β-1,4葡聚糖间的亲和力强于纤维素和β-1,4葡聚糖之间的亲和力,因此可以在纤维素上剥离出葡聚糖链;Chung 等人[31]系统地研究了纤维二糖、纤维三糖和长链β-1,4葡聚糖在介孔碳纳米颗粒( MCN )上的吸附,并证实 MCN 优先吸附长链葡聚糖,吸附自由能随着葡聚糖链长度的增加而单调降低,且与氢键的强度相比,吸附自由能的降低相对较小。Dornath等人[32]在亲本3DOm 碳和 SO3 H-3DOm 碳上也有同样的发现,葡聚糖低聚物吸附量随链长的增加而单调增加,同时发现葡聚糖低聚物长链在非晶态碳材料上的良好吸附使选择性水解成为可能,可抑制Br?nsted酸催化的成型产物,如葡萄糖生成5-羟甲基糠醛和乙酰丙酸的副反应。
5.2 辅助方法
5.2.1 碾磨预处理
纤维素由于受到氢键和纤维素链间存在的紧密的轴向堆积的影响而产生高度结晶,难以被固体酸水解。Kobayashi 等人[33]受球磨纤维素代替微晶纤维素为固体酸底物可显著提高水解效率[34]的启发,开发了一种混合研磨技术,将纤维素和催化剂放在一起球磨,以增加固体酸催化剂和纤维素的接触,通过硬氧化铝球的冲击将结晶纤维素粉碎成更小的无定形颗粒,并将无定形纤维素和含碳固体酸催化剂彻底混合。这种方法增强了纤维素和碳催化剂的物理接触,纤维素转化率达93%,缺点是能耗高、耗时长。
5.2.2 均匀水解
为增强固体酸对纤维素的可及性,发现可以将纤维素在离子液体等纤维素溶剂中进行溶解后再被固体酸水解[35]。纤维素的溶解破坏了晶体结构,使β-1,4糖苷键易于水解。100℃下,磺化树脂Amberlyst 15可在1-丁基-3-甲基咪唑氯盐中将纤维素水解成纤维素低聚物[36]。然而离子液体会影响固体酸的催化活性,Amberlyst 15在离子液体中失活是由于 SO3 H 基团通过与离子液体阳离子进行离子交换而浸出。离子液体也可通过浸出金属物影响金属负载催化剂的催化活性。此外,在工业应用中,离子液体价格昂贵、难回收。
微波辐射能有效促进固体酸对纤维素的催化水解[37]。微波既可削弱和破坏纤维素链之间的氢键,又可增强纤维素和固体酸间的碰撞,促进纤维素的非均相水解。但由于能耗大,大规模工业应用仍有很多挑战。
5.3 改善纤维素和固体酸之间的相互作用
固体酸水解纤维素时,固体酸和底物之间的充分吸附和接触至关重要,否则固体酸的活性酸性位点就不能接近糖苷键从而完成水解。目前有2种方法,一是改善纤维素与固体酸的物理接触,如混合研磨;另一种方法是提高附着或结合纤维素的亲和力来修饰固体酸[38]。氢键和 CH—π相互作用是固体酸吸附葡聚糖的2个重要机制。
5.3.1 氢键结合
Kitano 等人[12]发现,含高密度 SO3 H 、COOH 和酚羟基的无定形碳基固体酸可以有效地吸附和水解可溶性长链β-1,4葡聚糖,而仅含有 SO3 H 基团的磺化树脂由于其与葡聚糖之间缺乏密切的相互作用而不能水解葡聚糖。研究表明,酚羟基和 COOH 能够吸附β-1,4葡聚糖(酚羟基是主要的吸附位点),而 SO3 H 不能。因此,碳催化剂中纤维素的糖苷键和羟基间形成的强极化的羟基氢键,是纤维素在碳上吸附的原因。这种氢键比纤维素的分子间和分子内氢键更强,纤维素的β-1,4糖苷键可以更好地与水解催化剂的酸性活性位点结合。因此,碳质固体酸的良好性能归因于酚羟基和 COOH作为纤维素结合的吸附位点和强 SO3 H 基团作为纤维素水解的有效酸性位点间的协同作用。
5.3.2 CH—π相互作用
Kobayashi 等人[39]证明纤维素与含氧官能团的亲水相互作用不是纤维素吸附的原因,轴向 CH 基团和碳石墨烯片的π电子之间的疏水相互作用是吸附的主要驱动力。Dornath等人[32]发现葡聚糖低聚物在三维有序介孔碳催化剂上的吸附是热焓和熵增加的,吸附量随葡聚糖链长的增加而增加。较长的葡聚糖低聚物在碳表面上具有更有效的堆积,因此较长葡聚糖的吸附量大于短葡聚糖低聚物和葡萄糖的吸附量。这些发现表明疏水作用而非亲水作用是纤维素在碳催化剂上吸附的可能驱动力之一。此外,范德华力,包括纤维素链的轴向疏水 C—H 基团和碳结构的多芳香环中的π电子之间的 CH—π相互作用,对吸附驱动力有很大贡献。CH—π相互作用类似于纤维素水解酶和纤维素之间的相互作用,其中纤维素酶通过疏水性芳香族氨基酸残基组成的碳水化合物结合位点吸附在纤维素上。
5.3.3 仿纤维素酶双功能固体酸催化剂
由于固体酸和纤维素底物间的无效相互作用,固体酸水解纤维素通常需要很高的底物催化剂负载量。而纤维素酶在水解時非常活跃,因为纤维素酶有一个与纤维素表面结合的底物结合域和一个负责水解β-1,4糖苷键的催化结构域。为了改善固体酸和纤维素之间的相互结合,提出了纤维素仿生固体酸的概念,引入额外的纤维素结合基团,制备双功能固体酸。Shuai 等人[40]制造了磺化氯甲基聚苯乙烯树脂( CP ),作为纤维素水解的双官能固体酸( CP-SO3 H )。固体酸上的氯化物通过与纤维素的羟基形成氢键作为纤维素结合基团( CBGs ),并促进纤维素内部氢键的断裂,作为催化域的磺酸基(—SO3 H )负责水解β-1,4糖苷键。由于 CP-SO3 H 的底物结合能力,在同等酸负载下,催化活性明显高于硫酸和其他固体酸,在相对温和的条件下(120℃, 10 h)水解纤维素效率高达93%。此外,纤维素水解的表观活化能比硫酸低得多。这就是 CP-SO3 H 能够在较低温度下水解纤维素,避免或减少在高温下发生的葡萄糖降解。
在固体酸中引入纤维素结合功能区,增强了纤维素和固体酸之间的相互结合,这是传统单功能固体酸的主要局限性。为了进一步提高纤维素仿生固体酸的性能,应注意选择更有效和稳定的纤维素结合基团,增加纤维素水解/结合位点的密度,操纵多孔结构,以及提高仿酶固体酸的可回收性。
6 固体酸水解与纤维素的结晶度和聚合度的关系
结晶度和聚合度是纤维素的重要特性,对纤维素的固体酸水解有重要的影响。固体酸催化水解纤维素的效率,一方面与固体酸本身的性质有关,如酸性位点密度、多孔结构和官能团的种类;另一方面,通过改变固体酸用量、水解温度、研磨、微波辐射等措施可以改进反应性能。
Rinaldi 等人[41]研究了固体酸催化水解纤维素过程聚合度的变化,发现断裂速率和催化剂量间存在线性相关性,且酸浓提高可加速纤维素的水解和5-羟甲基糠醛的形成。温度也影响纤维素的水解速率,100℃下比80℃下的反应快100倍。Zhang 等人[42]发现结晶度和聚合度对纤维素酶水解有重要影响,木质纤维素的水解速率和结晶度间的反比例关系可表现在化学预处理和球磨段。
综上所述,高的纤维素结晶度与聚合度相应需要强的固体酸酸解条件,固体酸酸解程度的增大相应会降低结晶度和聚合度。
7 固体酸回收
固体酸相较液体酸在回收方面具有一定优势,有的固体酸本身就很容易从体系中分离出来。Jin等人[43]使用仿酶固体酸 A-15-Cl 在水介质中水解球磨微晶纤维素,并用80目筛轻易将 A-15-Cl 分离了出来,且回收利用5次催化性能仍保持在80%以上。Sug? anuma等人[14]报道,通过简单的倾析从水解产物中回收了超过99%的碳催化剂,并且回收的催化剂在纤维素水解的25次重复使用后没有显示出活性降低。
对于不易分离固体酸可采用合成磁性固体酸等方法,如磁性磺化介孔二氧化硅( Fe3 O4-SBA-SO3 H )[44],性能好,易回收,在水解纤维素时, 150℃下获得50%的葡萄糖产率,另外当水解纤维二糖时,在 120℃下水解1 h ,葡萄糖产率高达96.0%,远高于 H2 SO4,在第一次反应后, Fe3 O4-SBA-SO3 H 可以很容易地通过外部永磁体从反应混合物中分离出来重复使用,且没有明显的催化活性损失。
8 结论
纤维素水解固体酸催化剂的设计、制造和应用取得了重大进展。纤维素水解固体酸催化剂的设计主要针对催化活性、水热稳定性、固体酸和纤维素间相互作用以及可回收性等方面展开研究。
制造具有高催化活性、高表面积、中孔和高密度酸位点的固体酸,进一步深化固体酸和纤维素间的相互作用的认识,如底物(纤维素)、中间体(低聚葡聚糖和纤维二糖)和产物(葡萄糖)在固体酸上的相对亲和力和选择性吸附,对于设计和制造底物亲和性的固体酸,以增强纤维素和固体酸之间的相互作用具有重要作用。另外,合成水热稳定且易于回收的固体酸用于纤维素水解,保护固体酸的 SO3 H 免受高温浸出是一项具有挑战性的工作。一种方法是在较低的温度下水解纤维素,但需要较多的固体酸用量和较长的水解时间。具有超高催化活性的固体酸是解决这一问题的潜在方法。另一种方法是制造密度低于水固体酸,固体酸可以通过离心(从水解产物和残余木质纤维素生物质(未水解的纤维素和木质素)中分离。磁性固体酸易于回收,但在酸性和水热环境中的稳定性需要进一步提高。对于固体酸的再生,开发快速、简便和廉价的再生固体酸的方法,如再磺化和离子交换,也成为了研究前景之一。
参考文献
[1] 赵志刚,程可可,张建安,等.木质纤维素可再生生物质资源预处理技术的研究进展[J].现代化工,2006,26(2):39-42+44.
ZHAO Z G,CHENG K K,ZHANG J A,et al. Advances in pretreat? ment technology of lignocellulose renewable biomass [J]. Modem Chemical Industry,2006,26(2):39-42+44.
[2] Mika L T ,Csefalvay E , Nemeth A. Catalytic Conversion ofCarbohydrates to Initial Platform Chemicals:Chemistry and Sustainability[J]. Chemical Reviews,2018,118(2):505-613.
[3] 张欢欢,高飞虎,张玲.固体酸催化纤维素水解制备葡萄糖的研究进展[J].食品工业,2018,39(9):256-260.
ZHANG H H,GAO F H,ZHANG L. Advances on the Hydrolysis of Cellulose into Glucose by Solid Acid Catalysts[J]. The Food Indus? try,2018,39(9):256-260.
[4] Rinaldi R F. Acid Hydrolysis of Cellulose as the Entry Point intoBiorefinery Schemes[J]. ChemSusChem,2010,3(3):296-296.
[5] 张景强,林鹿,孙勇.纤维素结构与解结晶的研究进展[J].林产化学与工业,2008,28(6):109-114.
ZHANG J Q,LIN L,SUN Y. Advance of Studies on Structure and Decrystallization of Cellulose[J]. Chemistry and Industty of Forest Products,2008,28(6):109-114.
[6] 付时雨.纤维素的研究进展[J].中国造纸,2019,38(6):54-64.
FU S Y. Progress in Cellulose Research[J]. China Pulp & Paper,2019,38(6):54-64.
[7] JUTURU V , WU J C. Microbial cellulases: Engineering,production and applications[J]. Renewable and Sustainable Energy Reviews,2014,33:188-203.
[8] Shrotri A ,Kobayashi H ,Fukuoka A. Cellulose Depolymerizationover Heterogeneous Catalysts[J]. Accounts of Chemical Research,2018,51(3):761-768.
[9] 靳書缘,程意,鲁杰,等.仿酶固体酸的制备及其改善纤维素水解的研究进展[J].中国造纸学报,2020,35(3):70-79.
JIN S Y,CHENG Y,LU J,et al. Research Progress in Preparation of Enzyme-mimic Solid Acid and Improvement of Cellulose Hydroly ? sis[J]. Transactions of China Pulp and Paper,2020,35(3):70-79.
[10] ZENG M J,PAN X J. Insights into solid acid catalysts for efficientcellulose hydrolysis to glucose :Progress ,challenges ,and future opportunities [J]. Catalysis Reviews-Science and Engineering,doi:10.1080/01614940.2020.1819936.
[11] 叶科丽,唐艳军,傅丹宁,等.纤维素水解制备葡萄糖的研究进展[J].中国造纸学报,2020,35(2):81-88.
YE K L,TANG Y J,FU D N,et al. Research Progress in Prepara? tion of Glucose by Hydrolysis of Cellulose[J]. Transactions of Chi? na Pulp and Paper,2020,35(2):81-88.
[12] Kitano M,Yamaguchi D,Suganuma S,et al. Adsorption-enhancedHydrolysis of β-1,4-Glucan on Graphene-based Amorphous Carbon Bearing SO3H,COOH,and OH Groups[J]. Langmuir,2009,25(9):5068-5075.
[13] Akiyama G,Matsuda R,Sato H,et al. Cellulose hydrolysis by anew porous coordination polymer decorated with sulfonic acid functional groups[J]. Advanced Materials,2011,23(29):3294-3297.
[14] Suganuma S,Nakajima K,Kitano M,et al. Hydrolysis of celluloseby amorphous carbon bearing SO3H,COOH,and OH groups[J]. Journal of the American Chemical Society,2008,130(38):12787-12793.
[15] Pang J ,Wang A ,Zheng M ,et al. Hydrolysis of cellulose intoglucose over carbons sulfonated at elevated temperatures [J]. Chemical Communications,2010,46(37):6935-6937.
[16] To A T , Chung P W , Katz A. Weak-acid sites catalyze thehydrolysis of crystalline cellulose to glucose in water:importance of post-synthetic functionalization of the carbon surface [J]. AngewandteChemie-International Edition,2015,127(38):11202-11205.
[17] Guo S F,Sievers C. Synergistic Effect between Defect Sites andFunctional Groups on the Hydrolysis of Cellulose over Activated Carbon[J]. ChemSusChem,2014,8(3):534-543.
[18] Seri K ,Sakaki T ,Shibata M ,et al. Lanthanum(III )-catalyzeddegradation of cellulose at 250℃[J]. Bioresource Technology,2002,81(3):257-260.
[19] Fraga A D,Quitete C P B,Ximenes V L,et al. Biomass derivedsolid acids as effective hydrolysis catalysts[J]. Journal of Molecular Catalysis A-Chemical,2016,422:248-257.
[20] Wu Y Y,Fu Z H,Yin D L,et al. Microwave-assisted hydrolysis ofcrystalline cellulose catalyzed by biomass char sulfonic acids [J]. Green Chemistry,2010,12(4):696-700.
[21] Nakajima K,Hara M. Amorphous Carbon with SO3H Groups as aSolid Br?nsted Acid Catalyst [J]. ACS Catalysis ,2012,2(7):1296-1304.
[22] Kobayashi H ,Komanoya T , Hara K , et al. Water-tolerantmesoporous-carbon-supported ruthenium catalysts for the hydrolysis of cellulose to glucose[J]. ChemSusChem,2010,3(4):440-443.
[23] Konwar L J , Maki A P ,Salminen E , et al. Towards carbonefficient biorefining:Multifunctional mesoporous solid acids obtained from biodiesel production wastes for biomass conversion [J]. Applied Catalysis B-Environmental,2015,176:20-35.
[24] Zhang B,Chen B,Douthwaite M,et al. Macroporous-mesoporouscarbon supported Ni catalysts for the conversion of cellulose to polyols[J]. Green Chemistry,2018,20(15):3634-3642.
[25] Liu R,Wang X Q,Zhao X,et al. Sulfonated ordered mesoporouscarbon for catalytic preparation of biodiesel[J]. Carbon,2008,46(13):1664-1669.
[26] Xing R,Liu Y,Wang Y,et al. Active solid acid catalysts preparedby sulfonation of carbonization-controlled mesoporous carbon materials[J]. Microporous and Mesoporous Materials,2007,105(1/2):41-48.
[27] Zhong R Y ,Sels B F. Sulfonated mesoporous carbon and silica-carbon nanocomposites for biomass conversion [J]. Applied Catalysis B-Environmental,2018,236:518-545.
[28] Chung P W ,Charmot A ,Click T ,et al. Importance of InternalPorosity for Glucan Adsorption in Mesoporous Carbon Materials[J]. Langmuir,2015,31(26):7288-7295.
[29] Yabushita M ,Techikawara K , Kobayashi H , et al. Zeolite-templated Carbon Catalysts for Adsorption and Hydrolysis of Cellulose-derived Long-chain Glucans:Effect of Post-synthetic Surface Functionalization [J]. ACS Sustainable Chemistry & Engineering,2016,4(12):6844-6851.
[30] Chung P W ,Yabushita M ,To A T ,et al. Long-chain GlucanAdsorption and Depolymerization in Zeolite-templated Carbon Catalysts[J]. ACS Catalysis,2015,5(11):6422-6425.
[31] Chung P W,Charmot A,Gazit O M,et al. Glucan adsorption onmesoporous carbon nanoparticles:Effect of chain length and internal surface[J]. Langmuir,2012,28(43):15222-15232.
[32] Dornath P S ,Ruzycky S , Pang , et al. Adsorption-enhancedhydrolysis of glucan oligomers into glucose over sulfonated three- dimensionally ordered mesoporous carbon catalysts [J]. Green Chemistry,2016,18(24):6637-6647.
[33] Kobayashi H ,Yabushita M ,Komanoya T ,et al. High-yieldingOne-pot Synthesis of Glucose from Cellulose Using Simple ActivatedCarbons and Trace Hydrochloric Acid[J]. ACS Catalysis,2013,3(4):581-587.
[34] Li X T,Jiang Y J,Wang L L,et al. Effective low-temperaturehydrolysis of cellulose catalyzed by concentrated H3PW12O40 under microwave irradiation [J]. RSC Advances ,2012,2(17):6921-6925.
[35] Gan L H,Zhu J,Lv L. Cellulose hydrolysis catalyzed by highlyacidic lignin-derived carbonaceous catalyst synthesized via hydrothermal carbonization[J]. Cellulose,2017,24(12):5327-5339.
[36] Rinaldi R,Palkovits R,Schuth F. Depolymerization of CelluloseUsing Solid Catalysts in Ionic Liquids [J]. AngewandteChemie- International Edition,2008,47(42):8047-8050.
[37] Jiang Y J,Li X T,Wang X C,et al,Effective saccharification oflignocellulosic biomass over hydrolysis residue derived solid acid under microwave irradiation[J]. Green Chemistry,2012,14(8):2162-2167.
[38] Gazit O M,Katz A. Understanding the role of defect sites in glucanhydrolysis on surfaces [J]. Journal of the American Chemical Society,2013,135(11):4398-4402.
[39] Kobayashi H ,Kaiki H ,Shrotri A ,et al. Hydrolysis of woodybiomass by a biomass-derived reusable heterogeneous catalyst[J]. Chemical Science,2016,7(1):692-696.
[40] Shuai L ,Pan X J. Hydrolysis of cellulose by cellulase-mimeticsolid catalyst[J]. Energy & Environmental Science,2012,5(5):6889-6894.
[41] Rinaldi R , Meine N , Stein J V , et al. Which controls thedepolymerization of cellulose in ionic liquids:the solid acid catalyst or cellulose?[J]. ChemSusChem,2010,3(2):266-276.
[42] Zhang Y H ,Lynd L R. Toward an aggregated understanding ofenzymatic hydrolysis of cellulose:noncomplexed cellulase systems [J]. BiotechnolBioeng,2004,88(7):797-824.
[43] Jin S Y,Gong J W,Yang C,et al. A recyclable and regenerablesolid acid for efficient hydrolysis of cellulose to glucose [J]. Biomass & Bioenergy,doi:10.1016/j. biombioe.2020.105611.
[44] Lai D M ,Deng L ,Guo Q X ,et al. Hydrolysis of biomass bymagnetic solid acid[J]. Energy & Environmental Science,2011,4(9):3552-3557.
(責任编辑:杨苗秀)
