布鲁氏菌荧光定量PCR检测方法的建立
2021-09-18巫秀红刘庆斌张永红郭俊林崔德凤
巫秀红,刘庆斌,张永红,郭俊林,张 玮*,崔德凤*
(1.北京农学院动物科学技术学院/兽医学(中医药)北京市重点实验室,北京 102206; 2.北京市动物疫病预防控制中心,北京 102609)
布鲁氏菌病,简称布病或马耳他热,是中国的二类动物疫病之一,是由布鲁氏菌(Brucella)引起的人兽共患病,世界动物卫生组织将其列为B类动物疫病。布鲁氏菌主要分为6个种属:羊种布鲁氏菌、牛流产布鲁氏菌、猪种布鲁氏菌、犬种布鲁氏菌、绵羊附睾布鲁氏菌和沙林鼠布鲁氏菌[1-2],其中以羊种布鲁氏菌病最为常见。临床主要特征是波状热、不育不孕、慢性感染、公畜睾丸炎和母畜流产等[3]。近年来,中国多地报道布鲁氏菌病呈反弹趋势,根据《国家布鲁氏菌中长期规划(2016—2020年)》要求,本研究致力于建立一种灵敏、特异、准确的布鲁氏菌荧光定量PCR检测方法,为布鲁氏菌病临床诊断和流行病学调查提供技术支持。
1 材料与方法
该试验已通过北京市动物疫病预防控制中心福利与伦理审查,编号为ACDC2019052001。所有操作均在北京市动物疫病预防控制中心二级生物安全实验室进行。
1.1 材 料
1.1.1 试验菌株 牛种布鲁氏菌2308株核酸、羊种布鲁氏菌16M株核酸、猪种布鲁氏菌S2株核酸、犬种布鲁氏菌6166株核酸、致病性大肠杆菌、志贺氏菌、金葡萄球菌、猪链球菌由北京市动物疫病预防控制中心实验室留存;莫氏耶尔森菌16197、猪霍乱沙门氏菌186354购买于北京北纳创联生物技术研究院;肠炎沙门氏菌3949、鼠伤寒沙门氏菌14028、单增李斯特菌1599、奇异变形菌1969购买于中国兽医药品监察所。
1.1.2 仪器设备 赛默飞世尔科技有限公司的荧光定量PCR仪Quant Studio7 Flex;天根生化科技(北京)有限公司的TGuide S32全自动核酸提取仪;Quawell Q9000超微量核酸测定仪。
1.2 方 法
1.2.1 引物设计与验证 通过GenBank搜索布鲁氏菌6个种属外膜蛋白(outer membrane protein, Omp) 25基因片段并通过BLAST进行比对,最终确立登录号为NO. U33003的Omp 25基因序列。利用Primer Express v 3.0软件设计1对扩增片段大小为90 bp的引物和探针。引物序列Omp 25-F为5′-GAAGTCAAGCAGGGCTTTGAAG-3′,Omp 25-R为5′-ACGGCATAACCGGGTTCAG-3′;探针序列为5′-(FAM)CTCGCTGCGTGCCCGCGT(BHQ1)-3′。引物和探针由生工生物工程(上海)股份有限公司合成。PCR反应体系50 μL:2×Taq Master Mix为25 μL、模板5 μL、上游引物2 μL、下游引物2 μL,双蒸水补足。反应条件:95 ℃ 4 min,94 ℃ 40 s,56 ℃ 30 s,72 ℃ 45 s,共35个循环;72 ℃ 10 min。
1.2.2 质粒构建 通过比对外膜蛋白(outer membrane protein, Omp)基因保守序列,设计合成一段3 272 bp的Omp 25质粒,送至生工生物工程(上海)股份有限公司合成。用超微量核酸测定仪测得质粒为4 ng/μL,并通过公式计算得出Omp 25质粒拷贝数约为1.12×109copies/μL。
1.2.3 样本DNA提取与制备 对肠炎沙门氏菌3949、鼠伤寒沙门氏菌14028、单增李斯特菌1599、志贺氏菌、金葡萄球菌、猪链球菌、奇异变形菌1969、莫氏耶尔森菌16197、猪霍乱沙门氏菌186354、致病性大肠杆菌进行菌株培养,获得菌落并制成菌悬液,按照天根生化科技(北京)有限公司的DNA磁珠快速提取试剂盒推荐步骤进行提取,提取产物-20 ℃冰箱保存。
1.2.4 引物浓度的优化 上游引物和下游引物浓度为80、120、160、200、240、280、320、360和400 nmol/L,9个浓度梯度。探针浓度保持在250 nmol/L,每个浓度梯度5个平行。反应条件:50 ℃ 2 min,95 ℃ 15 min,94 ℃ 15 s,60 ℃ 45 s,40个循环。对所得的每个浓度循环阈值(cycle threshold,Ct)的平均值进行比较,以产生Ct值的平均值最小和Ct值标准偏差(standard deviations,SD)综合指数最小为依据对引物浓度进行选择。
1.2.5 探针浓度的优化 探针浓度为100、150、200、250、300、350、400、450和500 nmol/L,9个浓度梯度。引物浓度保持在280 nmol/L,每个浓度梯度5个平行。反应参数和最佳浓度选择同“1.2.4”引物浓度优化选择条件。
1.2.6 退火温度的优化 选择优化后的引物浓度和探针浓度,选取55、56、57、58、59、60、61、62 ℃退火温度进行实时荧光PCR扩增,每个温度3个平行。反应参数和最佳退火温度同“1.2.4”引物浓度优化选择条件。
1.2.7 荧光定量PCR反应条件 布鲁氏菌荧光定量PCR反应体系20 μL:2×real-time PCR Mix 10 μL、上游引物0.8 μL、下游引物0.8 μL、探针0.5 μL、模板2 μL、ddH2O为5.9 μL。反应条件:50 ℃ 2 min,95 ℃ 15 min,94 ℃ 15 s,61 ℃ 45 s,40个循环。退火温度61 ℃时检测荧光信号,选用FAM通道。
1.2.8 特异性验证试验 以猪种布鲁氏菌S2株核酸为试验组,无菌去离子水为对照组,对肠炎沙门氏菌3949、鼠伤寒沙门氏菌14028、单增李斯特菌1599、志贺氏菌、金葡萄球菌、猪链球菌、奇异变形菌1969、莫氏耶尔森菌16197、猪霍乱沙门氏菌186354、致病性大肠杆菌进行特异性验证试验。
1.2.9 灵敏度试验评价 对Omp 25质粒进行10倍倍比稀释,稀释度为10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9、10-10,制得10个稀释度的标准品,每个稀释度5个平行,进行灵敏度验证试验。
1.2.10 标准曲线的制备 以质粒为模板,5个质粒稀释度分别为10-3、10-4、10-5、10-6、10-7,进行荧光定量PCR标准曲线制备,每个稀释度5个平行,取各个稀释度的质粒模板2 μL。动力学曲线由每个质粒稀释度对数值与其对应的Ct值的平均值绘制得到,通过计算得出相应的标准曲线。
1.2.11 重复性试验评价 以10-2、10-3、10-4的质粒溶液进行检测,每个稀释度3个平行,根据3个稀释度的Ct值进行变异系数计算,确定重复性。
1.3 临床样品的检测
取已知临床背景的34份牛全血样品,样品来自北京市某牛场,经灭活处理后保存在北京市动物疫病预防控制中心二级生物安全实验室,所有操作均在北京市动物疫病预防控制中心二级生物安全实验室进行。用所建立的荧光定量PCR方法进行检测,同时与常规PCR检测结果进行比较,对检出率进行差异分析。
2 结 果
2.1 引物验证
以Omp 25质粒和猪种布鲁氏菌S2株核酸为模板,用引物Omp 25-F与Omp 25-R进行PCR扩增,结果与预期大小一致,目的片段90 bp,无杂带(图1)。说明设计的引物可作为检测布鲁氏菌的特异性引物。
2.2 引物浓度优化
引物浓度优化结果见图2。通过比较Ct值的平均值和Ct值标准偏差最小的综合指数,发现280 nmol/L试验组的扩增曲线要优于其他试验组的扩增曲线,所以选择最佳引物浓度为280 nmol/L。
2.3 探针浓度优化
探针浓度优化结果见图3。250 nmol/L的Ct值和Ct值标准偏差综合指数最小,扩增曲线要优于其他试验组的扩增曲线,因此选择最佳探针浓度为250 nmol/L。
2.4 退火温度优化
退火温度优化结果见表1,依据Ct值和Ct标准偏差值,退火温度61 ℃时综合指数最高,所以最佳退火温度为61 ℃。

表1 退火温度优化数据Tab.1 Annealing temperature optimization data
2.5 标准曲线的制备
标准曲线见图4。相关系数R2=0.994,扩增效率99.73%,表明标准曲线有良好的线性关系,循环阈值与质粒拷贝数的常用对数关系为Y=-3.481x+41.319。
2.6 特异性试验
除猪种布鲁氏菌S2株核酸有较好的荧光扩增曲线外,肠炎沙门氏菌3949、鼠伤寒沙门氏菌14028、单增李斯特菌1599、志贺氏菌、金葡萄球菌、猪链球菌、奇异变形菌1969、莫氏耶尔森菌16197、猪霍乱沙门氏菌186354、致病性大肠杆菌均无荧光扩增曲线(图5),说明该方法具有良好的特异性。
2.7 灵敏度试验
对Omp 25质粒进行10倍倍比稀释,稀释度为10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9、10-10,结果见图6。质粒稀释度为10-7时仍有荧光信号,即检测方法的最低检测限约为100 copies/μL。
2.8 重复性试验评价
对Omp 25质粒进行10倍倍比稀释,质粒在10-2、10-3、10-4下进行3次试验,结果见表2。3次试验的变异系数分别为0.72%、0.53%、0.14%,变异系数均小于1%,即建立的荧光定量PCR检测方法具有良好的重复性。
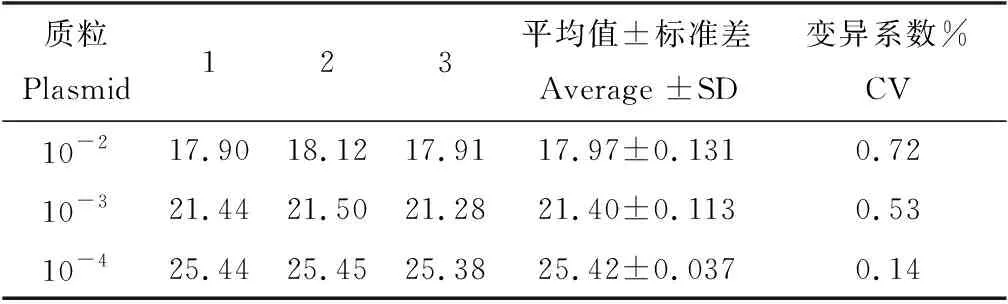
表2 重复性试验结果Tab.2 Analysis of repeatability test results
2.9 临床样品检测
用所建立的荧光定量PCR方法和常规PCR方法对已知临床背景的34份牛全血样品进行检测,结果显示,荧光定量PCR检测出阳性17份,阴性17份,阳性率50%;常规PCR检测出阳性15份,阳性率44%,两者之间差异不显著。
3 讨 论
布鲁氏菌病是一种呈世界性流行的传染病,该病给畜牧业带来巨大的经济损失,超过170个国家有布鲁氏菌病报道,主要流行地区在欧洲东部及南部地区、中南美洲地区、亚洲及非洲部分地区[4]。在中国布鲁氏菌病呈地方性流行,治疗难度较高,目前临床上对布鲁氏菌病仍没有特效的治疗措施,对于这种传染性疾病主要采取以预防为主的防治措施[5-6]。通过2016年全国家畜布鲁氏菌病监测数据分析,中国家畜布鲁氏菌病群阳性率高地区主要在北方,流行面广;群内阳性率高地区主要在南方,呈爆发流行;已免疫的地区(如内蒙古),群内阳性率较低,呈免疫抑制感染传播。建立一种快速、准确性好、灵敏度高的布鲁氏菌检测方法对于病原的流行病学、防控及风险分析具有重要意义[7]。
目前中国常用检测布鲁氏菌的方法主要有三类:一是细菌分离鉴定,被认为是检测布鲁氏菌病最可靠的方法,但需要进行布鲁氏菌的分离培养,细菌分离培养耗时长,技术较复杂,检出率低,对实验室检测条件要求较高,存在相应的生物安全隐患。二是血清学检测,主要有虎红平板凝集试验、试管凝集试验、补体结合试验和酶联免疫吸附试验等。凝集试验存在敏感性差、特异性不强、操作繁多等缺点,易受人为判断主观意识的影响,需要通过其他方法辅助才能确诊[8];补体结合试验对检测人员能力要求高并且需要在体内产生抗体后才能检测出来,不能排除潜伏期的带菌动物;酶联免疫吸附试验主要用于布鲁氏菌病的监测,不能有效区分免疫抗体与野毒感染抗体,存在假阳性、在确诊布鲁氏菌病方面存在严重不足[9-10]。三是分子生物学检测,如荧光定量PCR检测方法以其特异、灵敏、省时省力、安全等优点,在布鲁氏菌鉴定方面逐渐被广泛应用[11]。
本研究根据布鲁氏菌保守基因Omp 25片段,设计引物、合成探针,通过反应条件优化,建立一套布鲁氏菌荧光定量PCR检测方法,与肠炎沙门氏菌3949、鼠伤寒沙门氏菌14028、致病性大肠杆菌、莫氏耶尔森菌16197、单增李斯特菌1599、志贺氏菌、奇异变形菌1969、金葡萄球菌、猪链球菌、猪霍乱沙门氏菌186354等高同源性菌株均无交叉,特异性良好。
本检测方法采用Taqman水解探针技术,相对于SYBR Green Ⅰ荧光染料特异度更好,与张爱萍等[12]建立的荧光定量PCR检测方法相比较,SYBR Green Ⅰ荧光染料特异性95.4%低于本试验的特异性100%。
本检测方法建立的标准曲线3个参数均符合标准:扩增效率99.73%,决定系数R2=0.994以及ΔCt值变异系数均小于1%,最低检测限约为100 copies/μL微量样品级别并且重复3次试验变异系数均小于1%,说明本试验建立的方法具有较好的检测灵敏度和重复性。相对于常规PCR,如HUBER等[13],徐军等[14]建立的PCR检测方法,其灵敏度均低于本试验的灵敏度,同时常规PCR检测耗时、染料毒性、易有气溶胶污染等问题。本检测方法不受其他理化因素的影响,相对普通PCR操作简单,耗时少,减少操作中病原体的接触,有效降低生物安全风险,且可同时进行大批量检测。对于布鲁氏菌病早期诊断、疫病筛查、疫情监测、探索和研究其流行规律和流行特点以及根据检测数据制定合理有效的防治对策具有重要意义。同时,为实验室检测、诊断提供相对安全、快速、便捷的技术支持,为临床检测提供新兴检测手段,具有较好的潜在应用价值。
