低剂量莠去津对雄性小鼠生殖毒性作用
2021-09-17秦嫘姜明马岩石朱玉何宝国
秦嫘 姜明 马岩石 朱玉 何宝国
【摘要】建立低剂量的莠去津(ATR)对雄性小鼠生殖毒性的模型及其生殖毒性作用。在长期暴露后, ATR剂量组睾丸组织实质区排列紊乱,出现空泡化;睾酮(T)含量显著性降低(P<0.001);且ATR暴露能够引起睾丸中类激素合成途径相关基因的表达发生紊乱。表明低浓度的ATR可引起雄性小鼠性激素紊乱,睾丸结构改变,类激素合成相关基因表达量降低,可以对小鼠的生殖功能产生影响。
【关键词】莠去津;环境内分泌干扰物;生殖毒性;激素
[中图分类号]R114 [文献标识码]A [文章编号]2096-5249(2021)07-0184-02
莠去津(Atrazine, ATR)是目前世界范围内应用量最大的三氯苯类除草剂,主要通过农业径流和灌溉用水等途径进入生态环境系统,由于其在生物体内的蓄积及通过食物链的传递从而对各物种机体都有损伤作用。近些年,由于ATR使用量大以及在环境中存留期长,对生物体表现出较为显著的雌激素样作用,其毒理学研究广受关注[1-3]。尽管现在已经有很多研究证实了ATR能够引起生命机体的生殖毒性,但多为对毒性剂量的检测研究,对日常生活中可能存在的ATR暴露浓度下的毒性研究还比较少,而且通过长期饮用水暴露ATR对机体产生损害的研究还没有得到关注,所以本研究以小鼠为受试动物,探究饮用水中ATR暴露对小鼠机体造成的损害及对其生殖器官产生的毒性影响。
1 材料和方法
1.1小鼠染毒及样本采集 21日龄清洁级昆明雄性小鼠平均体重(20±2)g,由辽宁长生生物技术有限公司提供,生产许可证号SCXK(辽)2016-0001。适应性喂养7 d后随机分为7组,10只/组,分别设为对照组、1.5 mg/kg、3.0 mg/kg、15 mg/kg、30/kg、150 mg/kg和300 mg/kg的ATR剂量组。第一次灌胃前每组小鼠尾静脉采血50μL,静置后离心,取血清冻存,之后连续灌胃70 d。样本采集前12 h禁食,眼球采后处死小鼠,取睾丸组织于-80℃冻存备用。
1.1血清中T和LH的检测两次分离到的血清通过ELISA检测T和LH的含量。
1.2类固醇合成通路上 关键因子mRNA表达量检测根据Gene bank中的序列信息,设计特异性扩增引物,详见表1。采用qRT-PCR方法对类固醇合成途径上关键因子进行基因表达水平的测定。
1.3统计分析 数据以x±s表示,采用prism5软件进行统计分析,采用双侧t检验,以P<0.05为具有统计学显著性差异,以P<0.01为具有统计学极显著差异。
2 结果
2.1血清中T和LH变化 如图1,暴露前各组血清中T和LH无明显变化,70 d后与对照组相比,剂量组血清T含量显著性降低(P<0.001),LH含量升高,且有显著性差异(P<0.05)。
2.2类激素合成途径 相关基因水平变化如图2,与对照组相比,类激素合成途径相关基因的表达均有下降趋势,其中stAR、CYP17A1和17β-HSD的相对表达量均显著性降低(P<0.05)。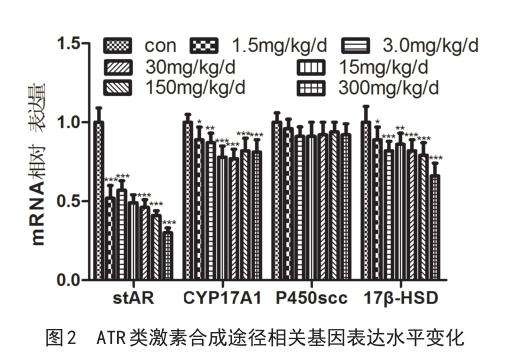
3 讨论
三嗪类化学物质已经被许多研究证实是内分泌干扰物的典型,有研究表明高剂量的ATR会引起雄性生殖毒性[4-8]。有研究报道ATR暴露环境下可能会对人类的健康产生危害,其主要的接触途径是通過饮用水[9]。睾酮(T)是一种在睾丸间质细胞中生成的类固醇类激素,对雄性第二性征的发育起到关键的作用[10],通过LH水平变化的影响,T的含量受下丘脑-垂体-睾丸轴调节。本研究针对ATR暴露雄性小鼠,在暴露第0 d检测小鼠血清中T和LH水平,结果表明各组血清中T和LH的变化没有显著性差异,暴露70 d后检测,ATR剂量组小鼠血清中T的水平显著低于对照组,而低剂量的ATR对LH的变化不明显,在150 mg/kg和300 mg/kg剂量组中LH的含量显著性增高(如图1),表明雄性体内T的合成受ATR暴露的影响,且血清中低浓度的T会通过下丘脑-垂体-睾丸轴进行负反馈调节使血清中LH的含量升高。
睾丸中睾酮合成通路上关键因子的基因表达量,即stAR,CYP17A1,CYP450scc和17β-HSD,为T合成途径的关键酶基因[11]。本研究中暴露ATR后类固醇合成途径关键因子基因表达量的分析结果显示与对照组相比,剂量组的stAR、CYP17A1和17β-HSD的表达均明显降低,表明ATR可以干扰睾丸间质细胞中T合成途径,引起雄性生殖毒性,表明低浓度的ATR可以对小鼠的生殖功能产生影响。
本研究结果与国内流行病学调查的结果基本一致,即 ATR的暴露可以引起雄性生殖毒性,而目前大部分研究表明高剂量的ATR能够引起毒性效应。本研究结果显示低浓度的ATR的长期暴露同样可以对小鼠的生殖功能产生影响,表明对于ATR的安全使用风险需要更进一步的研究,生活中ATR的暴露风险需要得到更多的关注。
参考文献
[1] 吕耀中, 杨光, 赵剑. 莠去津原药大鼠致畸毒性试验[J]. 农药, 2018, 57(2): 117-119.
[2] Govers Luke C, Harper Alesia P, Finger Bethany J, et al. . Atrazine induces penis abnormalities including hypospadias in mice. [J]. Journal of developmental origins of health and disease, 2020, 11(3): 2051-2054.
[3] 林佳. 线粒体损伤调控在番茄红素拮抗阿特拉津致小鼠睾丸毒性中的作用[D]. 东北农业大学, 2019.
[4] Fani Masoumeh, Mohammadipour Abbas, EbrahimzadehBideskan Alireza. The effect of crocin on testicular tissue and sperm parameters of mice offspring from mothers exposed to atrazine during pregnancy and lactation periods: An experimental study. [J]. International journal of reproductive biomedicine (Yazd, Iran), 2018, 16(8): 1924-1926.
[5] 田淑新, 杨淑玉, 赵文阁, 等. 两种农药对青鳉抗氧化和bcl6b基因表达的影响[J]. 生态学杂志: 1-14[2020-07-23].
[6] 李龙雪, 张先艳, 付丹, 等. 阿特拉津对大鼠肝肾功能及DNA氧化损伤作用的实验研究[J]. 江西中医药, 2018, 49(12): 72-74.
[7] 吕耀中, 杨光, 赵剑. 莠去津原药大鼠致畸毒性试验[J]. 农药, 2018, 57(2): 117-119.
[8] M. E. Chávez-Pichardo, Reyes-Bravo D Y, Mendoza-Trejo M S, et al. Brain alterations in GABA, glutamate and glutamine markers after chronic atrazine exposure in the male albino rat[J]. Archive für Toxikologie, 2020(2).
[9] Saalfeld Graciela Quintana, Varela Junior Ant?nio Sergio, Castro Tiane, et al. Atrazine exposure in gestation and breastfeeding affects Calomys laucha sperm cells. [J]. Environmental science and pollution research international, 2019, 26(34).
[10] 秦嫘. 核受體介导的阿特拉津致鹌鹑睾丸毒性效应研究[D]. 东北农业大学, 2016.
[11] 王丹丹, 李柏, 吴艳萍, 等. 游泳对阿特拉津暴露大鼠的雄性子代中脑损伤的改善[J]. 毒理学杂志, 2019, 33(2): 102-107.
基金项目:齐齐哈尔市科学技术计划项目(编号:SFGG-201705)
作者简介:秦嫘(1989.01-),女,山东省莱芜市人,硕士研究生,研究实习员,研究方向:生殖毒理学。
*通信作者:何宝国,齐齐哈尔医学院实验动物中心。
