苏姜猪MC4R基因多态性及其与生产性状的关联分析
2021-09-17周春宝刘林雨胡廷延倪黎纲徐盼
周春宝 刘林雨 胡廷延 倪黎纲 徐盼

摘要: 本研究旨在探討MC4R基因多态性对苏姜猪生产性状的影响,以期能够筛选出可用于提高苏姜猪生产性状的分子标记。利用DNA混合池和Sanger测序法对MC4R基因外显子进行单核苷酸多态性(SNP)检测,分析SNP的遗传多态性及其与生产性状的关联性。结果显示,苏姜猪MC4R基因外显子中共检测到6个SNP位点,其中1个错义突变[rs81219178 G>A(Asp298Asn)],5个3′UTR突变(rs325999553 G>A、rs344775772 T>A、rs334536177 A>C、rs335628164 C>T和rs81221063 A>T),均包含3种基因型,且符合Hardy-Weinberg平衡,2个SNP位点为低度多态,4个SNP位点为中度多态。关联分析结果显示,rs81219178 G>A(Asp298Asn)位点对胸围和胸宽有显著影响,5个3′UTR突变位点对体质量、体高和胸围有显著影响。rs325999553 G>A和rs344775772 T>A呈现高度连锁,rs334536177 A>C、rs335628164 C>T和rs81221063 A>T呈现高度连锁。结果提示,MC4R基因对苏姜猪的部分生产性状有显著影响,可作为苏姜猪早期选育的分子标记。
关键词: 苏姜猪;MC4R;单核苷酸多态性;生产性状
中图分类号: S858.28 文献标识码: A 文章编号: 1000-4440(2021)04-0929-07
Analysis on MC4R gene polymorphism and its association with production traits in Sujiang pigs
ZHOU Chun-bao1, LIU Lin-yu1, HU Ting-yan1,2, NI Li-gang1, XU Pan1
(1.School of Animal Science and Technology, Jiangsu Agri-animal Husbandry Vocational College, Taizhou 225300, China;2.College of Animal Science and Technology, Yangzhou University, Yangzhou 225009, China)
Abstract: This study was aimed to explore the effect of MC4R gene polymorphism on the production traits of Sujiang pigs, as so to screen molecular markers that can be used to improve the production traits of Sujiang pigs. Single nucleotide polymorphism (SNP) in the exons of MC4R gene was detected by DNA pooling and Sanger sequencing to analyze the genetic polymorphism of SNP and its association with production traits. The results showed that six SNP loci were detected in the exons of MC4R gene of Sujiang pigs, including one missense mutation [rs81219178 G>A(Asp298Asn)], five 3′UTR mutations (rs325999553 G>A, rs344775772 T>A, rs334536177 A>C, rs335628164 C>T and rs81221063 A>T), which all contained three genotypes and conformed to Hardy-Weinberg equilibrium. Two SNP loci were low polymorphic and four SNP loci were moderate polymorphic. Association analysis results indicated that rs81219178 G>A(Asp298Asn) locus had significant effects on chest circumference and chest width, and five 3′UTR mutational loci had significant effects on body weight, body height and chest circumference. There showed high linkages between rs325999553 G>A and rs344775772 T>A, among rs334536177 A>C, rs335628164 C>T and rs81221063 A>T. The results suggest that MC4R gene has a significant effect on some production traits of Sujiang pigs and can be used as a molecular marker in early breeding of Sujiang pigs.
Key words: Sujiang pig;MC4R;single nucleotide polymorphism (SNP);production traits
黑素皮质素受体-4(Melanocortortion-4 receptor, MC4R)是黑素皮质素受体家族的5种亚型之一,是下丘脑分泌的一种肽类物质,为跨膜神经受体[1]。MC4R蛋白是Leptin蛋白调节采食量和刺激下丘脑神经原活性调控通路的下游物质,具有介导Leptin蛋白的功能,在人和动物体内主要参与调控食欲、体质量和能量代谢等生物学过程。
Vaisse等[2]、Geller等[3]和Young等[4]发现MC4R基因的移码突变和错义突变与人的显性遗传学肥胖显著相关。靶向缺失MC4R基因的小鼠表现出食欲亢进、高胰岛素血症和高血糖症等肥胖相关的症状[5]。Qiu等[6]发现鸡MC4R基因5′UTR和编码区的突变与体质量、生长性状和胴体性状显著相关。Kim等[7-8]报道,MC4R基因中的错义突变Asp298Asn与猪的背膘厚、生长速度和采食量显著相关。因此,MC4R基因是影响人和动物生长发育的重要候选基因之一。
苏姜猪是以姜曲海猪、枫泾猪、杜洛克为亲本,采用继代选育方法,经过6个世代继代选育而成的新品种猪[9]。由于猪的遗传改良已经从表型选择发展到分子标记辅助选择(Marker-assisted selection, MAS)和全基因组选择等方法,因此在苏姜猪持续选育的过程中,建立苏姜猪分子育种的分子标记重要且必要。基于MC4R基因的功能,本研究对MC4R基因外显子的单核苷酸多态性(Single nucleotide polymorphisms, SNP)进行检测,并对MC4R基因SNP与7个生产性状进行关联分析,以期为在苏姜猪群体中应用分子标记进行辅助选择奠定基础。
1 材料与方法
1.1 试验动物
试验动物为来自江苏苏姜种猪有限公司的365头苏姜猪,记录日龄(180±5) d时的体质量(BW)、体长(BL)、体高(BH)、胸围(CC)、胸宽(CW)、臀宽(HW)和背膘厚(BF)7个生产性状的数据[9] 。采集猪耳组织,保存于-20 ℃冰箱内待用。
1.2 主要试剂及仪器
基因组DNA提取试剂盒(DP304)、2×Taq PCR Mastermix(KT201)和D2000 DNA Marker(MD114)购自天根生化科技(北京)有限公司,溴化乙锭(E808961)购自上海麦克林生化科技有限公司,Biowest西班牙琼脂糖(111860)购自南京迈克沃德生物科技有限公司,50×TAE 缓冲液(T1060)购自北京索莱宝科技有限公司。
Biodropsis超微量核酸蛋白分析仪(BD-1000,北京五洲东方科技发展有限公司产品),Veriti 96孔热循环仪(4375786,美国赛默飞世尔科技公司产品),电泳仪(DYY-7C,北京六一生物科技有限公司产品),凝胶成像系统(GelDocIt 310,美国UVP公司产品)。
1.3 基因组DNA提取及DNA混合池构建
采用血液/组织/细胞基因组DNA提取试剂盒提取猪耳组织DNA,DNA经Biodropsis超微量核酸蛋白分析仪和琼脂糖凝胶电泳检验合格后稀释至50 ng/μl,-20 ℃冰箱保存备用。每头猪取1 μl DNA构建DNA混合池,共构建10个DNA混合池。
1.4 引物設计及合成
根据EnsemblASIA(http://asia.ensembl.org/index.html)中猪MC4R基因序列(登录号:ENSSSCG00000051798),利用Primer Premier 5.0软件设计3对引物扩增MC4R基因外显子,引物序列见表1。引物由生工生物工程(上海)股份有限公司合成。
1.5 PCR扩增
25.0 μl PCR反应体系包括2×Taq PCR Mastermix 12.5 μl,上游引物(F)1.0 μl,下游引物(R)1.0 μl,模板DNA 1.5 μl,ddH2O水9.0 μl。PCR反应程序:95 ℃预变性5 min;95 ℃变性30 s,退火30 s(退火温度见表1),72 ℃延伸1 min,35个循环,72 ℃延伸10 min,4 ℃保存。
1.6 MC4R基因多态性检测
将PCR产物送至生工生物工程(上海)股份有限公司进行Sanger测序,测序结果用DNASTAR.Lasergene.v7.1软件和Chromas.v2.22软件进行分析。
1.7 统计分析
根据测序结果,使用Microsoft Excel计算苏姜猪MC4R基因的基因型频率及等位基因频率。使用χ2检验进行哈迪-温伯格平衡(Hardy-Weinberg equilibrium, HWE)检验。使用PopGene 32分析苏姜猪群体MC4R基因纯合度、杂合度、有效等位基因数和多态信息含量等遗传多样性参数[10]。使用SPSS 19.0的单因素方差分析(One-Way ANOVA)统计苏姜猪群体中MC4R基因不同基因型与生产性状的关联性[11-12],结果用平均值±标准差表示,使用邓肯氏新复极差法(Duncans)进行各组平均值之间的差异显著性分析,当P<0.05时表示差异显著。利用Haploview软件(https://www.broadinstitute.org/haploview/haploview)对MC4R基因SNP位点进行连锁不平衡性分析。
2 结果与分析
2.1 MC4R基因的PCR扩增结果
PCR扩增产物经1.5%琼脂糖凝胶电泳检测,电泳结果见图1,PCR扩增产物条带单一,产物大小与目的片段大小相符。
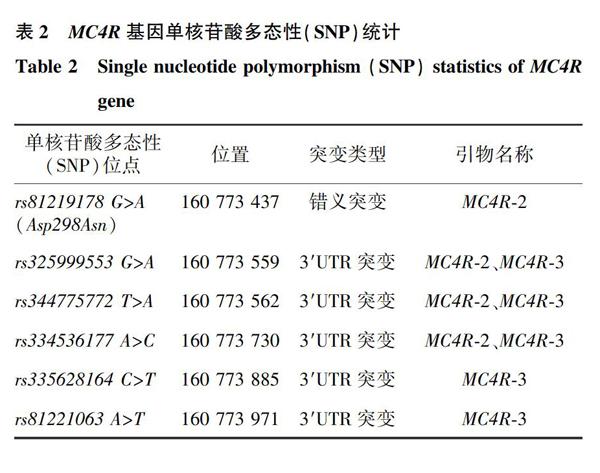
2.2 MC4R基因的多态性SNP位点
MC4R基因外显子区域检测到6个SNP位点,分别为rs81219178 G>A(Asp298Asn)、rs325999553 G>A、rs344775772 T>A、rs334536177 A>C、rs335628164 C>T和rs81221063 A>T,其中rs81219178 G>A(Asp298Asn) 是错义突变,其余5个SNP是3′UTR突变(表2)。
2.3 MC4R基因SNP的遗传多态性分析
由表3可知,SNP位点rs81219178 G>A(Asp298Asn)有3种基因型,分别为GG、GA和AA,其中GG为优势基因型,有2种等位基因,分别为G和A,其中G为优势等位基因;rs325999553 G>A有3种基因型,分别为GG、GA和AA,其中GG为优势基因型,有2种等位基因,分别为G和A,其中G为优势等位基因;rs344775772 T>A位点有3种基因型,分别为TT、TA和AA,其中TT为优势基因型,有2种等位基因,分别为T和A ,其中T为优势等位基因;rs334536177 A>C位点有3种基因型,分别为AA、AC和CC,其中AA为优势基因型,有2种等位基因,分别为A和C, 其中A为优势等位基因;rs335628164 C>T位点有3种基因型,分别为CC、CT和TT,其中CC为优势基因型,有2种等位基因,分别为C和T,其中C为优势等位基因;rs81221063 A>T位点有3种基因型,分别为AA、AT和TT,其中AA为优势基因型,有2种等位基因,分别为A和T,其中A为优势等位基因。经χ2检验,6个SNP在苏姜猪群体中符合Hardy-Weinberg平衡(P>0.05)。
由表4可知,rs81219178 G>A在6个SNP中纯合度最低,杂合度最高,有效等位基因数最多,多态性信息含量(PIC)最高;rs325999553 G>A和rs344775772 T>A属于低度多态(PIC<0.250),其余4个位点属于中度多态(0.250≤PIC≤0.500)。
2.4 MC4R基因6个SNP连锁不平衡分析
图2的连锁不平衡分析结果显示,rs325999553 G>A和rs344775772 T>A呈现高度连锁,rs334536177 A>C、rs335628164 C>T和rs81221063 A>T呈现高度连锁。
2.5 苏姜猪MC4R基因6个SNP与生产性状的关联分析
由表5可知,SNP位点rs81219178 G>A (Asp298Asn)AA和GA基因型个体胸围、胸宽显著高于GG基因型(P<0.05),其余性状不同基因型之间差异均不显著(P>0.05);rs325999553 G>A位点GG基因型个体体质量、体高、胸围显著高于AA基因型(P<0.05),GG基因型体高显著高于GA基因型(P<0.05),其余性状不同基因型之间差异均不显著(P>0.05);rs344775772 T>A位点TT基因型个体体质量、体高、胸围显著高于AA基因型(P<0.05),TT基因型个体体高显著高于TA基因型(P<0.05),其余性状不同基因型之间差异均不显著(P>0.05);rs334536177 A>C位点AA基因型和个体体质量、體高、胸围显著高于CC基因型(P<0.05),AC基因型个体体高、胸围显著高于CC基因型(P<0.05),其余性状不同基因型之间差异均不显著(P>0.05);rs335628164 C>T位点CC基因型个体体质量、体高、胸围显著高于TT基因型(P<0.05),CT基因型个体体高、胸围显著高于TT基因型(P<0.05),其余性状不同基因型之间差异均不显著(P>0.05);rs81221063 A>T位点AA基因型个体体质量、体高、胸围显著高于TT基因型(P<0.05),AT基因型个体体高、胸围显著高于TT基因型(P<0.05),其余性状不同基因型之间差异均不显著(P>0.05)。
3 讨论
猪MC4R基因位于1号染色体,含1个外显子和2个内含子,编码332个氨基酸,被认为是影响猪生长发育的候选基因,具有较高的生产应用价值[8,13-15]。相同基因或分子标记在不同品种(品系)的猪群体中对表型的影响不一致。本研究以苏姜猪为研究对象,验证猪MC4R基因对其生产性状的影响。作为继限制性片段长度多态性(Restriction fragment length polymorphism, RFLP)和微卫星标记后的新一代分子标记,单核苷酸多态性已广泛应用于猪的育种领域,但在筛选开发SNP时样本量大会导致工作量大、成本高。作为随基因诊断技术的发展而建立起来的一种快速高效的检测技术,DNA混合池适用于基因型分型、突变检测、连锁分析、基因定位等[16-17]。研究结果表明,大部分功能变异都潜藏在外显子中[18-20]。因此,本研究采用DNA混合池和Sanger测序法对苏姜猪MC4R基因外显子区域SNP进行检测,共发现6个SNP,包括1个错义突变和5个3′UTR突变。MC4R基因的6个SNP均符合Hardy-Weinberg平衡(P>0.05),表明苏姜猪群体未发生MC4R基因的遗传漂变,群体未经过MC4R基因辅助选择。6个SNP的纯合度高于杂合度,表明苏姜猪群体MC4R基因的6个SNP遗传均匀性较高。6个SNP中有4个SNP(rs81219178 G>A、rs334536177 A>C、rs335628164 C>T、rs81221063 A>T)属于中度多态(0.250≤PIC≤0.500),表明该4个位点具有较大的选育潜力。
错义突变位点rs81219178 G>A(Asp298Asn) 已在多项研究中被报道与猪的生长发育相关。Kim等[8]研究发现西方品种猪中MC4R基因Asp298Asn位点AA基因型个体与GG基因型个体相比有更厚的背膘和更快的生长速度。杨晓慧等[21]在333头商品猪群体中发现AA基因型个体的背膘厚显著高于AG和GG基因型个体。闫德超[22]的研究结果表明,在美系大白猪和法系大白猪群体中,AA基因型个体的背膘厚显著高于AG和GG型个体。熊琪等[23]在大白猪×清平猪F2黑色群体中发现,AA基因型个体的背膘厚显著高于AG和GG基因型个体。赵聪哲等[12]在分析MC4R基因多态性与生长性状的关联性时发现,AA型大白猪6月龄的体质量显著高于GG型。本研究中,rs81219178 G>A(Asp298Asn) 突变位点对苏姜猪生产性状的影响与上述研究结果相符,苏姜猪群体中AA基因型个体与AG和GG基因型个体相比背膘更厚、体质量更大,但差异未达到显著水平,其原因可能是试验群体中AA基因型个体的数量较少,下一步试验应扩大样本量进行验证分析。另有多项报道显示,G等位基因和背膘厚显著相关[8, 24],也有多项研究结果表明,MC4R基因rs81219178 G>A (Asp298Asn) 突变位点对猪的背膘厚和生长速度无显著影响[25-26]。因此,MC4R基因rs81219178 G>A (Asp298Asn)突变位点对不同品種猪的生长发育影响不同,该突变不是影响猪生产性状的因果突变,但可能与因果突变连锁。
本研究中的6个SNP中有5个3′UTR突变。3′UTR参与转录后基因的表达调控,影响mRNA稳定性、亚细胞定位和蛋白翻译效率等生物学过程[27-29]。大量研究结果表明,3′UTR与畜禽生产性能密切相关。Cui等[30]在鸡HMGR基因3′UTR发现的SNP对血清和肌肉中胆固醇含量有显著影响。Hou等[31]发现山羊MTHFR基因3′UTR的2个miR-SNP突变与产奶性状相关。Li等[32]在牛HMGB1基因3′UTR鉴定到与奶牛乳房炎相关的分子标记。Zang等[33]在猪DGAT2基因3′UTR发现的多态位点与猪背膘厚和瘦肉率显著相关。Zhang等[34]的研究结果表明,miRNA-29c通过靶向YY1基因参与猪肌肉发育。本研究中5个3′UTR突变对体质量、体高和胸围有显著影响。3′UTR是miRNA的结合区域,miRNA是内源性的具有调控功能的非编码RNA,介导mRNA的降解和阻遏翻译[35],下一步试验应进行5个3′UTR突变的靶向miRNA研究。
SNP参考文献:
[1] YEO G S, FAROOQI I S, CHALLIS B G, et al. The role of melanocortin signalling in the control of body weight: evidence from human and murine genetic models [J]. QJM: Monthly Journal of the Association of Physicians, 2000, 93(1): 7-14.
[2] VAISSE C, CLEMENT K, DURAND E, et al. Melanocortin-4 receptor mutations are a frequent and heterogeneous cause of morbid obesity [J]. The Journal of Clinical Investigation, 2000, 106(2): 253-262.
[3] GELLER F, REICHWALD K, DEMPFLE A, et al. Melanocortin-4 receptor gene variant I103 is negatively associated with obesity [J]. The American Journal of Human Genetics, 2004, 74(3): 572-581.
[4] YOUNG E H, WAREHAM N J, FAROOQI S, et al. The V103I polymorphism of the MC4R gene and obesity: population based studies and meta-analysis of 29 563 individuals [J]. International Journal of Obesity, 2007, 31(9): 1437-1441.
[5] HUSZAR D, LYNCH C A, FAIRCHILD-HUNTRESS V, et al. Targeted disruption of the melanocortin-4 receptor results in obesity in mice [J]. Cell, 1997, 88(1): 131-141.
[6] QIU X, LI N, DENG X, et al. The single nucleotide polymorphisms of chicken melanocortin-4 receptor (MC4R) gene and their association analysis with carcass traits [J]. Science in China(Series C:Life Sciences), 2006, 49(6): 560-566.
[7] KIM K S, LARSEN N J, ROTHSCHILD M F. Rapid communication: linkage and physical mapping of the porcine melanocortin-4 receptor (MC4R) gene [J]. Journal of Animal Science, 2000, 78(3): 791-792.
[8] KIM K S, LARSEN N, SHORT T, et al. A missense variant of the porcine melanocortin-4 receptor (MC4R) gene is associated with fatness, growth, and feed intake traits [J]. Mammalian Genome, 2000, 11(2): 131-135.
[9] XU P, NI L, TAO Y, et al. Genome-wide association study for growth and fatness traits in Chinese Sujiang pigs [J]. Animal Genetics, 2020, 51(2): 314-318.
[10]陈露露,王 会,柴志欣,等. 牦牛MDHⅠ基因多态性及其与生长性状的关联分析 [J]. 中国畜牧兽医, 2019, 46(9): 2658-2664.
[11]易恒洁,李 辉,赵忠海,等. 高坡猪肌肉生长抑制素基因多态性及其与肉质性状的相关性分析 [J]. 中国畜牧兽医, 2017, 44(4): 1102-1107.
[12]赵聪哲,罗晓彤,李兆华,等. 大白猪MC4R、CDC16基因多态性及其与生长性状的关联分析 [J]. 中国畜牧兽医, 2019, 46(3): 792-799.
[13]HOUSTON R D, CAMERON N D, RANCE K A. A melanocortin-4 receptor (MC4R) polymorphism is associated with performance traits in divergently selected Large White pig populations [J]. Animal Genetics, 2004, 35(5): 386-390.
[14]SWITONSKI M, MANKOWSKA M, SALAMON S. Family of melanocortin receptor (MCR) genes in mammals-mutations, polymorphisms and phenotypic effects [J]. Journal of Applied Genetics, 2013, 54(4): 461-472.
[15]JOKUBKA R, MAAK S, KERZIENE S, et al. Association of a melanocortin 4 receptor (MC4R) polymorphism with performance traits in Lithuanian White pigs [J]. Journal of Animal Breeding and Genetics, 2006, 123(1): 17-22.
[16]DARVASI A, SOLLER M. Selective DNA pooling for determination of linkage between a molecular marker and a quantitative trait locus [J]. Genetics, 1994, 138(4): 1365-1373.
[17]童大躍. 混合DNA样品池扩增法及其应用 [J]. 生物技术通讯, 1999(3): 213-216.
[18]BOTSTEIN D, RISCH N. Discovering genotypes underlying human phenotypes: past successes for mendelian disease, future approaches for complex disease [J]. Nature Genetics, 2003, 33(S3): 228-237.
[19]WANG J L, YANG X, XIA K, et al. TGM6 identified as a novel causative gene of spinocerebellar ataxias using exome sequencing [J]. Brain, 2010, 133(12): 3510-3518.
[20]LIU Y, GAO M, LYU Y M, et al. Confirmation by exome sequencing of the pathogenic role of NCSTN mutations in acne inversa (hidradenitis suppurativa) [J]. Journal of Investigative Dermatology, 2011, 131(7): 1570-1572.
[21]杨晓慧,刘 源,唐 辉,等. 猪MC4R基因Asp298Asn位点的多态性及其与商品猪背膘厚的关系 [J]. 农业生物技术学报, 2008, 16(3): 407-411.
[22]闫德超. 大白猪MC4R、IGF2和VRTN基因的多态性及其与生产性状的关联分析 [D]. 武汉:华中农业大学, 2017.
[23]熊 琪,陈文娟,彭 健,等. MC4R和NR6A1基因与大白猪×清平猪F2黑色群体的经济性状关联分析 [J]. 湖北农业科学, 2019, 58(5): 90-93.
[24]李星润,兰国湘,王孝义,等. 猪MC4R基因Asp298Asn位点多态性及其与生长性状的关联 [J]. 畜牧与兽医, 2016, 48(2): 23-27.
[25]PARK H B, CARLBORG , MARKLUND S, et al. Melanocortin-4 receptor (MC4R) genotypes have no major effect on fatness in a Large White×Wild Boar intercross [J]. Animal Genetics, 2015, 33(2): 155-157.
[26]STACHOWIAK M, SZYDLOWSKI M, OBARZANEK-FOJT M, et al. An effect of a missense mutation in the porcine melanocortin-4 receptor (MC4R) gene on production traits in Polish pig breeds is doubtful [J]. Animal Genetics, 2010, 37(1): 55-57.
[27]VOGEL C, ABREU RDE S, KO D, et al. Sequence signatures and mRNA concentration can explain two-thirds of protein abundance variation in a human cell line [J]. Molecular Systems Biology, 2010, 6: 400.
[28]QUATTRONE A, DASSI E. Introduction to bioinformatics resources for post-transcriptional regulation of gene expression [J]. Methods in Molecular Biology, 2016, 1358: 3-28.
[29]MIGNONE F, GISSI C, LIUNI S, et al. Untranslated regions of mRNAs [J]. Genome Biology, 2002, 3(3).doi:10.1186/gb-2002-3-3-review50004.
[30]CUI H X, YANG S Y, WANG H Y, et al. The effect of a mutation in the 3-UTR region of the HMGCR gene on cholesterol in Beijing-you chickens [J]. Animal Biotechnology, 2010, 21(4): 241-251.
[31]HOU J X, AN X P, SONG Y X, et al. Two mutations in the caprine MTHFR 3′UTR regulated by MicroRNAs are associated with milk production traits [J]. PLoS One, 2015, 10(7): e0133015.
[32]LI L M, HUANG J M, ZHANG X J, et al. One SNP in the 3′-UTR of HMGB1 gene affects the binding of target bta-miR-223 and is involved in mastitis in dairy cattle [J]. Immunogenetics, 2012, 64(11): 817-824.
[33]ZANG L, WANG Y D, SUN B X, et al. Identification of a 13 bp indel polymorphism in the 3′-UTR of DGAT2 gene associated with backfat thickness and lean percentage in pigs [J]. Gene, 2016, 576(2): 729-733.
[34]ZHANG W Y, WEI W Y, ZHAO Y Y, et al. The microRNA, miR-29c, participates in muscle development through targeting the YY1 gene and is associated with postmortem muscle pH in pigs [J]. Frontiers of Agricultural Science and Engineering, 2015, 2(4): 311-317.
[35]DJURANOVIC S, NAHVI A, GREEN R. miRNA-mediated gene silencing by translational repression followed by mRNA deadenylation and decay [J]. Science, 2012, 336(6078): 237-240.
(責任编辑:陈海霞)
收稿日期:2021-01-08
基金项目:国家自然科学基金项目(31702089);江苏省第五期“333高层次人才培养工程”项目;江苏高校“青蓝工程”项目;江苏省大学生创新创业训练计划项目(202012806026Y)
作者简介:周春宝(1973-),男,江苏高邮人,博士,教授,主要从事动物遗传育种与繁殖研究。(E-mail)zhou_tz@163.com。刘林雨为共同第一作者。
通讯作者:徐 盼,(E-mail)panxu_nj@hotmail.com
