马铃薯种质资源晚疫病抗性评价及分子标记辅助筛选
2021-09-17娄树宝李凤云田国奎王海艳田振东王立春刘喜才王辉
娄树宝 李凤云 田国奎 王海艳 田振东 王立春 刘喜才 王辉
马铃薯种质资源晚疫病抗性评价及分子标记辅助筛选
娄树宝1李凤云1田国奎1王海艳1田振东2王立春1刘喜才1王辉1
(1黑龙江省农业科学院克山分院/农业农村部马铃薯生物学与遗传育种重点实验室,161005,黑龙江齐齐哈尔;2华中农业大学/农业农村部马铃薯生物学与生物技术重点实验室,430070,湖北武汉)
由致病疫霉()引起的晚疫病是马铃薯生产上最具危害性的病害,种植抗病品种是防治该病害最有效的方法。分子标记辅助选择可以大大缩短育种年限,提高育种效率。对395008.45×克新27号的60份杂交后代进行了晚疫病抗性评价,结果有39份表现抗病,21份表现感病。利用晚疫病抗性基因的分子标记对60份杂交后代进行了检测,其中有43份含有基因;对36份种质资源进行检测,其中有28份含有基因。本研究鉴定的抗性资源可为马铃薯抗病育种提供优质的亲本材料。
马铃薯;晚疫病;分子标记
马铃薯晚疫病是由致病疫霉()引起的具有毁灭性的病害之一。目前晚疫病防控以化学药剂为主,但由于成本较高,且长期使用会造成环境污染,也会使病原菌产生抗药性,加快其变异进程,因此,种植抗病品种仍是防控马铃薯晚疫病最经济有效和环境友好的途径。早期品种抗性改良主要通过向栽培种中导入野生种的主效抗性基因。然而,目前主栽品种主要由国外有限的数个品种和品系选育而成,导致遗传背景相对狭窄,抗病基因的数目和类型有限,抗性频繁丧失,限制了应用推广[1]。马铃薯中已经克隆了大约30个抗晚疫病基因及其同源基因,并开发了相应的分子标记,有效地提高了晚疫病抗性育种效率[2-3]。研究表明,将多个基因聚合在同一个马铃薯材料中可以提高晚疫病田间抗性,也有研究认为,利用具有数量抗性的材料选育品种能够减小对病原菌的选择压力,因此更倾向于使用具有数量抗性的材料进行晚疫病抗病育种[4]。
然而,近些年来的研究[5]表明一些主效基因的抗性也表现为数量抗性表型,即所谓的主效基因也可以解释数量抗性性状。主效基因被克服通常是因为其对病原菌的选择压较大,而数量抗性基因只具有局部、微弱的效应,对病原菌的选择压较小[6]。例如,水稻白叶枯抗病基因就被认为是一个可以对多个白叶枯菌[pv.()]小种起到抗病作用的“被克服了的”基因[7]。在马铃薯中,晚疫病抗性鉴别寄主MaR8、MaR9 和MaR10在田间都表现出广谱抗性和数量抗性的特点[8-9]。对具有晚疫病数量抗性的B3群体、Sarpo Mira、Stirling以及其他品种的多年抗性鉴定结果表明它们能够提供持久的晚疫病抗性。研究[10]证实,具有数量抗性表型的基因,田间和接种鉴定均表现出一定程度的病原侵染,发病较慢,因此病原菌受到的选择压没有其他主效基因剧烈,使病原菌的协同进化过程变慢,抗性能够较长时期地保存下来,基因广泛地存在于不同类型的马铃薯材料中,且具有较好的田间抗性。
本试验采用田间自然发病和室内人工接种鉴定2种方法对马铃薯60份杂交后代和36份种质资源进行晚疫病抗性鉴定,结合病情指数和病斑面积对马铃薯材料的晚疫病抗性进行评价;鉴于含有基因的抗性材料在田间表现广谱抗性和持久抗性,应用基因分子标记对育种后代和亲本材料进行筛选,快速检测马铃薯材料中是否含有基因,实现分子标记辅助选择,加快马铃薯晚疫病抗性育种进程,为今后马铃薯聚合抗病育种提供依据。
1 材料与方法
1.1 试验材料
395008.45、克新27号及其60份杂交后代,以及36份马铃薯种质资源由黑龙江省农业科学院克山分院提供。
1.2 晚疫病田间调查
试验材料种植于黑龙江省农业科学院克山分院试验地,进行田间晚疫病发生情况调查,在所有马铃薯植株叶片完全展开后,每周观察植株发病情况,统计各马铃薯品种(系)的病级,采用病情指数法计算马铃薯品种(系)晚疫病病情指数[11],病情指数为3次调查的平均值。
病情指数=∑(各级病叶数×相对病级数值)/(调查总叶数×9)×100。
病级标准如下:0级,无病斑;1级,病斑面积占整个叶面积5%以下;3级,病斑面积占整个叶面积6%~10%;5级,病斑面积占整个叶面积11%~20%;7级,病斑面积占整个叶面积21%~50%;9级,病斑面积占整个叶面积50%以上。
田间抗病性级别标准为病情指数低于30为高抗(HR),31~50为中抗(MR),51~70为中感(MS),70以上为高感(HS)。
1.3 晚疫病菌人工接种鉴定
采用田间分离的晚疫病菌株KS09-7(生理小种1、2、3、4、5、6、7、8、10、11)和KS11-26(生理小种3、4、6、7、8、11)混合接种。将晚疫病菌经18℃黑暗培养10~15d,用无菌水冲洗,过滤除去菌丝,将收集到的孢子囊置于4℃的冰箱内2~3h,以刺激游动孢子的释放,将浓度调到1×105个/mL待用。植株生长至现蕾阶段,采摘无病斑、大小适中、表面平整的叶片,背面朝上放在铺有无菌湿润滤纸的培养皿中,用配制好的游动孢子悬浮液接种,每个叶片背面接种20μL孢子悬浮液,每份材料接种4片叶,重复3次,置于18℃~20℃保湿培养(每天16h光照,8h黑暗)。接种5d后开始观察叶片背面有无病斑、孢子囊以及霉层,统计病斑面积,游标卡尺记载病斑的长(L)和宽(W)(两者垂直),连续统计3d。根据病斑长和宽计算病斑面积(ellipse area)A=1/4×π×L×W。
采用刘龙超等[12]的方法进行抗性分级,从最明显感病的孢子化病斑到最明显抗病的原位坏死的病情指数分别记为1~5级(图1)。接种叶片全部布满白色的病菌孢子记为病情指数1(高感,HS);叶片大部分枯萎坏死但未出现白色菌丝孢子记为病情指数2(感病,S);叶片自接种点出现较大扩展病斑且病斑周围轮廓清晰记为病情指数3(中抗,MR);叶片自接种点出现较小扩展病斑且病斑干燥记为病情指数4(抗病,R);叶片在接种点上出现原位坏死记为病情指数5(高抗,HR)。

图1 离体马铃薯叶片晚疫病抗性鉴定标准
1.4 马铃薯DNA提取以及晚疫病抗性基因检测
采集马铃薯幼嫩叶片,立即放入装有冰袋的密封采集箱中备用。采用CTAB法提取基因组DNA,利用核酸蛋白分析仪检测DNA浓度,用1.2%琼脂糖凝胶电泳检测其纯度。基因特异性标记信息由华中农业大学田振东教授提供。
2 结果与分析
2.1 马铃薯杂交后代晚疫病抗性鉴定
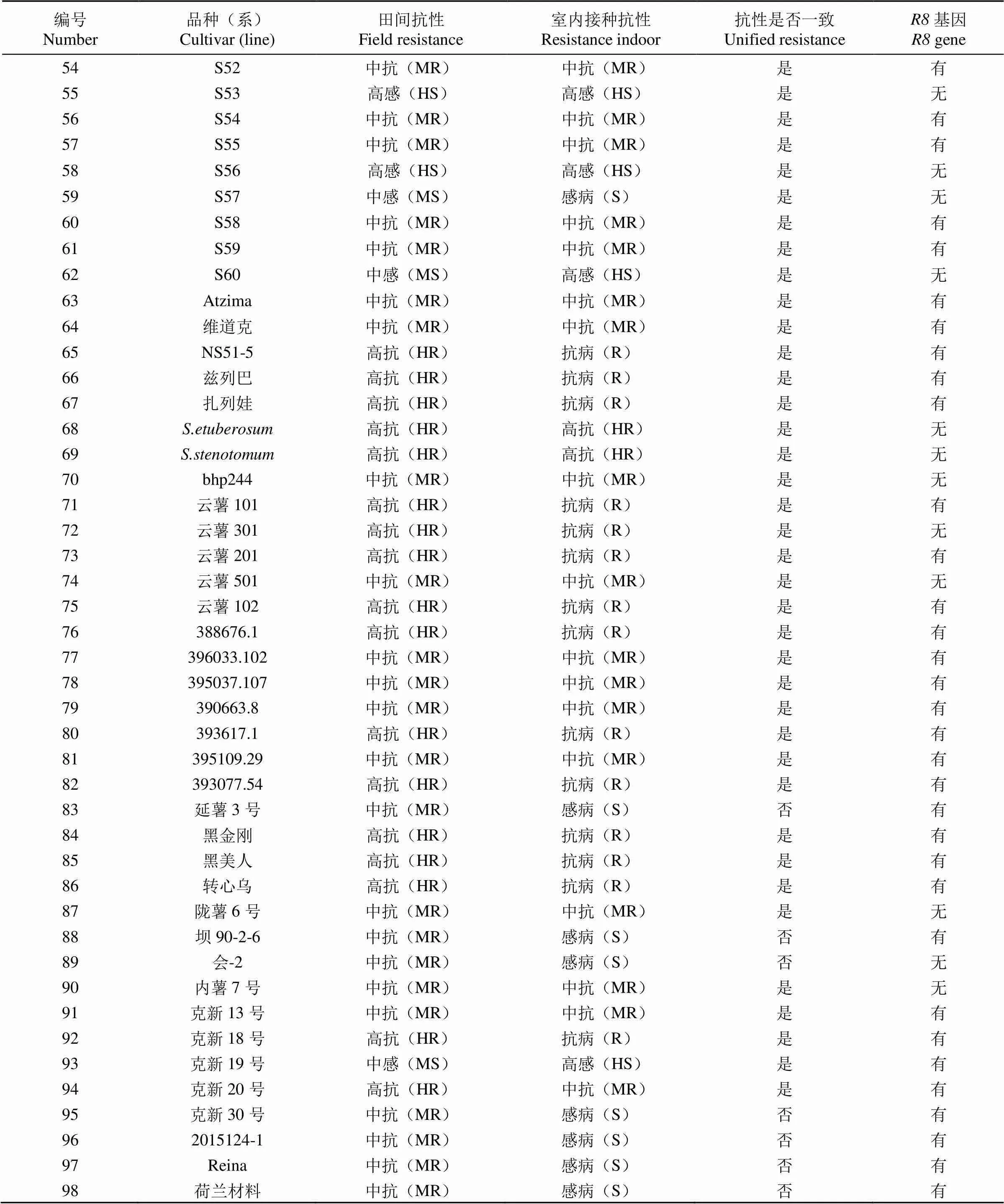
以395008.45为母本、克新27号为父本及其60份杂交后代(编号1~62)为供试材料,于2018-2019年连续2年对其进行田间抗性和室内接种抗性鉴定,结果(表1)显示后代材料中39份田间表现抗病,21份材料表现感病;室内接种鉴定结果与田间调查结果基本一致,室内接种抗性要低于田间。通过多年调查,克新27号在田间晚疫病抗性表现为高抗,并且抗性能够稳定遗传给子代,以克新27号为亲本的杂交组合,后代中表现抗病的比例较大,可以作为晚疫病抗性育种的重要亲本材料加以利用。克新27号室内接种鉴定为抗病,子代中有高抗的材料,表现超亲优势。
2.2 36份马铃薯种质资源晚疫病抗性鉴定
2016-2018年连续3年对230份育种亲本进行晚疫病抗性跟踪调查,从中选取36份(编号63~98)田间表现抗病的材料进行室内接种鉴定,结果(表1)显示,其中7份材料表现感病,与田间抗性不一致。根据多年观察,克新19号刚开始推广时晚疫病抗性较好,经过多年种植后抗性基本丧失,原因是晚疫病菌生理小种不断变化,新的小种克服抗性基因,所以应不断发掘新的抗性基因,通过多种手段聚合到新品种中,增强其晚疫病持久抗性。

表1 马铃薯种质资源和杂交后代晚疫病抗性鉴定
表续表1 Table 1 (continued)
2.3 马铃薯种质资源及杂交后代抗性基因R8检测
应用晚疫病抗性基因的特异性引物检测了60份395008.45×克新27号的杂交后代,部分结果如图2,含有基因的后代可以扩增出682bp的特异性片段,显示43份含有基因,其中39份田间表现为抗病,4份田间表现感病,其余17份不含有基因,都表现为感病。说明父本克新27号含有的抗性基因能够遗传给子代,并且子代大多数个体含有基因。
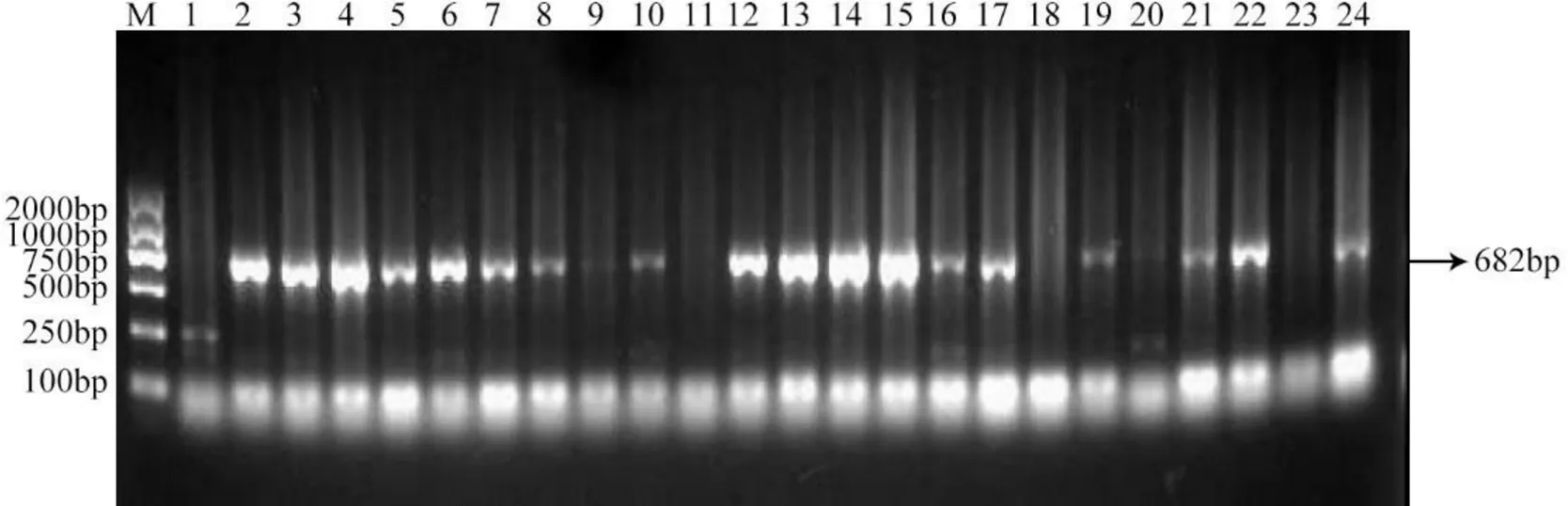
M:DL2000 DNA标记,下同
应用晚疫病抗性基因的特异性引物检测了36份多年田间表现抗病的材料(部分结果见图3),检测到其中28份含有基因,8份不含,其具有的抗性可能是由其他抗性基因提供的。这些资源是重要的抗病育种亲本,可以利用其对一些抗性较差的品种进行改良,对育种具有重要意义。
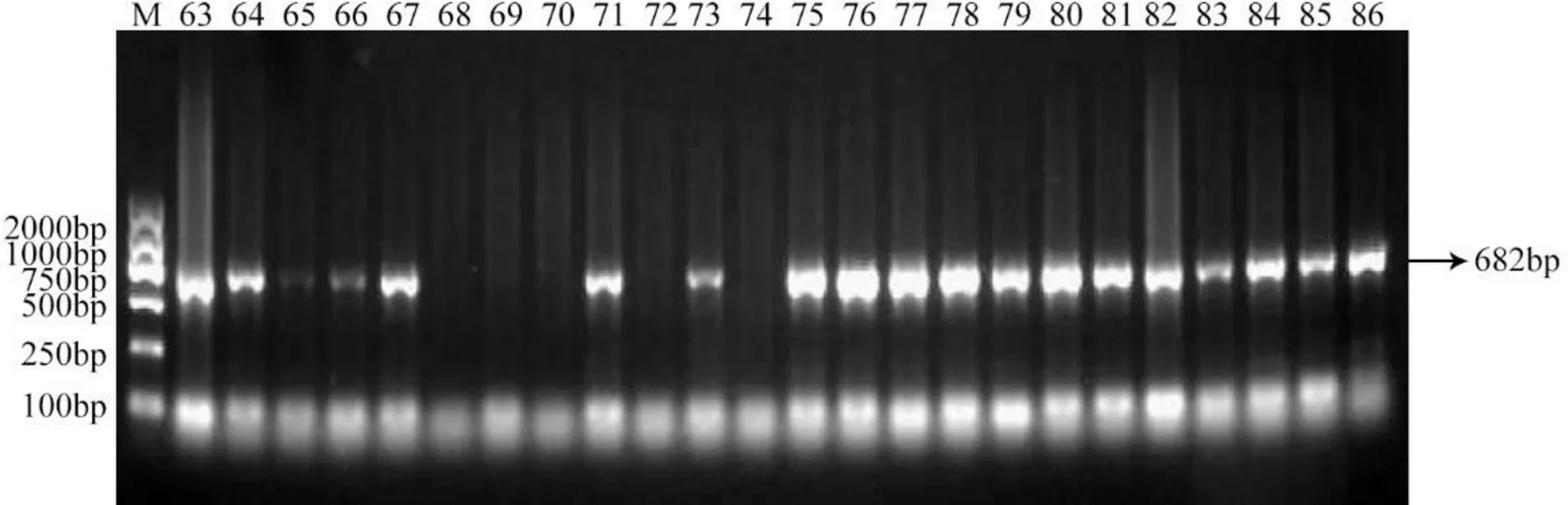
图3 马铃薯抗病种质资源中抗性基因R8检测
3 讨论
抗病基因的发掘和多个抗病基因聚合是提高品种持久抗病性的重要手段,获得优异抗病种质资源是培育抗病品种的基础。本试验中36份抗性资源有28份含有基因,在田间均具有较好的抗性,其余8份是否含有其他抗性基因需要进一步检测,部分材料虽然含有基因,但田间却表现感病,排除人为因素和标记准确度的影响,原因有待进一步研究。含有基因的抗性材料是否含有其他抗性基因还需要利用抗病基因分子标记去检测和评价,这是改良作物抗病性的一种经济有效的方法,在不同作物中被广泛应用[13-14]。本研究中含有基因的材料在田间和室内接种鉴定时均表现出一定程度的病原侵染,病斑扩展较慢,也证实基因具有数量抗性表型,与蒋锐[10]研究结果一致。
部分材料田间与室内接种鉴定存在差异,原因可能有,材料在田间具有广谱抗性;材料生长环境不同,造成抗性水平上的差异;离体叶片接种鉴定发病普遍严重,可能是离体鉴定发病条件更适合;人为因素有时也会影响鉴定结果。离体叶片接种鉴定在室内,温湿度条件可控,能创造最适合晚疫病发病的条件,鉴定结果比较准确。但结果在不同生理小种之间也会存在差异,本试验使用当地的强毒力生理小种和优势小种,通过多次重复接种,再与田间自然发病相结合,使鉴定结果更准确可靠。
晚疫病抗性基因的克隆和分子标记的开发加快了分子标记辅助选择进程。将多个抗性基因聚合在同一份马铃薯材料中可提高晚疫病田间抗性[15],有研究[16]表明含有的材料表现出高抗或中抗水平,说明RB标记在晚疫病抗性辅助选择中具有高效性。Rietman等[5]分析了典型持久抗病品种Sarpo Mira的抗病基因组成,发现该品种抗性持久的原因是有多个抗病基因(至少5个)聚合到了一起。随着越来越多抗性基因被克隆,我们要加大资源的评价范围,筛选含有更多抗性基因的资源,应用常规育种或分子手段将其转入到品种中,达到基因聚合的目的,培育具有持久抗性的马铃薯品种,真正达到常规育种与分子标记辅助选择相结合。
4 结论
对36份马铃薯种质资源和395008.45×克新27号的60份杂交后代进行晚疫病田间抗性调查和室内离体叶片接种鉴定,部分材料鉴定结果有差异;对96份材料进行基因检测,结果显示,大部分表现抗病的材料都含有基因,部分感病材料中也含有基因。
[1] 金黎平,屈冬玉,谢开云,等. 我国马铃薯种质资源和育种技术研究进展. 种子,2003(5):98-100.
[2] Vossen J H,van Arkel G,Bergervoet M,et al. Thelate blight resistance gene is anhomologue that has been deployed worldwide in late blight resistant varieties. Theoretical and Applied Genetics,2016,129(9):1785-1796.
[3] Witek K,Jupe F,Witek A I,et al. Accelerated cloning of a potato late blight–resistance gene using Ren Seq and SMRT sequencing. Nature Biotechnology,2016,34(6):656-660.
[4] Hein I,Birch P R,Danan S,el al. Progress in mapping and cloning qualitative and quantitative resistance againstin potato and its wild relatives. Potato Research,2009,52(3):215-227.
[5] Rietman H,Bijsterbosch G,Cano L M,et al. Qualitative and quantitative late blight resistance in the potato cultivar Sarpo Mira is determined by the perception of five distinct RXLR effectors. Molecular Plant-Microbe Interactions,2012,25(7):910-919.
[6] Poland J A,Balint-Kurti P J,Wisser R J,et al. Shades of gray: the world of quantitative disease resistance. Trends in Plant Science,2009,14(1):21-29.
[7] Li Z K,Luo L J,Mei H W,et al. A “defeated” rice resistance gene acts as a QTL against a virulent strain ofpv.Molecular and General Genetics,1999,261(1):58-63.
[8] Solomon-Blackburn R M,Stewart H E,Bradshaw J E. Distinguishing major-gene from field resistance to late blight () of potato () and selecting for high levels of field resistance. Theoretical and Applied Genetics,2007,115(1):141-149.
[9] Lindqvist-Kreuze H,Gastelo M,Perez W,et al. Phenotypic stability and genome-wide association study of late blight resistance in potato genotypes adapted to the tropical highlands. Phytopathology,2014,104(6):624-633.
[10] 蒋锐. 马铃薯晚疫病广谱抗性QTL_dPI09c的精细定位及抗性基因克隆. 武汉:华中农业大学,2017.
[11] 李文娟,Forbes Gregory A,谢开云. 马铃薯晚疫病发病程度田间观察记录标准的探讨. 中国马铃薯,2012,26(4):238-246.
[12] 刘龙超,周云,贺苗苗,等. 四倍体马铃薯SSR遗传图谱的构建及晚疫病抗性QTL初步定位. 植物病理学报,2016,46(1):84-90.
[13] 王金萍,刘永伟,孙果忠,等. 抗茎腐病分子标记在159份玉米自交系中的验证及实用性评价. 植物遗传资源学报,2017,18(4):754-762.
[14] 向小姣,张建,郑天清,等. 应用分子标记技术改良京作1号的稻瘟病抗性. 植物遗传资源学报,2016,17(4):773-780.
[15] Zhu S,Li Y,Vossen J H,et al. Functional stacking of three resistance genes againstin potato. Transgenic Research,2012,21(1):89-99.
[16] 刘勋,郑克邪,张娇,等.马铃薯晚疫病抗性基因分子标记检测及抗性评价. 植物遗传资源学报,2019,20(3):538-549.
Evaluation of Germplasms for Resistance to Potato Late Blight and Molecular Markers Assisted Screening
Lou Shubao1, Li Fengyun1, Tian Guokui1, Wang Haiyan1Tian Zhendong2, Wang Lichun1, Liu Xicai1, Wang Hui1
(1Keshan Branch of Heilongjiang Academy of Agricultural Sciences/Key Laboratory of Potato Biology and Genetics, Ministry of Agriculture and Rural Affairs, Qiqihar 161005, Heilongjiang, China;2Huazhong Agricultural University/Key Laboratory of Potato Biology and Biotechnology, Ministry of Agriculture and Rural Affairs, Wuhan 430070, Hubei, China)
Potato late blight caused byhas always been a devastating disease in potato production. Use of resistant varieties is the most fundamental and effective way to control the disease. Molecular marker assisted selection can greatly shorten the breeding period, significantly improve the breeding efficiency. A total of 60 offspring of hybrid combinations of 395008.45×Kexin No.27 were evaluated for resistance to. The results showed that 39 materials were resistantance varieties and 21 materials were susceptible varieties. The molecular marker related to the resistance genewere used to detect 60 offspring and 36 potato germplasm resources, and 43 varieties (lines) and 28 varieties (lines) had resistance gene, respectively. The potato resistance germplasm resources tested could provide high-quality parental materials for disease resistance breeding.
Potato; Late blight; Molecular markers
10.16035/j.issn.1001-7283.2021.04.030
娄树宝,从事马铃薯遗传育种研究,E-mail:loushubao@163.com
黑龙江省农业科学院青年基金(2019YYYF017);国家自然科学基金“基于抗病基因组学和效应子识别策略的马铃薯晚疫病抗性优异基因资源鉴定、新抗病基因发掘与利用”(31761143007)
2020-10-27;
2020-12-03;
2021-06-29
