微囊藻毒素(MCs)对淡水池塘养殖业的危害及防控研究进展
2021-09-17毕相东
毕相东
(天津农学院 水产学院,天津市水产生态及养殖重点实验室,天津 300384)
中国淡水养殖产量已连续30年稳居世界首位。2020年中国淡水养殖产量为3 088.89万t,其中池塘养殖产量占比高达73.8%,足见淡水池塘养殖业在中国渔业经济结构调整和渔民增收中具有非常重要的作用。然而,频繁发生的蓝藻水华给淡水池塘养殖业造成了巨大的危害,成为限制淡水池塘养殖业健康发展的主要瓶颈之一[1-2]。
然而,由于MCs含量检测技术相对复杂,且其对养殖动物肝胰腺等损伤多与关键水质因子剧烈变化的危害相耦合,因此,有关其危害及防控一直未受到足够的重视。以往MCs对动物危害及防控研究主要聚焦于江河湖库,专门以淡水养殖池塘为研究对象的报道相对较少。为此,本文中综述了目前MCs对淡水池塘养殖危害及防控技术相关研究进展,并对该领域的研究趋势进行展望,以期为淡水池塘养殖业健康可持续发展提供借鉴。
1 MCs结构特征
根据致毒机理,蓝藻毒素主要分为肝毒性毒素和神经性毒素,其中肝毒性毒素主要包含MCs、节球藻毒素(nodularin,NOD)和柱胞藻毒素(cylindrospermopsin,CYN)等,而神经性毒素包含鱼腥藻毒素a(anatoxin-a,ANTX-a)、β-N-甲氨基-L-丙氨酸(β-N-methylamino-L-alanine,BMAA)和石房蛤毒素(saxitoxin,STX)等[8]。MCs因分布范围广、结构稳定性高、肝毒作用强,对水生动物毒害作用最强[15]。MCs是一类由微囊藻属Microcystis、鱼腥藻属Anabaena、浮丝藻属Planktothrix、束丝藻属Aphanizomenon产毒基因型的肽合成酶复合体基因簇编码的多酶复合体催化合成的环状七肽化合物[16],分子结构为环(-D-Ala-X-D-MeAsp/D-Asp-Z-Adda-D-Glu-Mdha)(图1)。由于MCs化学结构中X、Z两个可变氨基酸基团的不同组合,目前已发现100多种MCs同分异构体,其中以MC-LR、MC-RR、MC-YR分布最广、毒性最强[17]。Adda是MCs表达生物活性的必需基团,其中共轭双键是MCs毒性表现的最重要功能团。
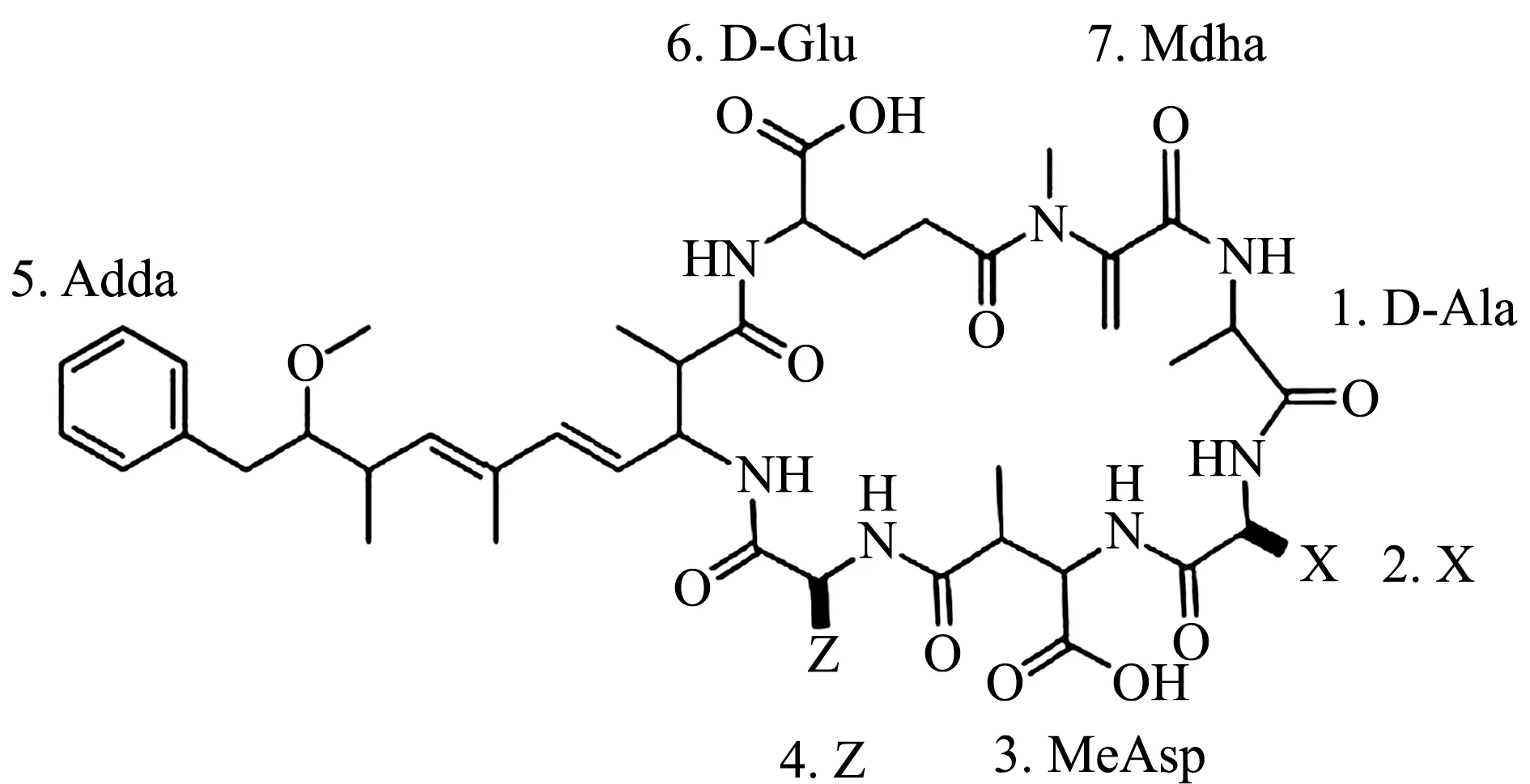
图1 微囊藻毒素(MCs)的分子结构
2 MCs的时空分布及机体积累特征
为科学防控MCs对养殖动物危害及提高淡水养殖产品质量安全性,近些年来,研究人员重点开展了MCs在养殖池塘中的时空分布及其在养殖动物机体中的积累特征两方面研究工作。
2.1 MCs在养殖池塘中的时空分布特征
以MCs为代表的蓝藻毒素主要贮存于鲜活的藻细胞内,少量分泌至水环境中,待藻细胞死亡破裂后胞内MCs会释放至水体中[18]。2015年6—12月,浙江湖州某淡水养殖池塘水体中MC-LR浓度(均为质量浓度,下同)为0~42 μg/L,MC-RR浓度为0~12 μg/L,某虾塘水体中MC-LR浓度为0~117 μg/L,MC-RR浓度为0~32 μg/L[19]。江苏省沿海地区凡纳滨对虾发病养殖池塘水体中MC-LR最高浓度达到23.15 μg/L[20]。在频繁暴发蓝藻水华的鲫养殖池塘,5—11月上覆水中胞外MCs浓度(以MC-LR与MC-RR总和计)为1.16~3.66 μg/L,上覆水中悬浮物(主要为蓝藻)MCs浓度为0.64~13.98 μg/g(干质量),底泥中MCs浓度为1.34~5.90 μg/g(干质量)[12]。在暴发微囊藻水华的河蟹养殖池塘中,8月上覆水中胞外MCs浓度(以MC-RR、MC-YR、MC-LR总和计)为1.09 μg/L、上覆水悬浮物中MCs浓度为0.88 μg/L[21]。2014年11月广东地区频频暴发蓝藻水华的凡纳滨对虾套养草鱼/鲫池塘中胞外MCs浓度(以MC-LR计)为0.18~0.79 μg/L[22]。因养殖后期水华蓝藻细胞的持续衰亡破裂,对虾养殖池塘中胞外MCs浓度可高达1.79~2.25 μg/L[23]。
2.2 MCs在养殖动物机体中的积累特征
养殖动物可以通过直接摄食有毒微囊藻、捕食以有毒微囊藻为食的浮游动物,或通过鳃和/或皮肤吸收等方式在其体内积累MCs[24]。MCs在养殖动物机体的积累特征可间接指征其对养殖动物的危害程度,同时又直接反映暴发蓝藻水华的养殖池塘中水产品质量安全状态。在持续发生蓝藻水华池塘中养成的鲫Carassiusauratus对MCs有明显的生物积累效应,其各组织器官对MCs 积累效应顺序为肝脏(3.73 μg/g)>肾脏(2.81 μg/g)>肠壁(2.27 μg/g)>肌肉(0.41 μg/g)(均为干质量)。按照一个体质量60 kg的成年人每天摄入300 g鱼肉估算食用风险,若食用该养成鱼的肌肉部分,人体每日MCs摄入量为世界卫生组织限定最大摄入量的4.3倍,存在较高的健康风险[12,14]。养殖动物对于MCs积累不仅具有器官特异性,还具有一定种属差异性,且与MCs的类型和不同养殖动物的解毒机制有关。银鲫Carassiusauratusgibelio摄食新鲜的铜绿微囊藻80 d后,血液、肝脏和肌肉中均检测到MC-RR的存在,最大值分别达到49.7、17.8、1.77 mg/g(干质量),虽然在其肠道中检测到高水平MC-LR,但在其肌肉和血液中却未检出MC-LR[25]。太湖鲤Cyprinuscarpio肠壁中MCs积累量明显高于肾脏、肝脏、心脏、肌肉,并且与多数器官主要积累MC-RR不同,鲤肠壁以积累MC-LR为主,其占比超过50%[26]。将罗非鱼在蓝藻水华发生池塘中养殖40 d,期间池塘水体MC-LR浓度变化为0.123~0.514 μg/L,鱼体肌肉中MC-LR积累量达到1.194~3.615 ng/g,肝脏中MC-LR积累量最大值达到21.478 ng/g,显著高于肌肉组织[27]。值得注意的是,养殖动物体内MCs积累量受其营养级影响,营养级越高的水产动物机体内MCs积累量越高,一般表现为肉食性鱼类> 杂食性鱼类> 浮游植食性鱼类> 植食性鱼类[28-29]。
3 MCs对养殖动物的毒害效应及作用机理
3.1 MCs对养殖动物胚胎发育的毒害效应
MCs具有胚胎发育毒性,能干扰养殖动物胚胎发育,延迟胚胎孵化时间,降低孵化率,增加畸形率。南方鲇Silurusmeridionalis受精卵经10、100 μg/L MC-LR孵育处理后,出膜时间分别延迟2、10 h,孵化率分别降低22%和45%,畸形率分别提高9%和15%[30]。MCs对大鳞副泥鳅Paramisgurnusdabryanus胚胎有明显的致畸效应,主要表现为:卵黄吸收少,卵黄膨大、崩解;心包肿大,管状心脏,心跳过缓或局部停止;弯体或弯尾且胚胎畸形率随MCs浓度升高而上升[31]。MCs对养殖动物胚胎的致畸作用不仅具有剂量依赖性,还受胚胎发育阶段的影响。翘嘴红鲌胚胎发育后期对MC-LR的敏感性大于胚胎发育前期,MC-LR对翘嘴红鲌卵裂期胚胎、囊胚期胚胎、原肠期胚胎致畸作用的EC50分别为201.07、180.03、176.38 μg/L[32]。不同发育时期的泥鳅胚胎经MC-LR染毒处理后,表现为胚胎原肠期对MC-LR最为敏感,孵化后期比早期敏感,即对原肠期影响最大,其次是出膜期、32-细胞期和1-细胞期[33]。大量研究发现,胚胎发育期对大多数毒物的敏感性低于仔鱼期[34],主要与卵膜和卵周液对毒物的天然屏蔽作用有关,但MCs属于对鱼类胚胎毒性较大的毒素,其对胚胎的毒性高于对初孵化仔鱼的毒性[31-32]。
3.2 MCs对养殖动物组织器官的毒害效应
目前,有关养殖池塘原位水环境中MCs对养殖动物组织器官毒害效应的研究报道相对较少,以往有关研究结论多是基于实验生态学下采取腹腔注射、灌胃、饲喂微囊藻毒素或有毒蓝藻的急性或亚急性毒性试验得到的,总体上可表现为以肝脏(或肝胰腺)为主,并伴有肾脏(中肾)毒性、免疫器官(脾脏和头肾)毒性、鳃毒性等(表1)。
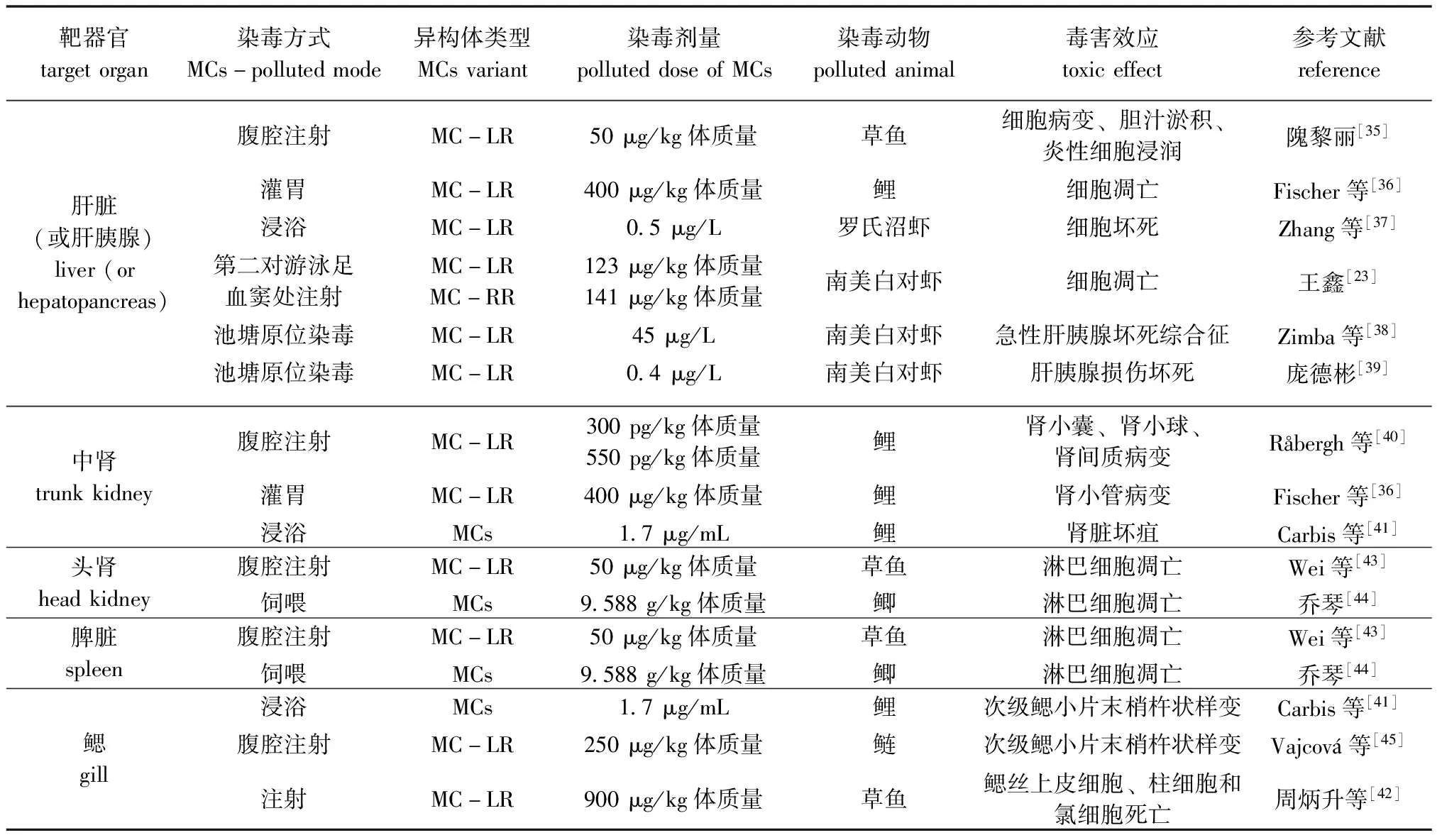
表1 MCs对水产养殖动物多靶器官的毒害效应
3.2.1 对肝脏(或肝胰腺)的毒害效应 肝脏(或肝胰腺)是MCs的主要靶器官。草鱼Ctenopharyngodonidella肝胰腺在50 μg/kg MC-LR亚急性毒性作用下,肝细胞发生明显的脂肪样变,同时发生线粒体水肿、内质网扩张、溶酶体增多等病理改变[35]。采用钝头注射器对鲤灌胃冻干铜绿微囊藻悬浮液,24 h后细胞分散,48 h后就可观察到肝细胞膜开始消失,并伴随着细胞核浓缩和早期细胞凋亡的出现[36]。较低浓度的MCs即可明显损伤虾类肝胰腺生理结构并降低其免疫防御能力,暴露于0.5 μg/L MC-LR水环境3周后,罗氏沼虾肝胰腺细胞坏死且抗氧化防御系统功能大幅降低,导致其染病致死率显著高于对照组[37]。南美白对虾Litopenaeusvannamei经注射MC-LR、MC-RR急性染毒16 h后,其肝小管管腔扩大、不规则,细胞出现空泡化,可见坏死的细胞核、残余的组织散落在肝小管间隙,并出现明显的细胞凋亡现象[23]。在养殖池塘原位水环境中,南美白对虾发生急性肝胰腺坏死综合征(俗称偷死病)与MCs密切相关,发生偷死病的对虾养殖池塘中溶解性MC-LR浓度高达45.0 μg/L,偷死对虾肝胰腺游离MC-LR浓度高达55.0 μg/g(虾体),而未发生偷死病池塘未检测到溶解性MC-LR[38]。庞德彬[39]基于长期监测及养殖实践分析发现,当水体中溶解性MC-LR浓度达0.4 μg/L时,可有效诱发对虾肝胰腺损伤坏死,继而暴发对虾白便综合征。
3.2.2 对肾脏(中肾)的毒害效应 肾脏(中肾)也是MCs作用的主要靶器官。鲤经300 pg/kg MC-LR注射染毒,7 d后可见肾小囊扩张,注射 550 pg/kg MC-LR,24 h后即可见肾小囊扩张、肾小球充血,肾间质水肿[40]。采用灌胃方式给鲤饲喂相当于400 μg/kg MC-LR的冻干铜绿微囊藻悬浮液后,1~3 h内可观察到肾近端小管(P1和P2)出现退行性病变,主要表现为单管上皮细胞空泡化增加,细胞固缩、凋亡,细胞裂解,上皮细胞脱落进入管状内腔;12 h 后所有的小管均出现同样损伤,导致皮质-髓质交界处形成蛋白质样脱落物,24 h时小管的病理变化增加到只剩下小管的残余,即小管结构已经解体[36]。除灌胃和注射方式外,浸浴在含1.7 μg/mL MCs的水中也可使鲤肾脏出现坏疽现象[41]。MCs对肾脏的毒性效应与染毒方式、染毒时间有关,并且还受养殖动物种类的影响。采用900 μg/kg MC-LR注射草鱼,染毒24 h后,草鱼肾超微结构没有显著变化[42]。
3.2.3 对免疫器官的毒害效应 脾脏和头肾是鱼类重要的免疫器官。采用腹腔注射MC-LR(50 μg/kg体质量)方式对草鱼进行染毒处理,1 d后脾脏内淋巴细胞线粒体即出现轻微水肿,2 d后大量淋巴细胞出现凋亡,表现为细胞变形,细胞核皱缩,染色质凝聚、浓缩成新月形或弧形,但至21 d时仅可观察到个别细胞有异染色质聚集的现象;用MC-LR处理1 d后头肾淋巴细胞即出现线粒体水肿和细胞质水肿,2 d后线粒体和细胞质水肿程度均加剧,大量线粒体空泡化,但到21 d时细胞均恢复正常[43]。用添加蓝藻藻粉的饲料饲喂鲫30 d,头肾中淋巴细胞质中出现空泡,线粒体肿胀,染色质凝集,溶酶体增多,细胞核发生变形;脾脏中淋巴细胞细胞核出现变形,线粒体肿胀,细胞质密度降低,红细胞膜外间隙明显增大[44]。
3.2.4 对鳃组织的毒害效应 鲤经浸浴染毒后,次级鳃小片末梢出现杵状样变,表皮增厚[41]。鲢经注射染毒后,亦可造成次级鳃小片末梢杵状样变,表皮逐渐增厚,广泛性上皮细胞固缩坏死,并与血管区分离[45]。MC-LR 不仅可导致草鱼鳃丝上皮细胞、柱细胞和氯细胞死亡,血管中无红细胞,还可引起心脏中心肌细胞间腔隙增大[42]。
3.3 MCs毒害养殖动物的作用机理
蓝藻毒素吸收与积累主要是通过肝肠循环的胆汁酸转运蛋白转运和肝/肠细胞膜上有机阴离子转运蛋白(organic anion transporting polypeptides,OATPs)直接摄取两种方式完成的[46-47],因此,蓝藻毒素在机体内积累及其毒性具有非常明显的器官特异性,即蓝藻毒素对肝胰腺及肠道损伤最为显著,蓝藻毒素对于肾脏及心脏等脏器的损伤则是通过肝胰腺及肠道的间接毒性实现的[47]。MCs可以通过与丝氨酸/苏氨酸亚基共价结合方式抑制蛋白磷酸酶(PP1和PP2A)活性,能够特异性地抑制蛋白磷 PP1和PP2A活性,相应增加蛋白激酶的活性,导致肝脏和肠道细胞内多种蛋白质高度磷酸化及肝肠细胞过磷酸化,进而通过线粒体通路与内质网通路诱导肝脏和肠道细胞凋零[48-49]。线粒体通路是MCs诱导肝脏和肠道细胞凋零的最重要通路,MCs引起的DNA损伤、细胞骨架损伤、细胞周期阻滞、细胞凋零和死亡均与其抑制PP1和PP2A活性,增加细胞蛋白磷酸化水平相关[48]。如MC-LR通过抑制PP2A激活P53,引起Bcl-2蛋白家族中凋零/抗凋零成员Bax/Bcl-2比例失衡,导致线粒体通透性孔道打开,释放凋零蛋白-细胞色素C到细胞质中,触发半胱天冬酶级联的激活,最终导致细胞凋零[48]。内质网通路是MCs诱导肝脏和肠道细胞凋零的另外一条重要通路,由于过度磷酸化,未折叠或错误折叠蛋白在内质网腔中积累可导致内质网应激[50],长时间或严重的内质网应激可导致未折叠蛋白反应和细胞凋零[49],这个过程由C/EBP同源蛋白(CHOP)的转录诱导[51]和/或caspase-12-dependent通路介导[52]。MCs还可通过消耗谷胱甘肽(GSH)及破坏线粒体电子传递链两种方式引起线粒体通透性发生变化,进而引起肝脏和肠道细胞氧化应激而产生活性氧(ROS),导致脂质过氧化,最终造成细胞凋零[48,53-55]。动物细胞中MCs摄取、毒性机制及生物转化和排泄路径见图2。
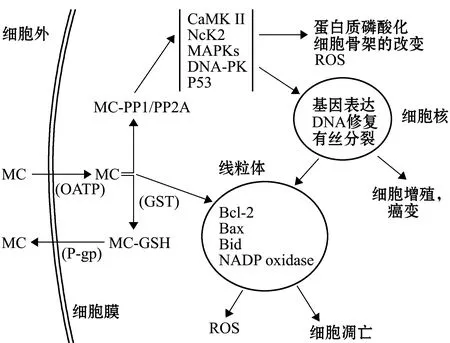
P-gp为P-糖蛋白;Bcl-2、Bax、Bid为与细胞凋亡有关蛋白;P53为一种蛋白;NeK2为丝氨酸-苏氨酸激酶;NADP oxidase为辅酶II氧化酶;MAPKs为丝裂原蛋白激酶;CaMKII为钙调蛋白激酶II;OATP为有机阴离子转运多肽。
4 养殖池塘中MCs防控技术
以往因缺乏蓝藻毒素对淡水池塘养殖动物危害系统性认识,建立起来的蓝藻水华防控措施是以快速有效降低蓝藻生物量为目的,而对于蓝藻毒素危害则缺乏针对性的防控技术。采用硫酸铜[57]、抗生素[58]和化感物质[59]杀灭蓝藻是快速降低养殖池塘蓝藻生物量的常用措施,然而短时间内蓝藻细胞死亡破裂会造成贮存于蓝藻细胞内的毒素大量释放,导致养殖动物发生中毒,动物免疫力下降并引发病原微生物感染;同时,因微藻光合产量急剧下降及化学耗氧量快速升高导致水体DO急剧下降,促使衰亡蓝藻碎片发生厌氧分解生成H2S及NH2OH等有害物质,养殖动物发生强烈的应激反应。
为此,研究人员有针对性地探索建立养殖池塘MCs的科学防控技术。结合蓝藻水华危害的防控过程,目前已初步建立起的MCs毒素科学防控技术主要包含3个层面:1)通过生态控藻,从源头防控MCs危害;2)开发MCs降解技术,直接降低其危害性;3)通过营养调控/药物治疗提高养殖动物对MCs的抵抗力,间接降低其危害性(表2)。

表2 淡水养殖池塘MCs科学防控技术
4.1 MCs危害的生态防控技术
4.1.1 生态养殖控藻 依托水生生物食性及生态位的不同构建生态养殖模式,可以较为有效地从源头防控蓝藻毒素危害。依托杂食性鲫和滤食性淡水螺类构建起来的中华鳖生态养殖模式相比于中华鳖普通养殖模式,极显著地提高了养殖池塘浮游植物多样性(P<0.01),且蓝藻数量占比下降了24.59%,最终中华鳖养殖单产提高2.61%[60]。利用不同生态位的水生生物间协同作用,构建由水生植物(水雍菜等)浮床、水生植物(芦苇)湿地、固定化微生物膜、底栖软体动物(褶纹冠蚌)和滤食性鱼类(鲢、鳙和梭鱼)组成的养殖池塘循环水多级生物净化系统,经过系统净化后养殖池塘蓝藻生物量减少率达51%以上,从根源上降低了蓝藻毒素危害性[61]。在三角帆蚌养殖池塘适当混养鲢或鳙可以有效控制铜绿微囊藻的生长,促进有益藻类的生长,有利于提高三角帆蚌养殖产量[62]。在罗氏沼虾养殖后期放养白鲢,各白鲢放养试验池塘蓝藻比例下降均显著高于对照组(P<0.05),放养密度为2 000尾/667 m2试验池塘蓝藻和微囊藻密度下降幅度分别高出对照组26.1%和37.2%[63]。
4.1.2 定向培育有益藻抑制蓝藻生长 微藻的定向培育是实现人工科学构建池塘良性微藻群落的主要技术手段,是根据养殖环境水质调控和对生物饵料的需要,在池塘或水泥池中培育经选育有益微藻而获得特定微藻群落和藻相的技术[64]。定期向养殖池塘添加硅藻藻种可以显著降低草鱼养殖池塘中蓝藻生物量和显著提高硅藻生物量(P<0.05),同时可以改变水体中浮游植物的群落结构,从源头上降低了蓝藻毒素对草鱼池塘养殖的危害[65]。在克氏原螯虾和河蟹混养池塘定向培育底栖饵料微藻,相比于施用鸡粪与猪粪的养殖池塘,定向培育底栖饵料微藻可极显著降低养殖池塘中蓝藻生物量(P<0.01),且蓝藻生物量占比降低4.9%[66]。在鱼类养殖池塘内定向培育小球藻可以高效地控制有害蓝藻水华的发生,并保持池塘水质稳定良好[67]。
4.2 MCs降解技术的研发
水环境中MCs自然降解主要依赖于微生物降解与光降解两种途径[68-70]。采用室内精准模拟试验[68,71-72]和长期原位跟踪分析[68]研究发现,微生物降解是自然环境中MCs最主要的消减策略,对有效降低MCs生态危害性具有重要意义。筛选MCs高效降解菌和MCs靶向降解酶是开发MCs微生物降解技术的两方面重点工作,并取得一定成果。然而,目前现有MCs微生物降解技术在淡水养殖池塘实际应用研究却鲜有报道。
4.2.1 MCs高效降解菌群及特异性降解菌株 从滇池选择性富集的高效MCs降解菌群可显著提高人工湿地系统对溶解性MC-LR的去除速率,将湿地系统中溶解性MC-LR半衰期由31 h缩短至22 h[73];从太湖中驯化获得2个土著MCs降解菌群,6 d内均可将初始浓度高达5.0 mg/L的MC-LR降解80%以上[74]。最早报道的MCs特异性降解菌Sphingomonassp.ACM-3962分离自澳大利亚河水中,该菌经过2~8 d降解滞后期后可迅速将1.0 mg/L溶解性MC-LR降解殆尽[75-76]。目前研究人员已从各种环境中分离出超百株特异性MCs降解菌,分类上多属于变形杆菌门、放线菌门和芽孢杆菌纲[77-78]。袁媛等[79]将分离自巢湖沉积物中MCs降解菌蜡样芽孢杆菌固定于活性炭纤维上,然后将固定膜置于MC-LR初始浓度为6.8 mg/L的培养基中,5 d后MC-LR降解率达到77.3%~92.9%。采用内酯纳米纤维膜固定化的太湖土著MCs降解菌48 h时对MC-LR降解率可达60.16%[80],采用以聚酯树脂为介质固定的特异性MCs降解菌株B-9 24 h 时对MC-RR降解率超过90%,更为重要的是其降解效率60 d后仍可保持在80%以上[81]。
4.2.2 基于微生物降解MCs分子机制的MCs降解酶 MCs降解菌Sphingopyxissp.ACM-3962的降解过程中至少有 3 种酶MlrA、MlrB和MlrC参与了MC-LR的降解[75]。MlrA是已发现的多数好氧降解菌酶催化降解MCs所需的第一个关键酶,是由336个残基组成的肽链内切酶[82]。MlrA负责水解打开MC-LR连接Adda与Arg间酞胺键,使环状MC-LR变成线型MC-LR,可大幅降低MC-LR毒性[83]。Liu等[84]基于MCs降解的分子机制,通过EscherichiacoliK12 TB1过表达mlrA基因后获得纯度超过90%降解酶MlrA,该酶表现出很高的降解效率,相对于对照组,MlrA 9 d的MC-LR降解率超过97%。目前,MCs降解酶技术被认为是非常具有开发应用前景的MCs危害防控技术。
4.3 采用营养调控/药物治疗提高养殖动物对MCs毒害作用的抵抗力
4.3.1 营养调控技术 通过向饲料中添加抗氧化剂等营养调控方式来间接降低MCs危害性研究较多。基于MCs通过消耗GSH引起脂质过氧化的致毒机理,在饲料中添加GSH或配伍GSH复合型抗氧化剂可有效提高鱼类对于MCs毒害的抗氧化能力,并能明显降低机体的MCs富集量[85]。另有研究表明,硫辛酸[86]、维生素C[80]、虾青素[87]、左旋肉碱[88]等抗氧化剂均可不同程度地提高养殖动物的抗氧化能力或降低MCs对养殖动物肝脏组织的损伤。
4.3.2 药物治疗技术 除采用营养调控技术来间接降低MCs对养殖动物危害性外,目前研究人员还依托中草药相关制剂,已初步开发出系列防护能力更强的MCs解毒药剂。毕相东等[89]利用黄芪总黄酮拮抗毒物损伤肝细胞的药理作用,配伍GSH制备出养殖鱼类内服用MCs解毒剂,可有效清除鱼体内ROS,诱导谷胱甘肽巯基转移酶(glutathione-S-transferases,GST)基因表达量显著上调(P<0.05),进而有效治疗对鱼类MCs中毒引发的肝胰腺损伤病症,进一步研究表明,黄芪总黄酮中的毛蕊异黄酮虽然对MCs暴露后的草鱼肝细胞表现出增强细胞骨架和在MCs暴露早期抑制ROS大量产生的作用,但同时也会引起MCs诱导的草鱼肝脏细胞氧化应激升高并降低草鱼肝脏细胞GST系统解毒功能(研究结果待发表)。韩光耀等[90]研究表明,在饲料中添加0.5%黄连水提液干物质可诱导鲢肝脏GSH和GST活力极显著升高(P<0.01),从而提高鲢对MCs毒害抵抗力。
5 存在问题及展望
5.1 淡水养殖池塘MCs危害科学防控中存在的问题
当前,以MCs为主的蓝藻毒素已成为制约淡水养殖业健康发展的重要因素之一。虽然目前关于淡水养殖池塘MCs危害防控已经取得一定的进展,但还存在以下几方面的问题:1)养殖池塘MCs时空分布特征、自然降解规律及最终环境归趋特征的相关研究还不够深入,直接影响养殖池塘MCs科学防控;2)有关MCs微生物降解机制的研究还不完善,直接影响养殖池塘MCs高效防控;3)养殖池塘中与MCs产生关联的水环境因子耦合关联因素还未完全明确,直接影响MCs防控体系的建立;4)养殖池塘中MCs危害的应急防控措施建立不够;5)从源头上降低水华蓝藻细胞数目的技术还不够完善,即养殖池塘科学的生态立体化养殖技术还需优化;6)采用营养调控/药物治疗技术直接拮抗MCs对养殖动物毒害作用研究不够。
5.2 未来研究应用展望
结合中国现阶段对于淡水养殖业生态绿色高质量发展的要求及现有淡水池塘养殖尾水处理主要模式,建议从以下方面加强对淡水养殖池塘中MCs危害及防控技术领域的研究应用,以期突破蓝藻水华对淡水养殖业的危害制约。
1)因地制宜地构建可复制、可推广的多营养层级的淡水池塘生态立体养殖模式,从根本上降低养殖水体富营养化水平,有力地遏制养殖池塘蓝藻水华的频繁发生,进而从源头上消除MCs对淡水池塘养殖的危害。
2)发挥水生植物、滤食性贝类、微生物等的生态耦合效应,建立起兼具吸收氮磷营养及降解MCs功能的淡水池塘养殖尾水(循环水)处理模式,既可降低池塘蓝藻水华发生,又能降低池塘MCs含量,有效降低水华蓝藻及MCs的危害。
3)加强典型淡水养殖池塘中MCs时空分布及环境归趋特征研究,为有针对性地建立MCs危害防控策略提供科学参考。
4)加强MCs对淡水池塘养殖危害的应急处置,可重点加强MCs高效降解菌(群)或高效降解酶在淡水池塘养殖中的研发应用,为应急防控做好技术储备。
5)加强针对养殖动物MCs毒害作用的营养调控/药物治疗技术研发应用,尤其是要结合MCs毒害作用的分子机制开发靶向药物,从根本上提高养殖动物对MCs毒害作用的抵抗力。
致谢:天津农学院水产学院戴伟副教授对本文提出了修改意见。
