TGF-β/Smad通路成员Smad2和Smad7及MMP-9蛋白在早发性子痫前期胎盘中的表达及意义
2021-09-17聂付芳杨培峰杜淑文任方
聂付芳,杨培峰,杜淑文,任方
(郑州大学第三附属医院/河南省妇幼保健院妇产科,河南 郑州 450052)
0 引言
子痫前期是一种妊娠特异性疾病,其特点是妊娠20周后出现新发高血压和/或伴随的临床和实验室指标的变化,是严重危害母胎健康的主要原因,其全球发病率为3%~8%;胎盘娩出后临床症状自行消失。而发生于34周之前的子痫前期被称为早发型子痫前期(EOPE),其病情进展迅速,且常合并多种并发症,严重时甚至直接导致胎儿死亡,对母婴的身体健康造成了严重的威胁[1]。滋养细胞浸润及侵袭不足、螺旋小动脉的不完全重塑、血管阻力增大,胎盘灌注减少,缺血缺氧,被认为在此疾病病因中起着重要作用[2,3]。
目前子痫前期的发病机制依然不明,在胎盘发育的整个过程中,细胞因子通过参与滋养细胞的信号对话,实现对胎盘发育的调控作用,其中TGF-β/Smad通路参与了机体广泛的生理活动,例如滋养细胞的分化、细胞凋亡、免疫调节和胎盘植入[4]。近年来,有大量研究认为TGF-β/Smad通路成员的传导紊乱在子痫前期的发生发展中起重要作用。现对该通路的主要成员受体激活型Smad2、抑制型Smad7及其下游因子MMP-9在子痫前期的发生发展所扮演的角色进行探讨。
1 资料和方法
1.1 一般资料
选取自2019年1月至2020年10月于我院分娩的EOPE孕妇的胎盘组织30例作为实验组,另取同期正常分娩的孕妇胎盘组织30例作为对照组.纳入标准:(1)均为单胎妊娠,胎儿无畸形;(2)所有纳入对象均符合EOPE相关诊断标准[5];(3)孕期均在本院进行完整的产前检查,且资料完整。排除标准:(1)孕期检查发现存在妊娠期糖尿病、肾脏疾病、血液系统疾病以及甲状腺功能异常;(2)孕期接受过心脑血管药物治疗或心血管疾病;(3)子宫先天性发育异常或胎盘异常;(4)无法正常交流沟通或伴有精神疾病。两组年龄、孕次、体重指数(BMI)、产次等一般资料比较,差异均无统计学意义(P>0.05),见表1。本研究已获本院伦理委员会审查批准,所有研究对象均已签署知情同意书。

表1 对照组和SPE组孕妇一般临床资料
1.2 方法
1.2.1 标本的采集与制备
胎盘娩出后,立即取胎盘母体面中央区域,剪除底蜕膜层,避开钙化坏死区,取丛密绒毛膜层组织2块,大小约为1.0cm×1.0cm×0.5cm,4℃生理盐水冲洗,10%中性甲醛固定24h,石蜡包埋,4μm厚切片备用。
1.2.2 主要试剂
上海生工兔抗人Smad2、Smad7及MMP-9多克隆抗体。
1.2.3 免疫组化
将标本连续切片,脱蜡,水化,抗原热修复,灭活内源性过氧化物酶,封闭液室温孵育30min,滴入一抗,恒温4℃冰箱过夜,滴加二抗,再次孵育30min,上述间隔均需用PBS冲洗,DAB显色约10min,苏木素复染,脱水,透明,最后封片。
1.3 统计学处理
采用SPSS 26.0软件进行临床资料统计学分析。Image J软件进行图像分析,graphpad 7进行图像数据分析。检验计量资料数据的正态性及方差齐性,若数据满足正态分布,则以(±s)表示,多个样本均数比较采用单因素方差分析(ANOVA),并用Bonferroni法进行事后检验;P<0.05代表差异有统计学意义。
2 结果
MMP-9蛋白主要表达于胎盘合体滋养细胞和血管内皮细胞的细胞质中呈棕黄色染色。1A:正常组,胎盘合体滋养细胞可见大量棕黄色颗粒,部分血管内皮细胞的细胞质中可见黄色颗粒。1B:早发型子痫前期组,胎盘合体滋养细胞胞质可见浅黄色染色,部分细胞核可见浅黄色染色。1C:Image J软件对MMP-9的免疫组化结果图进行半定量分析,*P<0.05,表示统计学有意义。
Smad7蛋白主要表达于胎盘合体滋养细胞和血管内皮细胞的细胞质和部分细胞核中,呈棕黄色染色。2A:正常组,胎盘合体滋养细胞、血管内皮细胞的胞质及部分细胞核中可见大量棕黄色颗粒。2B:早发型子痫前期组,胎盘合体滋养细胞、血管内皮细胞的细胞质及部分细胞核中可见浅黄色颗粒。2C:Image J软件对Smad7的免疫组化结果图进行半定量分析,*P<0.05,差异有统计学意义。
Smad2蛋白主要表达于胎盘合体滋养细胞和血管内皮细胞的细胞质及部分细胞核中呈棕黄色染色。3A:正常组,胎盘合体滋养细胞及血管内皮细胞胞质中可见浅黄色染色。3B:早发型子痫前期组,胎盘合体滋养细胞及血管内皮细胞的胞质及部分细胞核中可见大量棕黄色颗粒。3C:Image J软件对Smad2的免疫组化结果图进行半定量分析,*P<0.05,表示统计学有意义。
2.1 两组孕妇的胎盘组织中MMP-9蛋白表达结果
免疫组化结果显示:MMP-9蛋白主要表达于胎盘合体滋养细胞和血管内皮细胞的细胞质,呈棕黄色染色见图1(1A-1B)。且早发型子痫前期组的染色程度弱于正常组,见图1(1C);差异具有统计学意义,*P<0.05。

图1 免疫组化结果显示
2.2 两组孕妇的胎盘组织中Smad7蛋白表达结果
免疫组化结果显示:Smad7蛋白主要表达于胎盘合体滋养细胞和血管内皮细胞的细胞质以及部分细胞核,呈棕黄色染色见图2(2A-2B)。早发型子痫前期组的染色程度明显低于正常组,见图2(2C);差异具有统计学意义,*P<0.05。
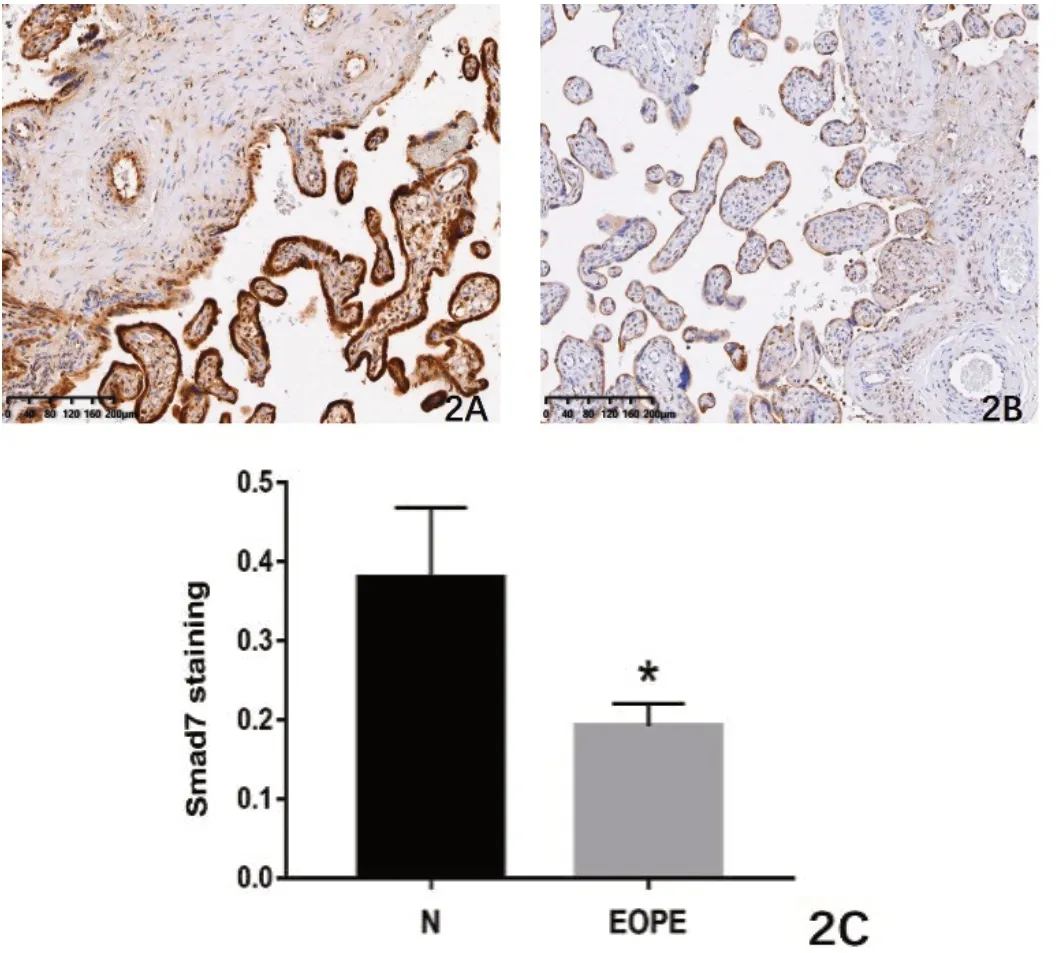
图2 免疫组化结果显示
2.3 组孕妇的胎盘组织中Smad2蛋白表达结果
免疫组化结果显示:Smad2蛋白主要表达于胎盘合体滋养细胞和血管内皮细胞的细胞质以及部分细胞核,呈棕黄色染色见图3(3A-3B)。且早发型子痫前期组的染色程度高于正常组,见图3(3C);差异具有统计学意义,*P<0.05。

图3 免疫组化结果显示
3 讨论
子痫前期多在妊娠20周以后出现,即胎盘功能成熟后开始发病,在胎盘娩出后病情得到迅速缓解,提示胎盘可能在子痫前期发病中起着关键作用[6]。Kadyrov[7]等人研究发现早发型子痫前期患者胎盘着床部位的子宫全层标本中,滋养细胞侵入不足,胎盘组织细胞凋亡明显增加,螺旋小动脉重塑不足,管腔狭窄,胎盘着床较浅,故得出早发型重度子痫前期更倾向于是一种胎盘疾病。近年来的研究表明晚发型子痫前期胎盘的滋养细胞不存在过度凋亡现象,推测晚发性子痫前期的发病原因可能与胎盘关系不大,而与母体因素有关[8]。故而得出早发型子痫前期和晚发性子痫前期可能存在不同的发病机制。
就目前而言子痫前期的发病机制主要有子宫螺旋小动脉重铸不足、胎盘浅着床、炎症反应过度激活、血管内皮细胞受损、滋养细胞过度凋亡等几种学说。研究表明TGF-β/Smad通路不仅在恶性肿瘤的发生发展中起着重要作用,而且也在上皮间质转化(epithelial-mesenchymal transition,EMT)中担当了重要角色,EMT可能是促进滋养细胞转移所必须经历的一个过程。Smad蛋白与转化生长因子-β(TGF-β)超家族配体相结合传递信号,其通过激活丝氨酸/苏氨酸激酶受体来调节细胞的增殖、分化和凋亡。Smad的蛋白在各种生物体及人类各组织中均有表达。Smad蛋白按其功能分为3类:一类是受体调节型R-Smad,可直接与受体结合,包括Smad1、2、3、5、8;一类是共同结合型Co-Smad,只有Smad4一种;最后一类是抑制型I-Smad,包括Smad6、7[9]。抑制型受体通过干扰R-Smad的磷酸化或竞争性抑制R-Smad和Co-Smad之间复合物的形成来抑制两组的信号功能[10]。然而Smad6会优先抑制BMP[11];而Smad7抑制活化素、TGF-β及BMP信号通路[12]。
抑制型Smad7已被证明是TGF-b信号通路的细胞内拮抗剂[13]。于洪等人的研究表明,在心脏重塑过程中,Smad7可抑制MMP-9的活性[14],而Seiya Kato等人的研究表明Smad7过表达能够促进细胞增殖[15];Sangmin Kim等人的研究表明在乳腺癌细胞中,表皮生长因子(the epidermal growth factor;EGF)诱导的MMP-9的表达被Smad7的过表达完全抑制,进而推断Smad7可能抑制乳腺癌细胞的侵袭和转移作用[16],这说明了Smad7对机体得调控受表达量影响。
绒毛外滋养细胞得侵袭和迁移常伴有细胞外基质得降解和重塑。MMPs是细胞外基质的降解和重塑的关键酶,MMP-9是一类结构中含有锌和钙的蛋白水解酶,在体内主要参与细胞外基质(ECM)的降解,MMP-9可降解大部分变性的胶原及IV、V型胶原。滋养细胞侵入母体的过程包括滋养细胞的黏附、基质的溶解和细胞的迁移。其中,基质的溶解是侵蚀过程的重要环节,滋养细胞本身并不能吞噬溶解基质,但可分泌作用于细胞外基质的酶。其中MMP-9是降解蜕膜基质的重要酶类[17];其主要功能是降解和重塑细胞外基质的动态平衡,研究报道MMP-9是调节绒毛外滋养细胞迁移和侵袭所必须的[18]。
本研究的免疫组化结果显示,Smad7蛋白于胎盘合体滋养细胞和血管内皮细胞的细胞膜、细胞质及细胞核中均有表达;且早发型子痫前期组胎盘组织中的表达量明显低于正常妊娠胎盘组。MMP-9蛋白主要表达于胎盘滋养细胞、血管内皮细胞的细胞膜、细胞质及细胞核中也均有表达,且早发型子痫前期组胎盘组织中的表达量明显低于正常妊娠胎盘组织。Smad2蛋白主要表达于胎盘合体滋养细胞和血管内皮细胞的细胞质以及部分细胞核,且早发型子痫前期胎盘组织中的表达量高于正常妊娠胎盘组织。说明Smad7和MMP-9于早发型子痫前期的发病中的作用可能存在正相关性,而Smad2与MMP-9的表达于早发型子痫前期的发病中可能存在负相关性。根据前人对TGF-β/Smad的研究推测Smad7的低表达可能降低了其对TGFβ1-Smad2/smad3表达的抑制,导致此信号通路的过表达,从而抑制了MMP-9的表达,近而抑制绒毛外滋养细胞的迁移和侵袭,参与子痫前期的发病[19]。
虽然Smad7的作用是有争议的,但我们的结果表明,较正常胎盘组织,早发型子痫前期胎盘组织中Smad7和MMP-9表达均下降,而Smad2在早发型子痫前期组呈高表达状态,提示Smad7和MMP-9在子痫前期发病中可能存在正相关性,而Smad2和MMP-9在子痫前期发病中可能存在负相关性。
