EGFR基因突变阳性肺腺癌脑转移患者治疗后颅内失败的临床研究
2021-09-16宋玉芝甄婵军白文文李博乔学英周志国
宋玉芝,甄婵军,白文文,李博,乔学英,周志国*
肺癌脑转移发生率为20%~40%[1-3]。EGFR基因突变阳性的患者在亚洲人群中占45%~65%[4-5]。既往研究显示,肺腺癌尤其是EGFR基因突变阳性患者更容易发生脑转移[6-8]。目前EGFR基因突变阳性肺腺癌脑转移患者的治疗仍是热点问题并存在争议,多项研究报道该类患者治疗后颅内控制时间为12.5~22.6个月,生存时间为15.1~41.1个月[9-16]。目前已知颅外器官转移或转移器官数目、年龄、吸烟、性别、颅脑放疗、美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)制定的体力状况评分、卡氏(Karnofsky)评分、脑转移数目、特殊诊断评估预后分级(diagnosis-specific graded prognostic assessment,DS-GPA)、肺癌专用诊断评估预后分级(lung-mol graded prognostic assessment,Lung-molGPA)等与该类患者的颅内控制和生存时间相关[9,11,14,16-20]。经脑转移治疗后部分患者仍会出现颅内失败,且部分患者较早就出现了颅内失败,颅内失败与哪些因素有关目前报道并不十分明确。本研究回顾性分析河北医科大学第四医院收治的282例EGFR基因突变阳性肺腺癌脑转移患者的临床资料,探讨该类患者治疗后发生颅内失败的相关影响因素,为提高患者的颅内控制效果、延长生存时间提供依据。
1 对象与方法
1.1 研究对象 收集2011年1月至2018年6月河北医科大学第四医院收治的EGFR基因检测突变阳性的肺腺癌脑转移患者。纳入标准:(1)经病理学检查证实均为肺腺癌并且EGFR基因检测突变阳性(19外显子缺失突变或21外显子点突变);(2)脑转移经颅脑强化MRI或CT检查确诊;(3)患者生存期≥3个月;(4)临床资料及随访资料完整。排除标准:(1)脑转移发生前应用EGFR-TKI靶向药物;(2)存在天然耐药基因突变;(3)合并其他恶性肿瘤病史。本研究经河北医科大学第四医院医学伦理委员会审查通过(2021KS004)。
1.2 治疗方法 (1)肺癌原发灶治疗包括手术、放疗、化疗、靶向药物,化疗采取含铂类双药联合化疗方案,胸部放疗包括肺原发灶及转移淋巴结照射,放疗剂量为50~60 Gy/25~30次。(2)脑转移治疗包括全脑放疗联合或不联合靶向药物治疗以及单纯靶向药物治疗,放疗包括全脑照射(剂量30 Gy/10次或40 Gy/20次),或全脑放疗联合局部转移灶加量照射(加量10~20 Gy/5~10次)。靶向药物包括口服吉非替尼250 mg、1次/d,或厄罗替尼150 mg、1次/d,或盐酸埃克替尼125 mg、3次/d。
1.3 观察指标
1.3.1 临床资料 收集并整理EGFR基因突变阳性肺腺癌脑转移患者的临床资料,包括年龄、性别、吸烟状况、卡氏评分、颅外控制情况、颅外转移器官数目、脑转移数目、脑转移症状、脑转移时间、脑转移治疗方案、肺原发灶治疗情况及Lung-molGPA。
1.3.2 随访指标 全脑放疗结束4周或口服靶向药物4周评价颅内疗效并开始进行随访,随访方式包括门诊复查和电话随访,随访截止时间为末次随访日期2019-12-31。采用颅脑强化MRI或CT检查进行疗效评价。以治疗后颅内再进展或死亡为终点事件。脑转移后生存时间(overall survival-brain metastases,OS-BM)指从脑转移诊断时开始计算至末次随访或死亡的时间。颅内无进展时间(intracranial progression-free survival,iPFS)指从脑转移治疗(放疗或靶向药物治疗)开始计算至颅内病灶出现未控、进展、复发或新发病灶的时间。颅内控制时间指从脑转移治疗时开始计算至末次随访或治疗后首次颅内出现进展的时间。
1.4 统计学方法 采用SPSS 22.0软件进行统计学分析。计数资料以相对数表示,组间比较采用χ2检验;计量资料以(±s)表示,两组间比较采用成组t检验。采用Kaplan-Meier法绘制生存曲线,生存曲线比较采用Log-rank检验;截尾数据(删失数据)包括末次随访时生存患者、中途失访患者、死于其他原因患者。治疗后颅内失败相关的影响因素分析及亚组分析采用多因素Logistic回归模型。以P<0.05为差异有统计学意义。
2 结果
2.1 临床资料比较 共纳入EGFR基因突变阳性肺腺癌脑转移患者282例,末次随访日期为2019-12-31,随访时间为3.0~94.8个月,中位随访时间为28.4个月,末次随访时生存数据完整患者 70 例,随访中途失访患者 13 例,其他原因或死因不详 5 例。282例患者1年、2年、3年的生存率分别为75.3%、44.9%、28.5%,中 位 OS-BM 为 45个 月〔95%CI(37.9,52.1)〕;1年、2年、3年的颅内无进展生存率分别为80.4%、56.9%、38.4%,中位iPFS为24个月〔95%CI(20.3,27.7)〕,见图1。至末次随访日期时,51.1%(144/282)的患者未发生颅内失败(未发生颅内失败组),48.9%(138/282)的患者发生颅内失败(发生颅内失败组)。脑转移治疗后发生颅内失败组患者的脑转移症状、脑转移治疗方式、Lung-molGPA与未发生颅内失败组比较,差异均有统计学意义(P<0.05);发生颅内失败组患者的年龄、性别、吸烟情况、卡氏评分、颅外控制情况、颅外转移器官数目、脑转移数目、脑转移时间、肺原发灶治疗方式与未发生颅内失败组比较,差异均无统计学意义(P>0.05),见表1。
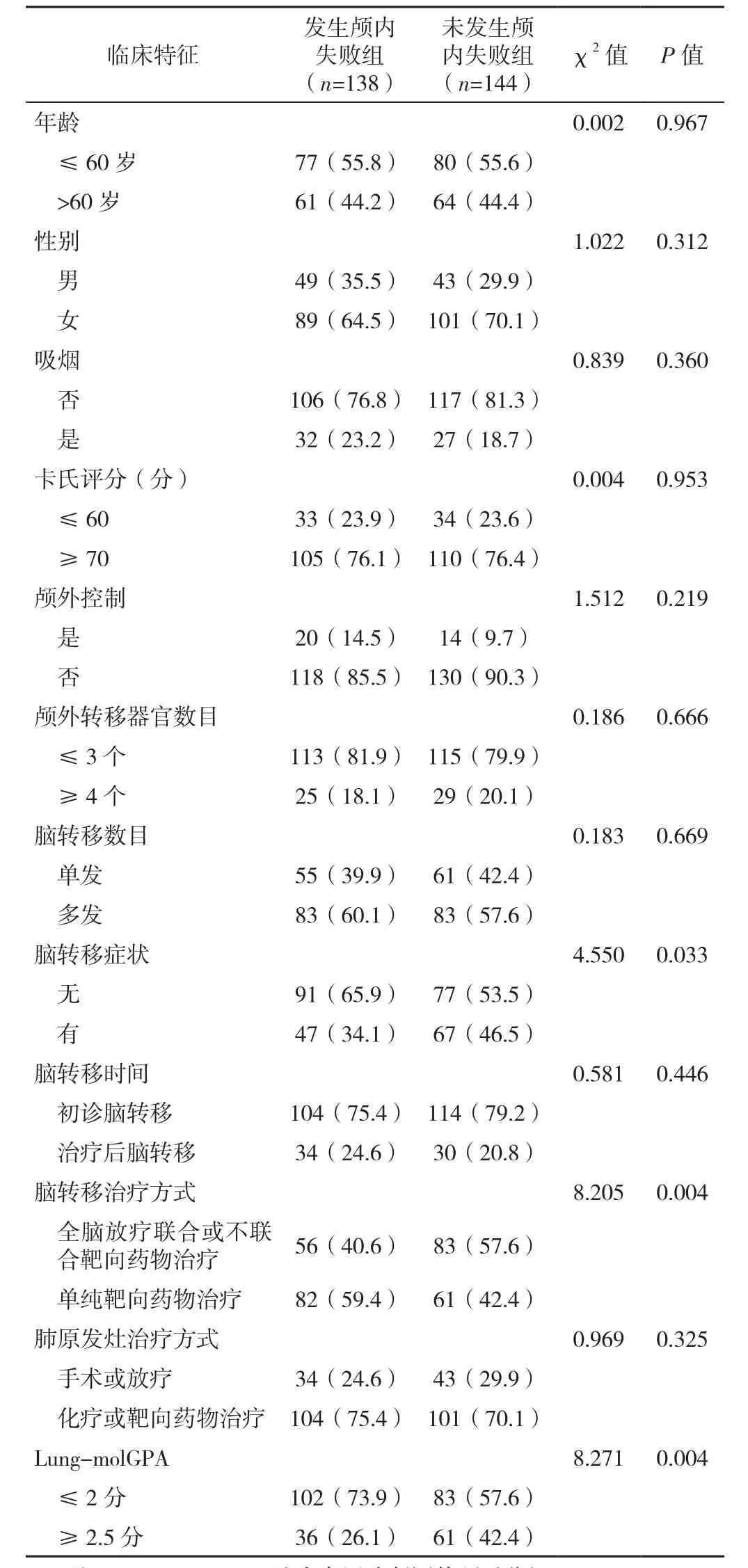
表1 EGFR基因突变阳性肺腺癌脑转移治疗后发生颅内失败组与未发生颅内失败组的临床资料比较〔n(%)〕Table 1 Baseline characteristics of developing intracranial failure or not in patients with lung adenocarcinoma harboring epidermal growth factor receptor mutation and brain metastases
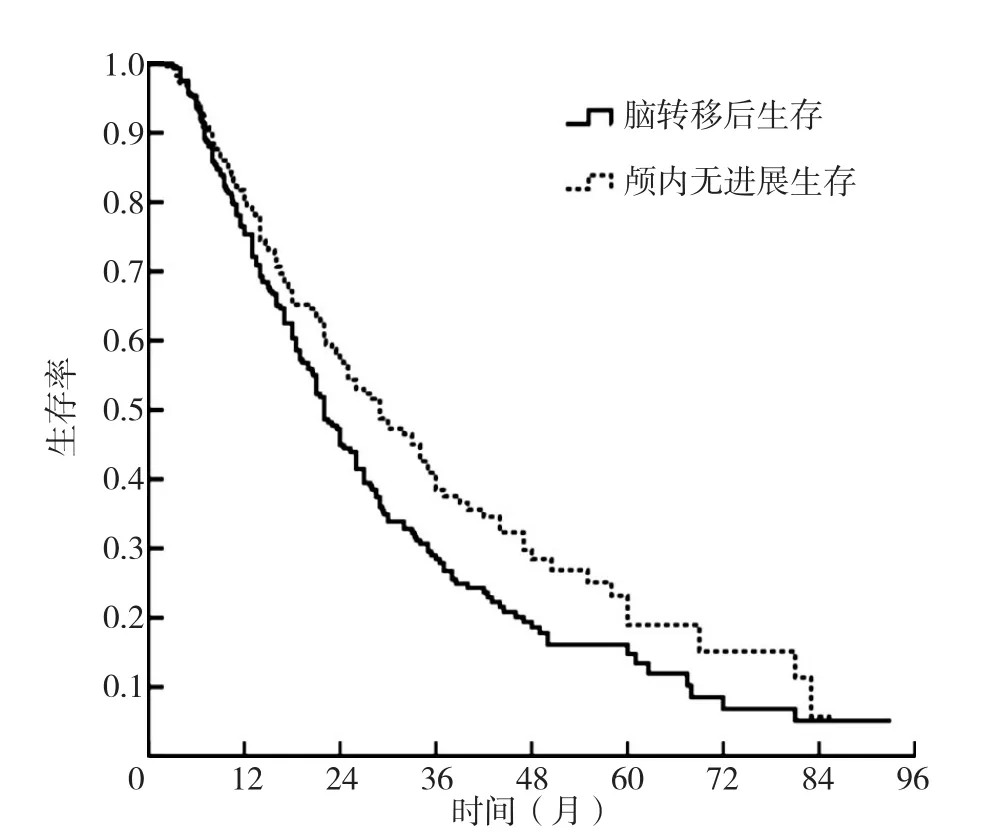
图1 EGFR基因突变阳性肺腺癌脑转移患者的脑转移后生存曲线和颅内无进展生存曲线Figure 1 Kaplan-Meier analysis of OS-BM and iPFS in patients with lung adenocarcinoma harboring epidermal growth factor receptor mutation and brain metastases
2.2 脑转移治疗后发生颅内失败影响因素的多因素Logistic回归分析 以是否发生颅内失败(赋值:0=否,1=是)为因变量,以年龄、性别、吸烟、卡氏评分、颅外控制、颅外转移器官数目、脑转移数目、脑转移症状、脑转移时间、脑转移治疗方式、肺原发灶治疗方式、Lung-molGPA为自变量,赋值见表2。经多因素Logistic回归分析,结果显示,脑转移治疗方式是脑转移治疗后发生颅内失败的影响因素(P<0.05),见表3。

表2 EGFR基因突变阳性肺腺癌脑转移治疗后发生颅内失败的影响因素多因素Logistic回归分析赋值表Table 2 Value assignment for associated variables of intracranial failure in multivariate Logistic regression analysis for patients with brain metastasis from lung adenocarcinoma harboring epidermal growth factor receptor mutation with treatment of brain metastases
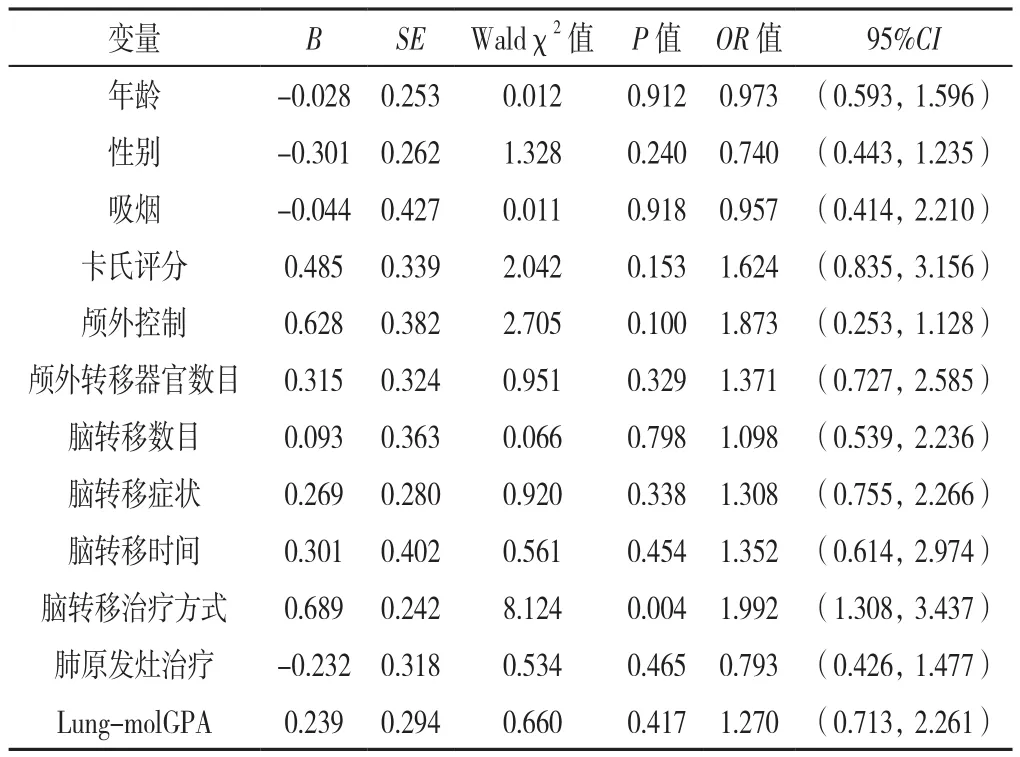
表3 EGFR基因突变阳性肺腺癌脑转移治疗后发生颅内失败影响因素的多因素Logistic回归分析Table 3 Multivariate Logistic regression analysis of factors possibly associated with intracranial failure in patients with brain metastasis from lung adenocarcinoma harboring epidermal growth factor receptor mutation with treatment of brain metastases
2.3 脑转移患者不同治疗方式的生存曲线分析 全脑放疗联合或不联合靶向药物治疗患者1年、2年、3年颅内无进展生存率分别为82.8%、65.7%、51.6%,中位颅内控制时间为37.0个月〔95%CI(24.3,49.7)〕;单纯靶向药物治疗患者1年、2年、3年颅内无进展生存率分别为78.4%、49.4%、26.7%,中位颅内控制时间为24.0个月〔95%CI(19.7,28.3)〕;全脑放疗联合或不联合靶向药物治疗患者颅内无进展生存率与单纯靶向药物治疗患者比较,差异有统计学意义(χ2=10.769,P=0.001),见图2。
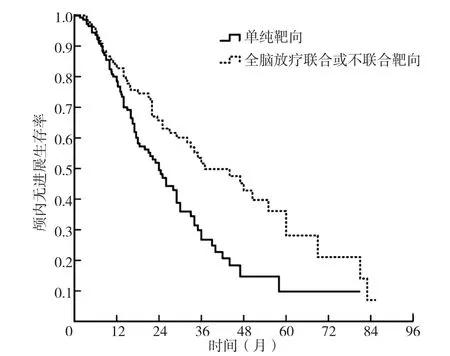
图2 全脑放疗联合或不联合靶向药物治疗与单纯靶向药物治疗患者的颅内无进展生存曲线Figure 2 Kaplan-Meier analysis of iPFS in patients with brain metastasis from lung adenocarcinoma harboring epidermal growth factor receptor mutation who received WBRT+/-TKIs compared with those received TKIs alone
2.4 颅内失败患者情况分析 颅内失败时间为1.3~81.5个月,中位颅内失败时间为10.0个月。6个月、1年、2年颅内失败发生率分别为31.2%(43/138)、58.7%(81/138)、87.0%(120/138)。138例颅内失败患者中复发和/或新发100例、脑膜进展34例、颅内未控4例。2.5 脑转移患者颅内失败不同时间的生存曲线分析以中位颅内失败时间10.0个月为界限,分为早失败组(颅内失败时间≤10.0个月)71例和晚失败组(颅内失败时间>10.0个月)67例。早失败组患者1年、2年、3年生存率分别为48.1%、15.6%、5.9%,中位OS-BM为11.5个月〔95%CI(9.4,13.6)〕;晚失败组患者1年、2年、3年生存率分别为98.5%、63.6%、42.1%,中 位 OS-BM 为 32.0个 月〔95%CI(26.5,37.5)〕;早失败组生存率与晚失败组比较,差异有统计学意义(χ2=51.888,P<0.001),见图3。
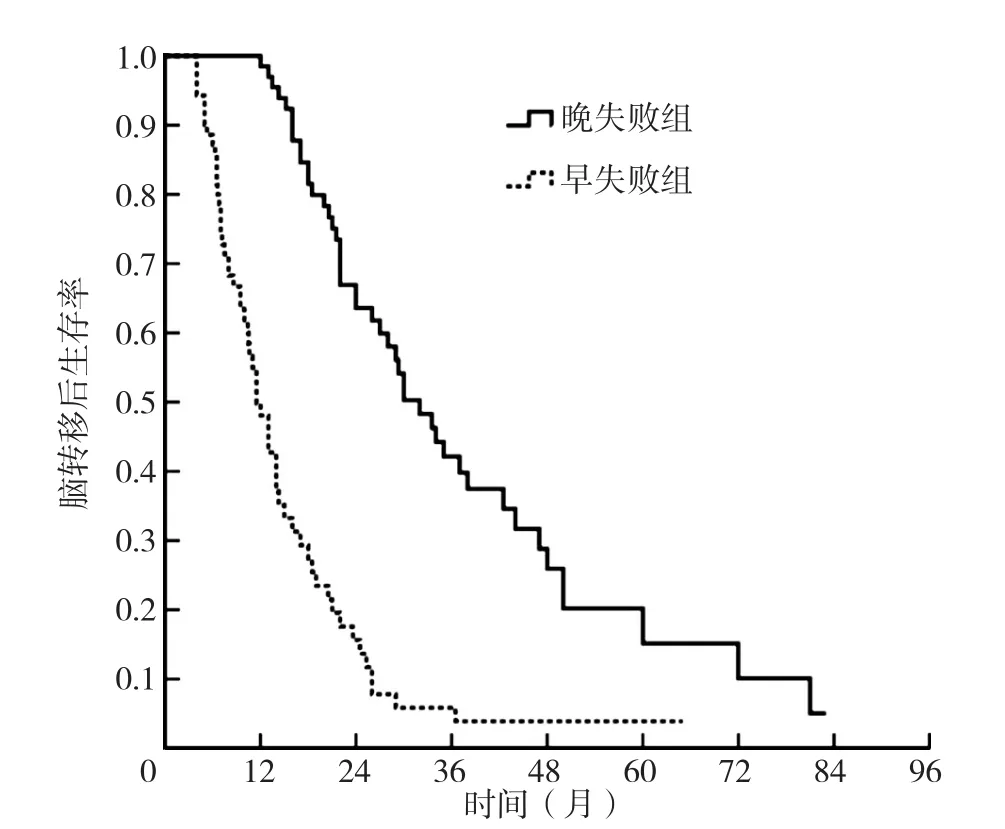
图3 治疗后颅内早失败和晚失败患者的脑转移后生存曲线Figure 3 Kaplan-Meier analysis of OS-BM in patients with brain metastasis from lung adenocarcinoma harboring epidermal growth factor receptor mutation with early or late intracranial failure
2.6 脑转移治疗后发生颅内早失败影响因素的多因素Logistic回归分析 以颅内失败不同时间(赋值:0=晚失败,1=早失败)为因变量,以年龄、性别、吸烟、卡氏评分、颅外控制、颅外转移器官数目、脑转移数目、脑转移症状、脑转移时间、脑转移治疗方式、肺原发灶治疗方式、Lung-molGPA为自变量,赋值情况与表2相同。经多因素Logistic回归分析,结果显示,颅外转移器官数目是脑转移治疗后颅内早失败的影响因素(P<0.05),见表4。
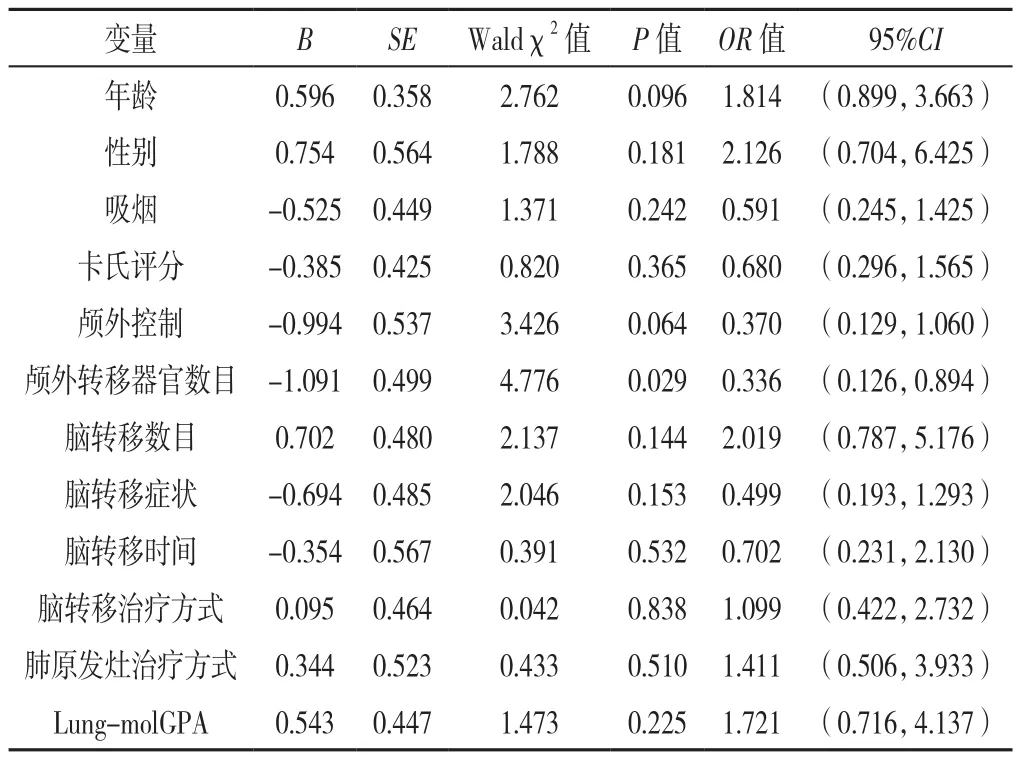
表4 EGFR基因突变阳性肺腺癌脑转移治疗后发生颅内早失败影响因素的多因素Logistic回归分析Table 4 Multivariate Logistic regression analysis of factors potentially associated with early intracranial failure(the time to intracranial failure≤ 10 months)in patients with brain metastasis from lung adenocarcinoma harboring epidermal growth factor receptor mutation
2.7 脑转移患者不同颅外转移器官数目的生存曲线分析 颅外转移器官数目≤3个患者1年、2年、3年颅内无进展生存率分别为66.7%、33.3%、14.0%,中位颅内控制时间为16.5个月〔95%CI(13.9,19.1)〕;颅外转移器官数目≥4个患者1年、2年、3年颅内无进展生存率分别为50.0%、16.7%、4.2%,中位颅内控制时间为11.0个月〔95%CI(7.0,15.0)〕;颅外转移器官数目≥4个患者颅内无进展生存率与颅外转移器官数目≤3个患者比较,差异有统计学意义(χ2=4.993,P=0.025),见图4。
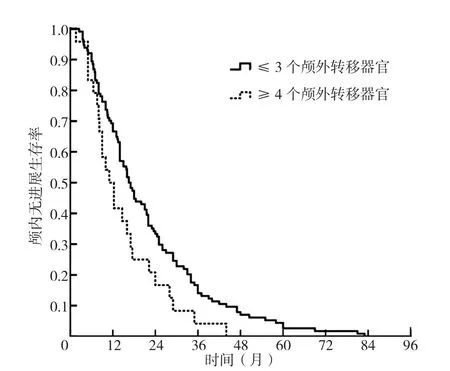
图4 颅外转移器官数目≤3个和≥4个患者的颅内无进展生存曲线Figure 4 Kaplan-Meier analysis of iPFS in patients with brain metastasis from lung adenocarcinoma harboring epidermal growth factor receptor mutation with ≥ 4 or ≤ 3 involved extracranial organs
3 讨论
EGFR基因突变阳性肺腺癌患者发生脑转移概率高[6-8]。发生脑转移后神经系统症状可能更多,生存质量可能更差,脑部作为转移的高危器官,在靶向药物时代给予合适的治疗能够获得比较好的疗效,因此这类患者的治疗受到越来越多的关注,但是目前没有标准的治疗模式。本研究入组的282例EGFR基因突变阳性肺腺癌脑转移患者既往未曾应用过靶向药物治疗,这些患者经过脑转移治疗包括靶向药物治疗以及全脑放疗联合或不联合靶向药物治疗,其3年生存率为28.5%,3年颅内无进展生存率为38.4%,与既往研究结果相类似[9,11-13,16,18-23]。本研究结果显示,30%的患者半年内出现治疗后颅内失败,近60%的患者1年内出现颅内失败,近90%的患者2年内出现颅内失败。哪些临床或病理因素与治疗后颅内失败相关?本研究经多因素Logistic回归分析显示,脑转移治疗方式是脑转移治疗后发生颅内失败的影响因素,单纯靶向药物治疗的脑转移患者发生颅内失败风险是全脑放疗联合或不联合靶向药物治疗患者的2倍。全脑放疗联合或不联合靶向药物治疗患者3年颅内无进展生存率为51.6%,中位颅内控制时间37个月,单纯靶向药物治疗患者3年颅内无进展生存率为26.7%,中位颅内控制时间24个月,两组比较差异有统计学意义(P=0.001)。本研究结果提示,全脑放疗联合或不联合靶向药物治疗较单纯靶向药物治疗可以延缓脑转移患者颅内失败时间,并降低约50%的颅内失败风险。
全脑放疗作为脑转移的局部治疗方式,对于EGFR基因突变阳性肺腺癌患者是否还有必要?既往研究显示,靶向药物治疗联合全脑放疗较单纯靶向药物治疗患者的颅内控制率高[21]。多个研究报道,全脑放疗仍是治疗脑转移灶的重要局部治疗手段。CHEN等[9]报道加入全脑放疗是颅内局部控制的独立预后因素(P=0.004)。HE等[11]报道全脑放疗加靶向药物治疗EGFR突变非小细胞肺癌脑转移患者的颅内进展发生率为76.8%,单独靶向药物治疗颅内进展发生率为89.6%,两种治疗方式的中位颅内控制时间为17.7个月和11.0个月(P=0.015),多因素Logistic回归分析显示全脑放疗联合靶向药物治疗是颅内控制的独立预后因素(P=0.004)。YU等[14]报道颅内接受局部治疗(全脑放疗、立体定向放射外科治疗、外科手术)是生存的独立预后因素(P=0.005)。CHEN等[19]对141例EGFR基因突变阳性肺腺癌脑转移患者的研究结果显示,有无全脑放疗是影响脑转移后生存的独立预后因素(P<0.001)。ZHU等[22]报道显示,颅内放疗是影响颅内控制(P=0.017)和总生存时间(P=0.015)的独立预后因素。苏鹏程等[23]对43例EGFR基因突变阳性非小细胞肺癌脑转移患者研究发现,全脑放疗加靶向药物治疗是影响颅内控制的独立预后因素之一。本研究结果提示,EGFR基因突变阳性肺腺癌脑转移患者给予全脑放疗联合或不联合靶向药物治疗方式有利于延长患者颅内控制时间甚至可能延长生存时间,且采用全脑放疗的方式仍具有价值。
本研究还对138例脑转移治疗后发生颅内失败的患者进行亚组分析,以中位颅内失败时间10.0个月为界限分为早失败组和晚失败组,发生颅内失败时间早晚不同的患者生存率有明显差异,多因素Logistic回归分析显示颅外转移器官数目与颅内早失败相关,颅外转移器官数目越多,发生颅内失败越早,颅外转移器官数目≥4个的患者3年颅内无进展生存率为4.2%,低于≤3个患者的14.0%(P=0.025)。其他因素未得出阳性结果。颅外转移器官数目越多,患者肿瘤负荷越大,常提示病情进展快,预后差。多项研究显示,颅外转移器官或颅外转移器官数目是影响局部控制和生存时间的独立预后因素[14,16,21,24]。YU 等[14]对真实世界中 261 例EGFR基因突变阳性肺腺癌脑转移患者预后情况研究发现,有无颅外器官转移(P=0.001)是总生存时间的独立预后因素。SAIDA等[16]研究显示,颅外转移是生存时间的独立预后因素(P=0.004 4)。ZHU等[22]的一项包含133例患者的单中心研究结果显示,颅外转移是影响颅内局部控制和总生存的预后因素。MAGNUSON等[24]2017年在JCO上发表的一项多中心回顾性研究,分析351例EGFR突变的非小细胞肺癌脑转移患者的生存预后,发现颅外器官转移是颅内局部控制(P=0.009)和总生存时间(P<0.001)的独立预后因素。结合本研究结果,提示颅外转移器官数目对患者生存时间具有重要意义,也进一步提示,在靶向药物治疗有效的前提下联合局部治疗方式来控制可见肿瘤病灶可能效果更优。
综上所述,EGFR基因突变阳性肺腺癌脑转移患者经过脑转移治疗后部分会发生颅内失败,颅内失败影响因素为脑转移治疗方式,全脑放疗联合或不联合靶向药物治疗较单纯靶向药物治疗可以延缓颅内失败时间,降低约50%的颅内失败风险。亚组分析显示,颅外转移器官数目与脑转移治疗后颅内较早发生失败相关,颅外转移器官数目≥4个的患者发生颅内失败会更早。本研究为回顾性研究,治疗方面可能存在选择偏移,随访时间短,需要大样本前瞻性研究进一步分析。下一步课题组拟进行立体定向外科放射治疗联合靶向药物治疗,全脑放疗联合免疫治疗以及脑转移患者脑脊液基因测序等方面的研究。
作者贡献:周志国进行文章的构思与设计,论文的修订,对文章整体负责,监督管理;乔学英进行研究的实施与可行性分析,英文的修订;宋玉芝、甄婵军、白文文进行数据收集;宋玉芝进行数据整理,统计学处理,撰写论文;宋玉芝、周志国进行结果的分析与解释;李博、周志国负责文章的质量控制及审校。
本文无利益冲突。
