预后营养指数在胃癌肺转移患者预后中的意义及列线图预测模型的建立研究
2021-09-16迪丽奴尔艾尔肯张华阿布都沙塔尔卡地尔卡丽比奴尔艾尔肯玛依努尔艾力
迪丽奴尔·艾尔肯,张华,阿布都沙塔尔·卡地尔,卡丽比奴尔·艾尔肯,玛依努尔·艾力*
本研究价值:
本研究将预后营养指数(PNI)引入胃癌肺转移患者的预后研究中,通过构建回归模型,证实了PNI对于胃癌肺转移患者预后的预测价值。此外,本研究将回归分析结果绘制成列线图,将复杂的回归方程转变为简单的可视化图形,使预测模型的预测结果更具可读性,对于临床医务工作者具有较高的实际应用价值。
胃癌是全球范围内常见的消化道恶性肿瘤之一,严重危害居民的生命和健康[1]。近年来,全球范围内胃癌的总体发病率仍处于较高水平。根据世界卫生组织统计,东亚地区是全球胃癌的“重灾区”,其中我国胃癌发病率最高[2-3]。2018年国家癌症中心的数据表明,我国胃癌的发病率和死亡率分别位居我国恶性肿瘤的第二位和第三位[1,4]。胃癌肺转移是指胃癌细胞通过血道转移等方式转移至肺部[5],早期无特异性临床表现,预后差,生存率低[6-7],严重影响我国居民健康和社会经济的发展。研究显示,肿瘤患者的预后与营养状态具有较高的相关性,营养不良可能导致肿瘤患者的免疫功能下降,抗感染能力降低,进而影响患者的预后[8-10]。近年来,不断有研究者将预后营养指数(PNI)纳入肿瘤的预后研究中[10-12],并通过PNI评价患者的营养状态及预测患者的远期预后。
本研究通过收集胃癌肺转移患者的临床、病理及随访资料,分析PNI与胃癌肺转移患者的临床病理特征和预后之间的关系,探讨了PNI在胃癌肺转移患者预后中的意义,同时构建了预测胃癌肺转移患者预后的列线图预测模型,建立了相对系统、完整的评价体系,有助于预测胃癌肺转移患者的预后。
1 对象与方法
1.1 研究对象 选取2010年7月至2018年7月新疆医科大学第一附属医院诊治的245例胃癌肺转移患者,其中男190例,女55例;年龄53~80岁,平均年龄(63.2±7.1)岁。纳入标准:(1)经术前病理检查确诊为胃癌;(2)经腹部CT、磁共振成像等影像学检查确诊为肺转移;(3)病历资料齐全;(4)随访资料齐全,有明确的终点状态和随访起始、终止时间。排除标准:(1)合并其他部位原发肿瘤;(2)随访过程中因非肿瘤因素死亡;(3)其他脏器功能衰竭;(4)患者未签署知情同意书。
1.2 研究方法 回顾性收集患者的住院病历及检测报告等以分析其临床病理特征,包括年龄、性别、原发灶、组织学分级、T分期、N分期、肺转移类型、肺转移时间、化疗情况、肿瘤直径、血清癌胚抗原(CEA)水平、血清CA199水平、胸腔积液发生情况、脉管癌栓发生情况、原发灶手术情况和患者术前1周外周血淋巴细胞总数、血清白蛋白水平等。PNI=血清白蛋白水平(g/L)+5×外周血淋巴细胞总数(×109/L)。
1.3 随访方式 所有患者的随访资料通过电话或门诊随访的方式完成收集,随访开始时间为发现胃癌肺转移时间,截止时间为2019年4月。确诊两年内每3个月复查1次,两年后每半年复查1次,总生存时间为发现胃癌肺转移至死亡或随访结束时间。随访结局事件为死亡。
1.4 统计学方法 采用SPSS 22.0软件和R软件4.0.0版本进行统计学分析,计量资料以(±s)表示;计数资料以相对数表示,两组间比较采用χ2检验。通过绘制受试者工作特征(ROC)曲线计算PNI的最佳截断值,采用Kaplan-Meier法计算患者累积生存率并绘制生存曲线,采用Log-rank检验比较高PNI值组和低PNI值组累积生存率。采用多因素Logistic回归分析探究PNI的影响因素,采用Cox回归模型进行单因素和多因素生存分析。采用R软件中“rms”包建立列线图预测模型。以P<0.05为差异有统计学意义。
2 结果
2.1 PNI预测胃癌肺转移患者生存结局的ROC曲线
以患者生存与否为结局变量,绘制PNI预测胃癌肺转移患者生存结局的ROC曲线,得到ROC曲线下面积为 0.691〔95%CI(0.607,0.776)〕,最佳截断值为46.1,Youden指数为0.395,灵敏度为71.7%,特异度为67.8%(图1)。故以46.1为PNI的分界值,将患者分为低PNI值组114例和高PNI值组131例。
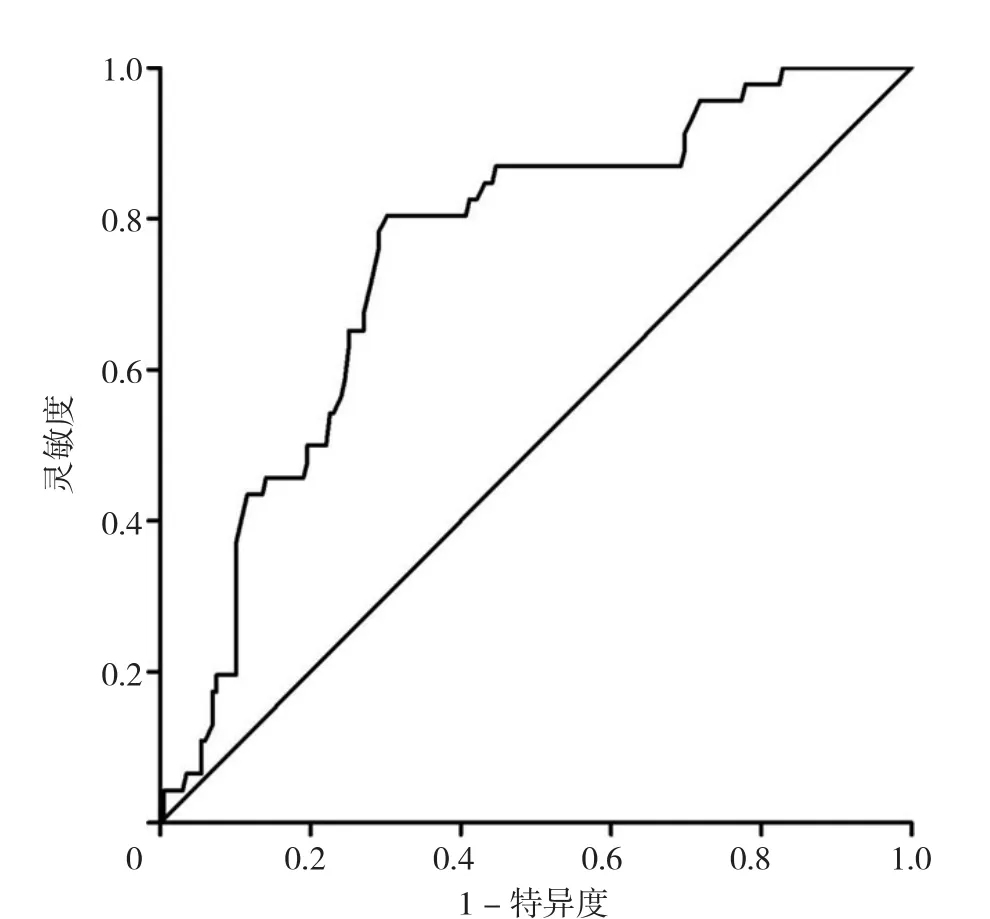
图1 PNI预测胃癌肺转移患者3年生存结局的ROC曲线Figure 1 ROC curve of PNI in predicting 3-year survival in gastric cancer patients with lung metastasis
2.2 两组患者临床病理特征比较 低PNI值组和高PNI值组患者性别、原发灶、组织学分级、肺转移类型、肺转移时间、化疗情况、血清CEA水平、血清CA199水平、胸腔积液发生情况、脉管癌栓发生情况、原发灶手术情况比较,差异无统计学意义(P>0.05);两组患者年龄、T分期、N分期、肿瘤直径比较,差异均有统计学意义(P<0.05),见表 1。

表1 低PNI值组与高PNI值组临床病理特征比较〔n(%)〕Table 1 Comparison of clinicopathological features between low and high PNI groups
2.3 胃癌肺转移患者PNI的影响因素分析 以PNI为因变量,以年龄、T分期、N分期、肿瘤直径为自变量(赋值见表2)进行多因素Logistic回归分析,结果显示,年龄>65岁、T分期高、N分期高、肿瘤直径>5 cm均为胃癌肺转移患者PNI<46.1的独立危险因素(P<0.05),见表3。

表2 胃癌肺转移患者PNI影响因素的多因素Logistic回归分析变量赋值表Table 2 Assignment for influencing factors of PNI in gastric cancer patients with lung metastasis analyzed using multivariate Logistic regression analysis

表3 胃癌肺转移患者PNI影响因素的多因素Logistic回归分析Table 3 Influencing factors of PNI in gastric cancer patients with lung metastasis analyzed using multivariate Logistic regression analysis
2.4 低PNI值组和高PNI值组累积生存率分析 胃癌肺转移患者1年、2年、3年生存率分别为33.3%、15.1%、4.3%。低PNI值组患者3年生存率为1.0%,高PNI值组患者3年生存率为11.6%,低PNI值组患者3年生存率低于高PNI值组,差异有统计学意义(χ2=10.843,P=0.001),见图2。

图2 两组患者的Kaplan-Meier生存曲线Figure 2 Kaplan-Meier curves of high and low PNI groups of gastric cancer patients with lung metastasis
2.5 胃癌肺转移患者预后的影响因素分析 以胃癌肺转移患者随访结局为因变量(赋值:死亡=1,存活或失访=0),以临床病理特征为自变量(赋值见表4)进行Cox回归模型分析,单因素分析结果显示,组织学分级、肺转移类型、肺转移时间、化疗、原发灶手术、PNI是胃癌肺转移患者预后的影响因素(P<0.05);多因素Cox回归模型分析结果显示,组织学分级、肺转移类型、化疗、原发灶手术、PNI是胃癌肺转移患者预后的独立影响因素(P<0.05),其中组织学分级为低、未分化和肺部双侧转移为危险因素,化疗、原发灶手术、PNI>46.1为保护因素,见表5。

表4 胃癌肺转移患者预后影响因素的Cox回归模型变量赋值表Table 4 Assignment for potential prognostic factors for gastric cancer patients with lung metastasis analyzed using Cox regression analysis
2.6 列线图预测模型对胃癌肺转移患者累积生存率的预测效果 通过绘制列线图展示胃癌肺转移患者累积生存率的预测效果,列线图纳入了多因素Cox回归模型中所有差异有统计学意义的影响因素,包括组织学分级、肺转移类型、化疗、原发灶手术、PNI,对胃癌肺转移患者1年、2年、3年生存率进行预测,一致性指数(C-index)为0.755,见图3。校正曲线均与理想曲线非常接近(图4),表明根据列线图预测模型得到的预测值能较好地代表实际值。

图3 列线图对胃癌肺转移患者1年、2年、3年生存率的预测结果Figure 3 Nomogram for predicting 1-year,2-year,and 3-year survival of gastric cancer patients with lung metastasis

图4 患者生存率校准曲线图Figure 4 Patient survival calibration curves
3 讨论
胃癌是我国主要癌症之一,在经济水平相对落后的地区其疾病负担尤为严重[13]。由于胃癌肺转移患者早期症状不明显,临床发现的病例多为中晚期,因此患者短期预后不容乐观。胃癌的预后与多种临床病理因素有关[14],近年来,随着对胃癌患者的预后研究深入,人们发现通过营养支持改善营养状态可以明显延长胃癌患者的生存时间。PNI作为评价患者营养状态的指标,越来越受到研究者的重视。研究表明,PNI在恶性肿瘤的预后评估中具有重要意义,且在多种恶性肿瘤中得到了证实[8-9,12,15]。本研究分析了PNI与胃癌肺转移患者临床病理特征和预后的关系,探讨了PNI在胃癌肺转移患者预后中的意义,并构建了预测胃癌肺转移患者预后的列线图预测模型,可帮助临床医生对胃癌肺转移患者的预后进行评估。
3.1 PNI临界值的计算 本研究绘制了PNI预测胃癌肺转移患者生存结局的ROC曲线,通过计算Youden指数得到PNI的最佳截断值,同时计算相应的灵敏度和特异度。通过得到的PNI截断值进行分组,分为低PNI值组(营养不良)和高PNI值组(营养正常)。既往大部分研究根据以往的经验将PNI=50作为分组标准,认为PNI<50提示患者出现营养不良,45~50为轻度营养不良,PNI值越低表示营养状态越差[16-17],缺乏科学研究的严谨性和客观性。本研究通过ROC曲线得到的最佳截断值为46.1,具有较高的临床意义。同时,PNI作为一种营养状态评估指标,可直接反映患者的营养状态,临床医生可通过PNI是否高于46.1来评估患者的营养状态,进而为营养不良的患者提供营养支持疗法。
3.2 PNI的影响因素分析 PNI由患者术前1周外周血淋巴细胞总数和血清白蛋白水平通过公式计算得出,因此PNI由这两个因素决定。国内外研究显示,PNI与胃癌患者多项临床病理特征具有较高的相关性,如患者年龄、胃癌分期、淋巴结转移等[12,18]。本研究通过多因素Logistic回归分析发现年龄>65岁、T分期高、N分期高、肿瘤直径>5 cm为胃癌肺转移患者PNI<46.1的独立危险因素。有研究提示PNI下降可能与胃癌患者术后并发症的发生也有密切关系[19],因此,临床上在重视胃癌患者营养状态的同时还应重视导致PNI<46.1的因素。
3.3 胃癌肺转移患者预后的影响因素分析 本研究结果显示,低PNI值组3年生存率为1.0%,高PNI值组3年生存率为11.6%,低PNI值组患者预后较差,其原因可能为PNI较低患者的营养状态较差,导致患者自身免疫力下降,进而使得感染发生率增加,患者生存时间缩短。此外,本研究多因素Cox回归模型分析结果显示PNI为胃癌肺转移患者预后的独立影响因素,与既往研究报道一致[20]。LEE等[21]研究发现,低PNI值组患者术后并发症的发生率明显高于高PNI值组,证实PNI下降与术后并发症的发生存在密切关联,这可能为低PNI值组患者预后较差的另一原因,但本研究没有进一步分析胃癌肺转移患者并发症的发生率,还需要进一步的研究来探讨和验证。
影响胃癌肺转移患者预后的因素较多,本研究证实组织学分级、肺转移类型、化疗、原发灶手术均为此类患者预后的独立影响因素,其中组织学分级为低、未分化为独立危险因素:低分化肿瘤恶性程度高,导致患者预后较差,未分化肿瘤恶性程度极高,生长快,转移率高,预后最差;肺部双侧转移为独立危险因素,与既往研究结论一致[7,22]:肺部双侧转移患者主要为中晚期患者,且肺部双侧转移患者病情严重,无法开展有效的手术治疗,导致肺部双侧转移患者的预后较差;化疗、原发灶手术为独立保护因素,其主要原因可能为临床上对于肺癌转移性患者采用的治疗方式主要为原发灶外科手术,而对于肺部双侧转移患者,首选的治疗方式为化疗,通过化疗可以有效缓解患者临床症状,延长患者生存时间。
3.4 列线图的应用价值 本研究根据Cox回归模型筛选的预后独立影响因素构建列线图,并通过列线图对胃癌肺转移患者的预后进行预测和评估。通过C-index和校准图评估列线图的准确性,证实列线图具有较高的预测价值。列线图提供了各个影响因素的具体分值,通过各个因素的分值相加最终推测结局的发生概率。同时,列线图将复杂的回归方程转变为简单的可视化图形,使预测模型的预测结果更具可读性。医务人员可以根据列线图更加快速、便捷地预测胃癌肺转移患者的预后,有利于提前做好预防工作,具有较高的临床应用价值。
3.5 本研究的优缺点 本研究样本量较小,构建的回归模型可能存在一定的偏倚,且未设置测试集对生存模型及列线图进行外部验证。因此,今后还需进一步收集样本进行更深入的研究。此外,本研究未将胃癌肺转移患者并发症纳入研究,今后还需进一步对此展开研究。
综上所述,PNI可以作为评估胃癌肺转移患者营养状态及预后的独立影响因素,且获取方便,适合在临床上推广应用。此外,列线图具有较高的临床应用价值,可以直观地进行胃癌肺转移患者的预后预测,帮助临床医生及时制定或调整合理的诊疗方案。
作者贡献:迪丽奴尔·艾尔肯进行文章的构思与研究的设计,研究的实施与可行性分析,数据收集,论文撰写,并对文章整体负责,监督管理;卡丽比奴尔·艾尔肯进行数据整理;阿布都沙塔尔·卡地尔进行统计学处理;玛依努尔·艾力进行结果的分析与解释、文章的质量控制及审校;迪丽奴尔·艾尔肯、张华进行论文的修订。
本文无利益冲突。
