108例铂类化疗药致药品不良反应报告分析
2021-09-16钱嘉,张雷,吴楠
钱 嘉,张 雷,吴 楠
(1.江苏省肿瘤医院/江苏省肿瘤防治研究所/南京医科大学附属肿瘤医院药学部,江苏 南京 210009; 2.昆山市中医医院药剂科,江苏 昆山 215300)
铂类药物是目前临床应用较广泛的化疗药。从1969年研究发现铂类配合物有抗肿瘤活性以来,铂类药物得到迅猛发展,被广泛用于各种恶性肿瘤的临床治疗中,如胃肠道、肺、头颈和妇科等恶性肿瘤的治疗,是全球销售额领先的十大抗恶性肿瘤药之一。目前,70%~80%的临床化疗或联合化疗方案中应用到铂类药物[1]。使用频率高导致其药品不良反应(adverse drug reaction,ADR)也增多。文献报道,在抗肿瘤药中,铂类药物致ADR病例数居第1位[2-3]。江苏省肿瘤医院(以下简称“我院”)为三级甲等肿瘤专科医院,铂类药物的用量很大。本研究对我院上报的铂类药物致ADR报告进行回顾性分析,以期为临床安全用药提供参考。
1 资料与方法
资料来源于2019年我院上报至国家ADR监测中心的关于铂类药物ADR的有效报告。收集患者的年龄、性别、原患疾病、药物使用情况、ADR发生时间、ADR累及器官和(或)系统及临床表现、转归等信息,采用Excel软件进行统计分析。根据国家ADR监测中心《WHO药品不良反应术语集》对ADR累及的器官和(或)系统进行分类汇总。
2 结果
2.1 发生ADR患者的基本信息
108例铂类药物致ADR报告中,男性患者52例(占48.15%),女性患者56例(占51.85%);患者年龄22~73岁,不同年龄段发生ADR患者的性别分布见表1。原发病方面,肺癌20例,结直肠癌19例,食道癌17例,胃癌11例,卵巢癌7例,宫颈癌7例,乳腺癌5例,鼻咽癌和淋巴癌各3例,肝癌、胰腺癌、胆囊癌、喉癌、牙龈癌、子宫内膜癌和腹部肿瘤各2例, 胸腺癌、肛管癌各1例。首次使用含铂方案化疗发生ADR的患者有15例,仅占13.89%;多次化疗发生ADR的患者有93例,占86.11%;化疗周期在1~4个周期内的患者有47例,占43.52%;化疗周期>4个周期的患者有61例,占56.48%。提示铂类药物致ADR的发生时间无明显规律,既可以发生于首次化疗,又可以发生于化疗中的任何一个周期。

表1 不同年龄段发生ADR患者的性别分布Tab 1 Distribution of gender and age in patients with ADR
2.2 ADR涉及铂类药物种类及联合用药情况
108例ADR报告涉及5种铂类药物,主要为奥沙利铂(34例,占31.48%)和奈达铂(30例,占27.78%),见表2。81例患者(占75.00%)存在联合用药,其中二联用药69例,三联用药11例,四联用药1例。

表2 ADR涉及铂类药物种类及联合用药情况Tab 2 Categories of platinum chemotherapy drugs and drug combination that induced ADR
2.3 铂类药物各品种致ADR的发生时间分布
108例铂类药物致ADR报告中,用药后>24 h发生的ADR病例数所占比例最高,多为铂类药物引起的骨髓抑制,主要涉及奈达铂;用药后24 h内发生的ADR以过敏反应居多,其中用药后30 min内发生的ADR主要涉及奥沙利铂,见表3。

表3 铂类药物各品种致ADR的发生时间分布[例(%)]Tab 3 Distribution of occurrence time of ADR induced by platinum chemotherapy drugs[cases(%)]
2.4 铂类药物致ADR累及器官和(或)系统及临床表现
铂类药物致ADR累及血液系统最为常见,其次为呼吸系统、皮肤及神经系统,见表4。血液系统的ADR表现为白细胞、中性粒细胞、血小板和血红蛋白减少,其中血小板减少最常见。按照世界卫生组织抗肿瘤药急性及亚急性毒性反应分度标准,铂类药物引起的Ⅱ级骨髓抑制最常见;其中,奈达铂所致骨髓抑制、Ⅲ—Ⅳ级骨髓抑制病例数均最多,见表5。

表4 铂类药物致ADR累及器官和(或)系统及临床表现Tab 4 Involvement of organs and(or) system and clinical manifestations in ADR induced by platinum chemotherapy drugs

表5 铂类药物各品种致骨髓抑制情况Tab 5 Bone marrow suppression induced by various platinum chemotherapy drugs
2.5 铂类药物致ADR的类型分布与转归
108例铂类药物致ADR报告中,严重的ADR有39例,一般的ADR有69例,见表6。97例患者经过及时有效的救治,ADR得以好转;有10例患者出院继续治疗;仅1例患者治疗后白细胞计数仍低于正常值。
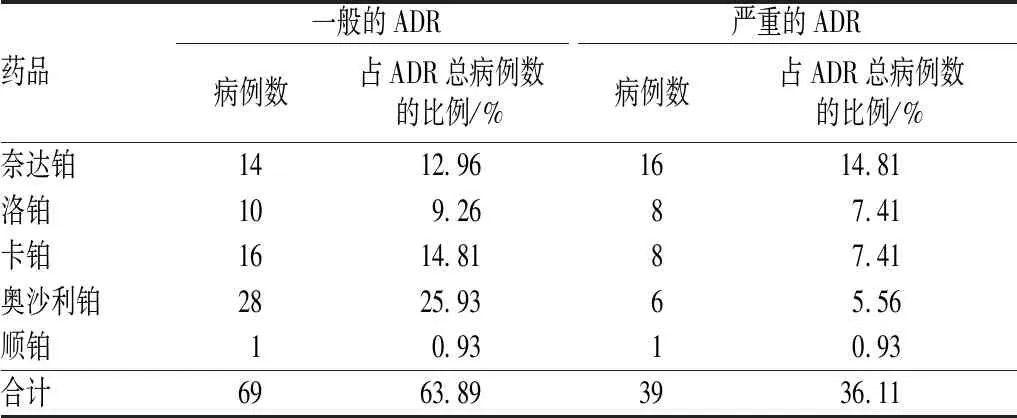
表6 铂类药物各品种致ADR的类型分布Tab 6 Distribution of types of ADR induced by platinum chemotherapy drugs
3 讨论
3.1 铂类药物致ADR与患者性别、年龄的关系
本研究结果显示,使用铂类药物发生ADR的患者中,男性患者与女性患者的比例为1∶1.08,女性患者略多于男性患者;>60岁患者所占比例最高。文献报道,45~74岁为肿瘤高发年龄段[4]。而且,老年人肝肾代谢功能减退,药物代谢发生改变,基础病较多,自身免疫功能降低,营养状况不佳,对药物的耐受能力差,是抗肿瘤药致ADR的高发人群[5]。上述因素均导致中老年患者的ADR发生率较高。提示在临床用药中,应重点监测中老年患者的用药情况,了解其身体状况、既往病史,合理用药。
3.2 铂类药物致ADR与原发病、联合用药的关系
使用铂类药物发生ADR患者的原发病主要为肺癌和消化道肿瘤,这与铂类药物的临床抗肿瘤谱吻合。奥沙利铂和奈达铂发生ADR最常见,与两者在我院临床使用量大有关。奥沙利铂联合氟尿嘧啶类药物是治疗消化道肿瘤的一线方案;奈达铂联合培美曲塞、依托泊苷、紫杉醇类、替吉奥和伊立替康等方案被广泛用于肺癌、头颈癌、妇科肿瘤和消化道肿瘤的治疗。铂类药物与紫杉醇、氟尿嘧啶类药物联合应用发生ADR的病例数较多。化疗中,联合用药是增加ADR发生风险的重要因素之一,而联合用药方案中的抗肿瘤植物药、抗代谢药是抗肿瘤药中除金属铂类外较易出现ADR的药物[6];氟尿嘧啶还可致心脏毒性,发生心律失常、心肌梗死和心源性猝死等;卡培他滨也可引起心脏毒性;紫杉醇和多西他赛均可以引发过敏反应,多为Ⅰ型速发型变态反应,常发生在开始滴注的几分钟内,药品说明书均提示可致部分病例发生严重过敏反应[7];紫杉醇类药物还可致神经毒性和皮肤毒性[8]。联合用药提高了抗肿瘤疗效,延缓了耐药性,但抗肿瘤药多为细胞毒性药物,在增强疗效的同时也增加了ADR。但也有观点认为,以铂类药物为基础的二联用药方案不仅不会增加化疗相关毒副作用,还可能增强化疗的敏感性[9]。
3.3 铂类药物致ADR累及器官和(或)系统及临床表现
铂类药物致ADR主要累及血液系统,表现为白细胞、中性粒细胞、血小板和血红蛋白减少。骨髓抑制是恶性肿瘤患者化疗过程中常见且严重的不良反应,多疗程化疗会增加药物的累积毒性,进而增加骨髓抑制的发生风险[10]。骨髓抑制是铂类药物的剂量限制性毒性。通过及时有效的处理,轻度骨髓抑制对患者自身病情及后续化疗往往影响不大[11]。发生严重的骨髓抑制时,需要患者减量甚至停药,从而影响化疗结果,降低患者生活质量[12]。粒细胞缺乏继发的感染发热、血小板减少引起的黏膜甚至内脏出血也可能直接威胁患者生命。本研究结果显示,奈达铂致骨髓抑制的发生率高于其他铂类药物,与相关文献报道一致[13]。有研究结果显示,患者使用奈达铂方案化疗4个周期后的贫血发生率高达70.16%,连续化疗可使患者预后不良的情况加重[14]。提示临床上使用含铂类药物化疗方案,尤其是含奈达铂方案时,应充分考虑其骨髓抑制的严重不良反应,用药前充分评估患者的整体情况,制定合理的化疗方案,在达到最大化疗效应的同时,最大限度地降低毒副作用。化疗后24~48 h内是监测血细胞计数并预防血细胞减少的最佳时期,预防性使用重组人粒细胞集落刺激因子可有效降低白细胞减少和中性粒细胞减少的发生率[15-16]。
奥沙利铂的神经系统反应和过敏反应发生率最高。神经毒性是奥沙利铂的剂量限制性毒性,往往会导致治疗剂量减少、化疗周期推迟,甚至终止治疗,从而影响化疗效果,耽误病情,因此,早期准确评估化疗患者周围神经损伤程度极为重要[17]。神经毒性主要包括急性和慢性2种类型,急性毒性主要诱因为冷刺激,慢性毒性为多周期用药后出现的蓄积毒性,呈剂量依赖性[18]。褚晓晖等[19]的研究中,62.8%的患者使用奥沙利铂后出现周围神经毒性反应。使用奥沙利铂时,应重点观察患者的周围神经毒性反应,输注钙镁合剂抗毒;嘱咐患者避冷,注意保暖,加强对神经毒性相关症状体征的监测。我院使用奥沙利铂发生的过敏反应表现为全身皮肤瘙痒、面色红、恶心呕吐、呼吸困难、胸闷咳嗽有窒息感和寒战高热等,多为Ⅰ型速发型超敏反应。奥沙利铂引起过敏的机制尚不清楚,可发生在化疗周期的任何一个过程。李小倩等[20]的研究结果显示,在无预处理的情况下,奥沙利铂致过敏反应的发生率为10.3%~24.2%,而使用奥沙利铂前常规予以小剂量地塞米松预处理,过敏反应发生率可降低至7.9%。但抗过敏预防用药不能阻止所有患者发生过敏反应,部分患者仍可能发生严重不良反应。提示用药前需仔细询问患者过敏史,必要时减慢滴注速度,延长输液时间,用药后30 min内密切观察,加强监护,备好抢救药物和设备[21]。
有文献报道,铂类药物的ADR以胃肠道反应为主,其次为骨髓抑制[22]。但在我院上报的铂类药物致ADR报告中,胃肠道反应(恶心呕吐)并不多。分析其原因,一方面,由于胃肠道不良反应比较轻微、常见,带来的危害较小,可能临床没有进行上报;另一方面,使用铂类药物化疗前后会采取相应的措施,如给予5-羟色胺受体抑制剂和神经激肽受体阻断剂,以减轻胃肠道不良反应。
总之,ADR是由药物本身的毒性和患者体质决定的,不能完全消除。回顾分析铂类药物在临床应用过程中的ADR,重视化疗副作用评估,采取有效的监测及防治措施,提高快速预警能力,才能保证整个化疗过程顺利进行[23]。本研究中,铂类药物的ADR以骨髓抑制最为常见,年龄>60岁、联合用药可能增加铂类药物致ADR的发生率。不同铂类药物引起的ADR存在差异,如奈达铂引起血液系统反应较为多见,而奥沙利铂引起神经系统反应和过敏反应更为常见。此外,文献报道,合并高血压、糖尿病等患者以及化疗前血红蛋白异常的患者为骨髓抑制高危人群[24]。应在首次化疗前进行评估,针对高危人群,在化疗开始前使用重组人粒细胞集落刺激因子等药物,并在化疗周期中严密观察,预防、减少骨髓抑制的发生,保证后续化疗的顺利进行。
