肿瘤相关巨噬细胞和幽门螺杆菌感染在各部位Ⅲ期胃腺癌患者预后中的意义
2021-09-16王月洁魏枫任秀宝
王月洁,魏枫,任秀宝,2
(天津医科大学肿瘤医院1.生物技术研究室;2.生物治疗科,国家肿瘤临床医学研究中心,天津市“肿瘤防治”重点实验室,天津市恶性肿瘤临床医学研究中心,天津市肿瘤免疫与生物治疗重点实验室,天津 300060)
胃癌是世界上第五大常见癌症和全球第三大癌症死亡原因[1],腺癌占胃恶性肿瘤的95%以上[2],进展期患者的5年生存率仅为7%~27%[3],其中胃底贲门癌处于胃食管交界部,近年来较胃体癌和胃窦癌发生率有所上升[4],且术后复发相对较多,患者预后差,严重影响患者的生活质量[5]。肿瘤相关巨噬细胞(tumor-associatedmacrophages,TAMs)是胃癌肿瘤微环境的重要组成部分。越来越多的研究关注胃癌的炎性微环境在胃癌发生、发展中的作用[6]。研究发现TAMs与不良预后密切相关,但亦有研究表明TAMs与预后呈正相关[7]。也有研究显示,幽门螺杆菌(Helicobacter pylori,Hp)相关Tip α蛋白经激活核因子κB,诱导巨噬细胞产生肿瘤坏死因子α等炎症因子,促进肿瘤的发生、发展[8],同时Hp感染在胃癌中可调控TAMs极化[9]。然而,Hp感染和TAMs结合起来讨论与不同部位胃腺癌的预后关系尚未阐明。因此,本研究旨在分析不同部位Ⅲ期胃腺癌组织中的TAMs相关标志物(CD68和CD163)和是否感染Hp,以探讨Hp感染和TAMs与不同部位的Ⅲ期胃腺癌患者预后的关系。
1 对象与方法
1.1 研究对象 选取2012年1月—2014年12月就诊于天津医科大学肿瘤医院胃部肿瘤科经病理确诊为Ⅲ期胃腺癌的病理组织石蜡标本。其中男223例,女77例;年龄范围27~83岁,平均(59.78±11.04)岁。分期采用最新的国际抗癌联盟(International Union Against Cancer,UICC)和美国抗癌联合会(American Joint Committee on Cancer,AJCC)第8版TNM分期。纳入标准:(1)年龄20~85岁。(2)无远处转移。(3)手术切缘镜下阴性。(4)诊断确切。(5)临床分期为Ⅲ期。(6)病例信息完备。排除标准:(1)术前接受除手术外的抗癌治疗者。(2)合并第二原发性肿瘤者。(3)失访者。共收集到符合要求的研究对象300例。其中胃底贲门癌100例、胃体癌100例和胃窦癌100例。本研究得到天津医科大学肿瘤医院伦理委员会批准,标本取材经家属知情同意并签署知情同意书。
1.2 主要试剂与仪器 鼠源单克隆抗CD68抗体购于美国Thermo Fisher公司;兔源单克隆抗CD163抗体购于美国Abcam公司;鼠源单克隆抗CD66b抗体购于美国BioLegend公司;鼠源单克隆抗Hp抗体购于迈新生物技术开发有限公司;DAB显色试剂盒购于北京中衫金桥生物有限公司;二抗即酶标羊抗鼠/兔IgG聚合物购于迈新生物技术开发有限公司;生物显微镜(型号BX51TRF)购自日本Olympus公司。
1.3 方法
1.3.1 免疫组化染色 所有组织标本均经10%福尔马林固定,石蜡包埋,4 μm厚连续切片,组织切片70℃烤箱烘烤1 h后,常规脱蜡,去离子水中浸泡复水15 min,用枸橼酸盐缓冲液高温高压修复3 min,自然晾至室温,3%H2O2封闭30 min,PBS冲洗5 min×3遍,加入稀释比例分别为CD68(1∶400)、CD163(1∶200)、CD66b(1∶100)、Hp(1∶100)于4℃冰箱孵育过夜。PBS洗5 min×3遍后,于室温孵育二抗(即用型免疫组化Elivision plus试剂)30 min,经DAB显色3~5 min,镜下(100×)观察染色情况,充分水洗,苏木素液染核,脱水、透明、中性树胶封片。免疫组化阳性标准:根据染色强度分为无棕黄色(阴性)、淡棕黄色(弱阳性)、棕黄色(阳性)、棕褐色(强阳性)。
1.3.2 免疫组化检测结果判定 所有指标的结果均由2位病理主治医师经双盲法判定。CD68和CD163阳性细胞计数:低倍(100×)下观察切片,选择阳性细胞分布最高密度区即“热点”,然后高倍(400×)下分别在癌巢(center of cancer tissues,CT)和癌巢浸润边缘(infiltrating edge of cancer nests,CI)计数5个视野的阳性细胞数,取其平均值为该例的CD68和CD163阳性细胞值,然后以中位数为截断值,分为高表达组和低表达组。将CD68阳性细胞在胃腺癌癌巢浸润边缘数量多于癌巢者定义为Ⅰ型胃腺癌,反之为Ⅱ型胃腺癌。CD66b阳性细胞计数:低倍(10×)下观察切片,选择中性粒细胞阳性细胞分布最高密度区,然后高倍(400×)下计数5个视野的阳性细胞数,取其平均值。然后以中位数为截断值,分为高表达组和低表达组。Hp结果判定:高倍(400×)下观察胃黏膜表面上皮与黏膜层之间和胃小凹,若观察到粗杆状、海鸥状菌体,部分呈颗粒和团块状,染色无棕黄色,则为阴性。
1.3.3 观察指标 计算患者CD68、CD163和CD66b阳性细胞数和Hp菌体数,观察其表达水平与临床病理特征的相关性以及与无病生存期(disease-free survival,DFS)、总生存期(overall survival,OS)的关系。
1.3.4 随访 随访开始于手术日,截止于2019年12月31日,以电话联系及定期复诊形式进行,中位随访时间为48个月,随访内容包括患者体重、精神状态、饮食、大小便的变化等。其中DFS定义为从手术日期到肿瘤复发或者是到最后1次随访的间隔时间。OS是指从手术日期到患者因肿瘤死亡或者到最后1次随访的间隔时间。
1.4 统计学处理 采用SPSS20.0、GraphPad Prism8进行统计分析。符合正态分布的计量资料以±s表示,组间比较采用t检验;不符合正态分布则以M(P25,P75)表示,组间比较采用Kruskal-Wallis H检验;计数资料以n(%)表示,组间比较采用χ2检验。相关性分析采用Spearman相关。绘制Kaplan-Meier生存曲线,截断值为中位数,采用Log-rank法比较生存率。Cox比例风险模型进行单因素和多因素分析。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料300例胃腺癌患者按照发病部位分为3组,3组的性别、年龄、癌胚抗原(CEA)、体重指数(BMI)、吸烟和淋巴结转移差异均无统计学意义。与胃体癌组比较,胃窦癌组饮酒者较多(t=6.742,P<0.05);与胃底贲门癌组比较,胃窦癌组和胃体癌组肿瘤较小(χ2=5.972,P<0.05),见表1。
表1 3组患者一般资料比较[n(%),±s,M(IQR)]Tab 1 Comparison of basic characteristics among the three groups[n(%),±s,M(IQR)]
注:与胃底贲门癌组比较,aP<0.05;与胃体癌组比较,bP<0.05;CEA:癌胚抗原;BMI:体重指数
?
2.2 CD68+TAMs和CD163+TAMs在不同部位胃腺癌组织中的表达情况CD68蛋白在巨噬细胞胞浆和胞膜呈阳性表达,呈棕褐色(图1)。CD163蛋白在M2型巨噬细胞胞浆和胞膜呈阳性表达,呈棕褐色(图2)。3个部位胃腺癌的TAMs空间分布不同,多在胃底贲门癌和胃体癌的癌巢浸润边缘和胃窦癌的癌巢分布。
2.3 CD68+TAMs和CD163+TAMs在不同部位胃腺癌组织中表达水平比较CD68+和CD163+TAMs在胃窦癌癌巢的相对表达水平高于癌巢浸润边缘;在胃底贲门癌癌巢浸润边缘的相对表达水平高于癌巢;在胃体癌癌巢浸润边缘的相对表达水平高于癌巢,差异有统计学意义(均P<0.01),见表2。

表2 3组患者CD68和CD163蛋白的表达[M(P25,P75)]Tab 2 Expressions of CD68 and CD163 proteins in three groups[M(P25,P75)]
2.4 CD68+TAMs与预后的相关性300例患者随访期均为5年,随访率为100%。CD68+TAMs在胃底贲门癌癌巢的浸润与预后呈正相关(rs=0.674,P=0.023),高计数组OS明显长于低计数组,差异有统计学意义,其他两个部位未见明显差别,CD68+TAMs高计数组在3个部位癌巢的5年累计总生存率分别为52.6%、44.1%和54.3%,5年累计无病生存率分别为25.7%、39.4%和44.9%;低计数组在3个部位癌巢的5年累计总生存率分别为33.3%、39.4%和36.7%,5年累计无病生存率分别为25.7%、29.6%和36.7%,见图3。CD68+TAMs在3个部位胃腺癌癌巢浸润边缘的浸润与预后呈负相关,低计数组OS均明显长于高计数组,在胃体癌癌巢浸润边缘低计数组DFS长于高计数组,差异有统计学意义,其他两个部位未见明显差异,CD68+TAMs高计数组在3个部位癌巢浸润边缘的5年累计总生存率分别为26.3%、34.7%和28.8%,5年累计无病生存率分别为25.0%、25.0%和34.6%;低计数组在3个部位癌巢的5年累计总生存率分别为55.6%、48.7%和45.1%,5年累计无病生存率分别为32.5%、42.5%和47.1%,见图4。
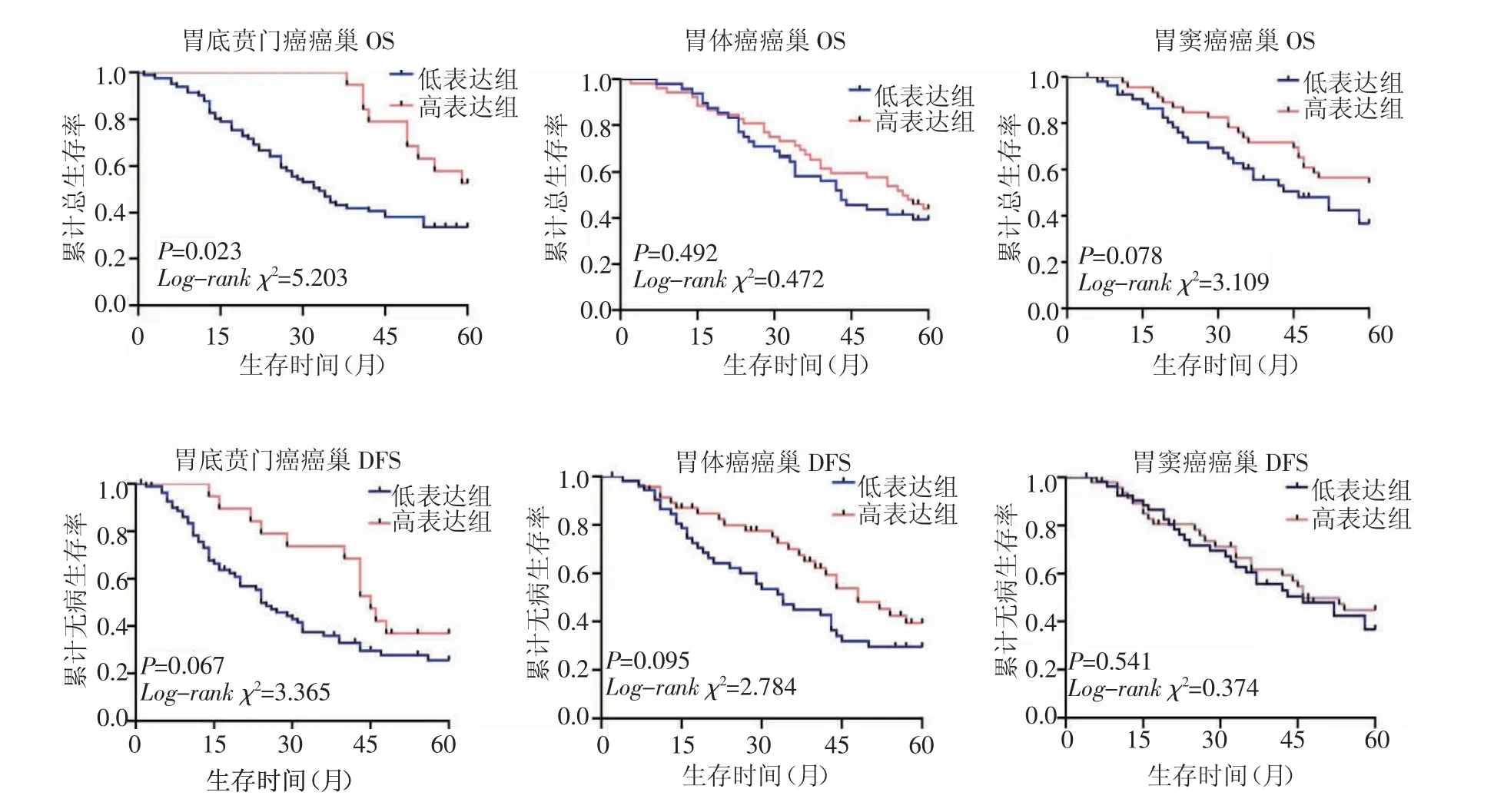
图3 不同部位胃腺癌癌巢的CD68蛋白表达与预后的关系Fig 3 Relationship between expression of CD68 protein in gastric adenocarcinoma nests at various sites and prognosis

图4 不同部位胃腺癌癌巢浸润边缘的CD68蛋白表达与预后的关系Fig 4 Relationship between expression of CD68 protein at the edge of gastric adenocarcinoma nest at the various sites and prognosis
2.5 CD163+TAMs与预后的相关性CD163+TAMs在胃体癌癌巢的浸润与预后呈正相关,高计数组DFS明显好于低计数组,差异有统计学意义,其他两个部位未见明显差别,CD163+TAMs高计数组在3个部位癌巢的5年累计总生存率分别为39.0%、42.1%和49.7%,5年累计无病生存率分别为31.1%、41.9%和43.5%;低计数组在3个部位癌巢的5年累计总生存率分别为34.7%、42.1%和33.1%,5年累计无病生存率分别为23.1%、26.1%和37.8%,见图5。CD163+TAMs在3个部位胃腺癌癌巢浸润边缘的浸润与预后呈负相关,低计数组OS均明显好于高计数组,在胃窦癌癌巢浸润边缘低计数组DFS好于高计数组,差异有统计学意义,其他两个部位未见明显差异,CD163+TAMs高计数组在3个部位癌巢浸润边缘的5年累计总生存率分别为20.4%、36.0%和33.1%,5年累计无病生存率分别为15.1%、23.2%和38.6%;低计数组在3个部位癌巢浸润边缘的5年累计总生存率分别为52.9%、48.0%和51.5%,5年累计无病生存率分别为41.2%、43.7%和44.2%,见图6。
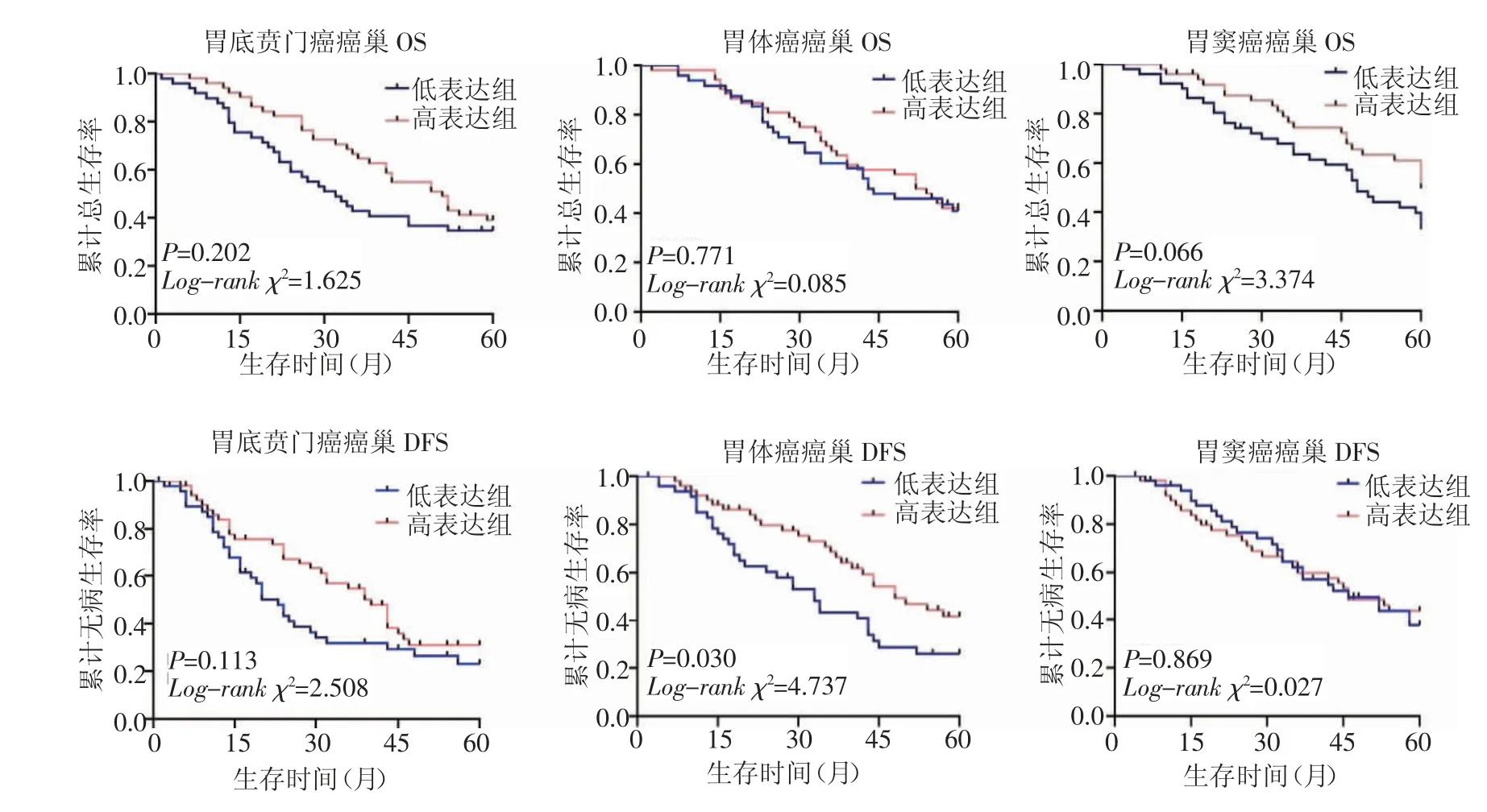
图5 不同部位胃腺癌癌巢的CD163蛋白表达与预后的关系Fig 5 Relationship between expression of CD163 protein in gastric adenocarcinoma nest at various sites and prognosis

图6 不同部位胃腺癌癌巢浸润边缘的CD163蛋白表达与预后的关系Fig 6 Relationship between expression of CD163 protein at the edge of gastric adenocarcinoma nest at the various sites and prognosis
2.6 验证Ⅰ型和Ⅱ型胃腺癌与预后的相关性 不同部位的Ⅰ型和Ⅱ型胃腺癌的构成比例,见图7。Ⅱ型胃腺癌累计OS和DFS率明显高于Ⅰ型,差异有统计学意义,见图8。

图7 不同部位Ⅰ型和Ⅱ型胃腺癌构成比例Fig 7 Proportion of typeⅠand typeⅡgastric adenocarcinoma atvarious sites

图8 Ⅰ型和Ⅱ型胃腺癌患者生存曲线Fig 8 Survival curves of patients with typeⅠand typeⅡgastric adenocarcinoma
2.7 Ⅰ型和Ⅱ型胃腺癌患者Hp的分布情况和CD66b蛋白的表达Hp主要分布在胃黏膜表面上皮与黏膜层之间,贴近黏膜表面上皮细胞,可进入癌巢,胃小凹和黏膜浅层腺腔内亦可见Hp,免疫组化染色呈棕褐色,粗杆状、海鸥状,部分呈颗粒和团块状。CD66b阳性细胞染色呈棕褐色,多分布在癌巢间质,癌巢内也可见(图9)。Ⅰ型较Ⅱ型胃腺癌患者Hp阳性表达率低,差异有统计学意义(表3)。2.8Ⅰ型和Ⅱ型Hp阳性胃腺癌患者临床病理特点的分析 Ⅰ型胃腺癌患者Hp阳性率与发生部位有关,胃底贲门和胃体部阳性率更高(χ2=6.352,P<0.05),而与性别、年龄、BMI、有无吸烟饮酒、肿瘤大小、CEA、淋巴结转移无关;Ⅱ型胃腺癌患者Hp的阳性率在不饮酒者中更高(χ2=4.996,P<0.05),而与发生部位、性别、年龄、BMI、有无吸烟、肿瘤大小、CEA和淋巴结转移无关,见表4。

表3 Ⅰ型和Ⅱ型胃腺癌患者Hp的阳性表达率[n(%)]Tab 3 Hp positive rateof patients with typeⅠand typeⅡgastric adenocarcinoma[n(%)]
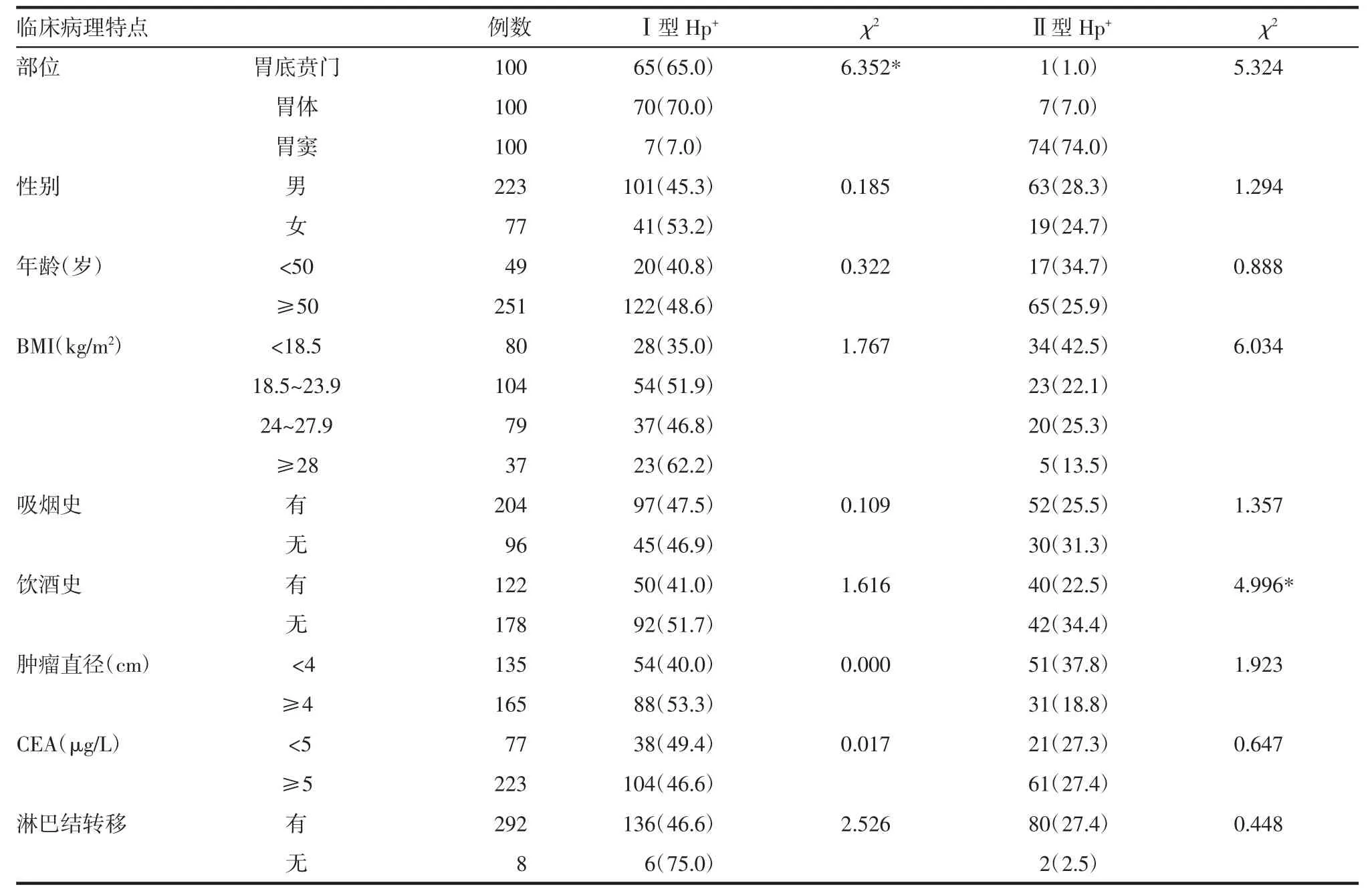
表4 Ⅰ型和Ⅱ型胃腺癌患者Hp阳性表达率与临床病理特点的关系[n(%)]Tab 4 The relationship between the positive rate of Hp and clinical parameters of patients with typeⅠand typeⅡgastric adenocarcinoma[n(%)]
2.9 Ⅰ型和Ⅱ型不同部位的Hp阳性胃腺癌患者与预后的相关性 肿瘤大小与年龄、发生部位有关系;分型与发生部位、中性粒细胞显著相关;Hp与发生部位、分型有关,见表5。单因素分析显示,在不同性别、年龄是否大于50岁、不同BMI、有无吸烟饮酒史、不同CEA、淋巴结是否转移、中性粒细胞不同水平间中位DFS差异无统计学,而发生部位在胃体和胃窦部、肿瘤直径<4 cm、Ⅱ型、Hp阳性者中位DFS较长,生存质量较好(P<0.05);在发生部位、不同性别、年龄是否大于50岁、不同BMI、有无吸烟饮酒史、不同CEA间中位OS差异无统计学意义,而肿瘤直径<4 cm、无淋巴结转移、Ⅱ型、Hp阳性、中性粒细胞高水平者的中位OS较长,生存质量较好(P<0.05),见表6。多因素分析显示肿瘤大小、分型、Hp和中性粒细胞水平是胃腺癌的独立预后因素(P<0.05),见表7。Ⅱ型Hp阳性胃体癌和胃窦癌患者的5年累积总生存率和无病生存率明显高于Ⅰ型Hp阴性(P<0.05),见图10。

表5 各临床病理特征之间的相关性(r)Tab 5 Correlation between each clinical parameters(r)

表6 300例胃腺癌患者生存资料单因素分析Tab 6 Univariate analysis of prognosis factors in 300 patients with gastric adenocarcinoma

表7 300例胃腺癌患者生存资料的多因素分析Tab 7 Multivariate analysis of prognosis factors in 300 patients with gastric adenocarcinoma

注:OS:总生存期;DFS:无病生存期
3 讨论
宿主遭受损伤、炎症、感染和恶性肿瘤时,单核细胞从血液循环中招募出来,分化为组织巨噬细胞[10]。既往研究表明,CD68和CD163蛋白是最常见的TAMs标志物[11]。CD68作为泛巨噬细胞,CD163作为M2型巨噬细胞标志物,常被用于TAMs的评估和分类。但CD68+和CD163+TAMs在肿瘤微环境中的意义仍存在争议。CD68+和CD163+TAMs的浸润与食管癌、肝癌、乳腺癌、膀胱癌以及卵巢癌患者预后不良有关[12-16]。本研究行免疫组化染色示CD68+和CD163+TAMs在不同部位胃腺癌的表达并进行生存分析,发现CD68+和CD163+TAMs多在胃底贲门癌、胃体癌癌巢浸润边缘和胃窦癌癌巢表达,且它们在不同部位胃腺癌癌巢浸润边缘的表达水平与预后呈负相关,与上述研究结果一致。还发现各部位的Ⅱ型胃腺癌患者预后普遍好于Ⅰ型,上述结论得到验证。CD68+和CD163+TAMs在胃腺癌癌巢的高表达与预后呈正相关,虽然这一结果没有达到统计学差异,但可能预示着TAMs只有进入癌巢才能更好发挥吞噬肿瘤细胞的作用,今后需要扩大纳入病例对预后进行深入研究。
本研究结果显示Ⅱ型胃腺癌里胃窦癌占87%,猜想可能是Hp引起的这种现象,Hp破坏线粒体转录基因的调控,影响胃黏膜上皮细胞癌基因的转录平衡,但对T淋巴细胞的免疫平衡无影响。Hp定植于人的胃黏膜表面,机体对细菌产生免疫反应,导致免疫或炎症组织损伤。因此,人体内的免疫系统通过细菌与上皮的黏附而被激活,从而有效地将Hp抗原呈递给T细胞和B细胞,进而产生针对Hp的特异性细胞和体液免疫[17]。正常情况下,人体内的免疫系统具有完善的免疫监视功能。其中,抗原提呈细胞可识别、捕获、加工和呈递内源和外源抗原,诱导机体产生特异性的抗肿瘤和抗炎免疫反应,同时具有免疫调节功能。此外,还受到局部巨噬细胞、细胞因子和内毒素的影响和调节,与消化道炎症和肿瘤密切相关。这些结果表明,上述免疫功能改变在胃癌的发生、发展中起重要作用,但其潜在机制尚需进一步研究。
既往研究认为Hp感染可能会加速胃癌的进展[18]。笔者行免疫组化法染色Hp菌体并计数,发现Ⅱ型胃腺癌Hp阳性表达率高于Ⅰ型(P=0.039),单因素回归分析发现Hp阳性患者中位OS、DFS长于阴性且胃体癌和胃窦癌Ⅱ型胃腺癌Hp阳性患者预后最好,提示Hp感染可能通过影响TAMs浸润癌巢来改善肿瘤发展,此结果与杜金耀[9]不同,原因可能是本研究区分不同部位且严格控制同一临床分期,避免出现由于早期、晚期患者数量不均和不同部位胃腺癌患者预后本身存在差异。另外,胃底贲门癌的Ⅱ型患者太少无法进行预后分析,后期需要进一步扩大样本。
本研究还发现Ⅰ型胃腺癌患者感染Hp的数量与发生部位有关,胃底贲门和胃体部阳性率更高,可能原因:Ⅰ型胃窦癌为少数;Hp定植部位上移。Ⅱ型胃腺癌患者Hp的阳性表达率在不饮酒者中更高(P<0.05),是因为酒精有抵抗Hp的作用[19]。单因素回归分析发现肿瘤体积较小,中位OS、DFS较长,因为肿瘤体积的增加会压迫周围血管、神经,继而诱发其他病变,影响患者的生存时间。中性粒细胞高水平者的中位OS较长,这一结论与Zhang等[20]的观点一致。本研究发现Ⅱ型Hp阳性胃体癌和胃窦癌患者的生存时间明显高于Ⅰ型Hp阴性,推测可能是胃内Hp的感染促进TAMs向癌巢内浸润进而杀伤肿瘤细胞。
总之,本研究提示了肿瘤大小、TAMs的浸润分型和Hp是否感染可能是Ⅲ期胃腺癌的独立预后因素,不同部位的Ⅱ型胃腺癌的Hp感染可能促进TAMs的癌巢浸润,抑制肿瘤的发展速度,缓解患者的生存压力,但是具体机制需要后期更加深入的基础研究和临床研究来探讨Hp和TAMs之间的关系,为胃腺癌的治疗提供新的思路。
