四君子汤含药血清通过抑制RhoA/Rac1/Cdc42通路影响卵巢癌细胞的上皮间质转化
2021-09-15凡张学林冯静茹郝洁周
李 凡张学林冯静茹郝 洁周 蕾
(河北北方学院附属第二医院,张家口 075100)
卵巢癌(ovarian cancer,OC)是全球第六大常见的女性妇科疾病,死亡率居妇科恶性肿瘤之首[1-2]。由于OC患者发作时具有隐匿性,因此确诊时70%处于晚期,为提高OC患者的生存率增加了挑战,因此开发新型有效药物改善OC治疗效果是当务之急[3]。四君子汤由人参、白术、茯苓和炙甘草四味中药材组成,对脾胃气虚、调节肠道蠕动和促进消化等具有良好的治疗效果[4]。此外,朱超等[5]研究发现,四君子汤能够抑制胃癌细胞株侧群细胞的增殖和侵袭能力。Ras同源基因家族成员A(Ras homolog gene family member A,RhoA)、Ras相关的C3肉毒素底物1(Ras-related C3 botulinum toxin substrate 1,Rac1)和细胞分裂周期蛋白42(cell division cycle 42,Cdc42)与细胞迁移和侵袭密切相关,已被证实阻断RhoA/Rac1/Cdc42信号途径,能够抑制风湿关节炎成纤维样滑膜细胞的迁移和侵袭行为,但四君子汤对卵巢癌迁移和侵袭的影响及其具体作用机制尚不明确[6]。本实验旨在探索四君子汤含药血清对人卵巢癌细胞增殖、迁移及侵袭的影响,并初步研究其与RhoA/Rac1/Cdc42信号通路的关联,为OC的临床治疗提供参考。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
SPF级SD大鼠50只,8周龄,体重(200±20)g,均为雌性,购自上海剑钝生物科技有限公司[SCXK(沪)2019-0027],动物饲养于河北北方学院(药学系)[SYXK(冀)2019-004]。本研究经河北北方学院附属第二医院伦理委员会批准(伦审IACUC2019-0307号),实验符合3R保护原则。
1.1.2 细胞
人卵巢癌细胞SKOV3购自中国科学院细胞库,批号TCHu185;人卵巢上皮细胞购自北京北纳创联生物技术研究院,批号BNCC340096。
1.2 主要试剂与仪器
四君子汤颗粒(人参12 g,白术12 g,茯苓12 g,炙甘草6 g)由本院中药房提供;舒尼替尼(原料药,纯度≥98%,批号20190109)购自武汉贝尔卡生物医药有限公司;McCOY’s 5A培养基(批号M9420)、RPMI 1640培养基(批号31800022)、噻唑蓝(methyl thiazolyl tetrazolium,MTT)试剂(批号M8180)、Matrigel胶(批号356234)、RIPA裂解液(批号R0010)、ECL发光液(批号PE0010)、TRIzol试剂盒(批号15596-018)、逆转录试剂盒(批号T2210-200T)、无血清培养基(批号ML4011)均购自北京Solarbio公司;胎牛血清(批号C0225)、胰酶消化液(批号C0201)、上皮型钙粘蛋白(E-cadherin)兔抗人多克隆抗体(批号AF6759)、波形蛋白(Vimentin)兔抗人单克隆抗体(批号AF1975)、神经性钙黏附蛋白(N-cadherin)兔抗人多克隆抗体(批号AF0243)、RhoA兔抗人单克隆抗体(批号AF2179)、Rac1兔抗人多克隆抗体(批号AF7854)、Cdc42兔抗人单克隆抗体(批号AF2794)均购自上海碧云天生物技术有限公司;GAPDH兔抗人多克隆抗体(批号PA1-16777)、山羊抗兔lgG(H+L)二级抗体(批号A32731)均购自美国Thermo Fisher Scientific公司。
HeracellTM240i型CO2细胞培养箱、Multiskan Sky型全波长酶标仪、GENESYSTM50型可见光/紫外分光光度计均购自美国Thermo Fisher Scientific公司;Gel DocTMXR+型凝胶成像仪购自美国Bio-Rad公司;2720型实时荧光定量PCR(Real time fluorescent quantitative PCR,qRT-PCR)仪购自美国ABI公司;LW300LFT-LED型荧光显微镜购自北京测维光电仪器厂。
1.3 实验方法
1.3.1 含药血清的制备
将50只SPF级雌性SD大鼠随机分为5组:不含药血清组、舒尼替尼阳性药物组、2.07 g/kg(1/2等效剂量)四君子汤给药组、4.14 g/kg(1倍等效剂量)四君子汤给药组、8.28 g/kg(2倍等效剂量)四君子汤给药组,每组10只,给药剂量参照“人和动物按体表面积折算的等效剂量比率表”计算。不含药血清组给予生理盐水灌胃,灌胃体积5 mL;舒尼替尼组给予10.14 g/kg舒尼替尼灌胃,每天1次,灌胃体积5 mL;各四君子汤组给予对应剂量的四君子汤分别进行灌胃处理,每天2次,每次2.5 mL;连续7 d,第8天末次给药1 h,麻醉后,无菌环境下经腹动脉采血,4℃静置2 h,离心(3000 r/min,15 min)3次,同组合并上清,56℃灭活30 min,过滤除菌,得不含药血清、舒尼替尼含药血清、四君子汤低、中、高剂量组含药血清,-20℃保存备用。
1.3.2 细胞培养及分组
将SKOV3细胞接种于含有10%胎牛血清的McCOY’s 5A培养基,在37℃、5% CO2培养箱中培养至细胞融合80%左右,每隔1 d更换一次培养液。取对数期生长的SKOV3细胞,随机分为空白对照组、舒尼替尼组、四君子汤I组、II组、III组,接种于96或6孔板,分别用体积分数为20%的不含药血清(空白对照组)、舒尼替尼含药血清(舒尼替尼组)、四君子汤低剂量含药血清(四君子汤I组)、四君子汤中剂量含药血清(四君子汤II组)和四君子汤高剂量含药血清(四君子汤III组),处理24 h,其中96孔板培养液量为每孔200 μL,6孔板培养液量为每孔2 mL,收集细胞用于后续实验。另将用含有10%胎牛血清的RPMI 1640培养基培养的人卵巢上皮细胞接种于96孔板,按照上述方法分组并处理24 h后用于后续实验。
1.3.3 MTT实验
向1.3.2各组SKOV3细胞孔板中加入5 μL 5 mg/mL MTT溶液,培养箱孵育4 h,吸去上清液,每孔添加100 μL二甲基亚砜,37℃摇床震荡10 min,570 nm下测量各孔OD值,计算细胞存活率,以上每组设置6个复孔。存活率(%)=(实验孔OD值-调零孔OD值)/(对照组OD值-调零孔OD值)。按照上述方法测定人卵巢上皮细胞的存活率。
1.3.4 划痕实验
待1.3.2各组SKOV3细胞融合至85%左右,用200 μL枪头垂直划痕,PBS清洗3次,加入无血清培养基,置于37℃、5% CO2培养箱中培养,显微镜下观察并记录0 h和24 h时划痕变化情况,计算各组细胞愈合率。愈合率=(0 h划痕距离-24 h划痕距离)/0 h划痕距离×100%。
1.3.5 Transwell实验
收集1.3.2各组SKOV3细胞,调整浓度为每毫升2×105个,取200 μL接种于预铺设Matrigel基底胶的上室,下室添加每孔500 μL完全培养液,置于37℃、5% CO2培养箱24 h,甲醛固定25 min,结晶紫染色25 min,随机抽取6个视野,高倍(×200)显微镜下观察并计数.
1.3.6 蛋白免疫印迹分析实验
收集1.3.2各组SKOV3细胞,加入RIPA裂解液裂解,测量各组总蛋白含量。取等量蛋白上样、12%聚丙烯酰胺凝胶电泳、转膜、脱脂牛奶封闭4 h,洗膜,加入一抗E-cadherin、N-cadherin、Vimentin、RhoA、Rac1、Cdc42和GAPDH(1∶1000),4℃孵化过夜,洗膜然后加入二抗(1∶5000),室温封闭1 h,TBST洗膜,曝光显影并记录,计算目标蛋白相对表达值。目标蛋白相对表达量=目标条带灰度值/GAPDH灰度值。
1.3.7 qRT-PCR实验
按照TRIzol说明书,提取1.3.2各组细胞总RNA,纯化后,使用紫外分光光度仪计算RNA纯度(OD260nm/OD280nm),逆转录(37℃60 min,95℃3 min)得cDNA。以各组cDNA为模板,进行扩增反应。PCR反应条件:95℃预变性3 min,95℃变性15 s,60℃退火40 s,95℃延伸15 s,共40次循环。以GAPDH为内参,采用2-ΔΔCT法分析RhoA、Rac1和Cdc42基因表达情况。RhoA、Rac1、Cdc42及GAPDH引物序列见表1,均由上海生工生物工程有限公司合成。

表1 RhoA、Rac1、Cdc42和内参GAPDH引物序列Table 1 Primer sequences of RhoA,Rac1,Cdc42 and internal reference GAPDH
1.4 统计学方法
以统计学软件SPSS 22.0分析实验数据,计量资料以平均数±标准差(¯x±s)描述,多组间比较使用单因素方差分析,进一步两组间比较行SNK-q检验,当P<0.05时,差异有统计学意义。
2 结果
2.1 四君子汤含药血清对SKOV3细胞及人卵巢上皮细胞存活率变化影响
与空白对照组相比,舒尼替尼组SKOV3细胞存活率显著降低(P<0.05),四君子汤I、II、III组SKOV3细胞存活率依次降低(P<0.05),呈剂量依赖性。四君子汤III组与舒尼替尼组SKOV3细胞存活率差异无统计学意义(P>0.05)。各组人卵巢上皮细胞存活率差异无统计学意义(P>0.05)。见表2。
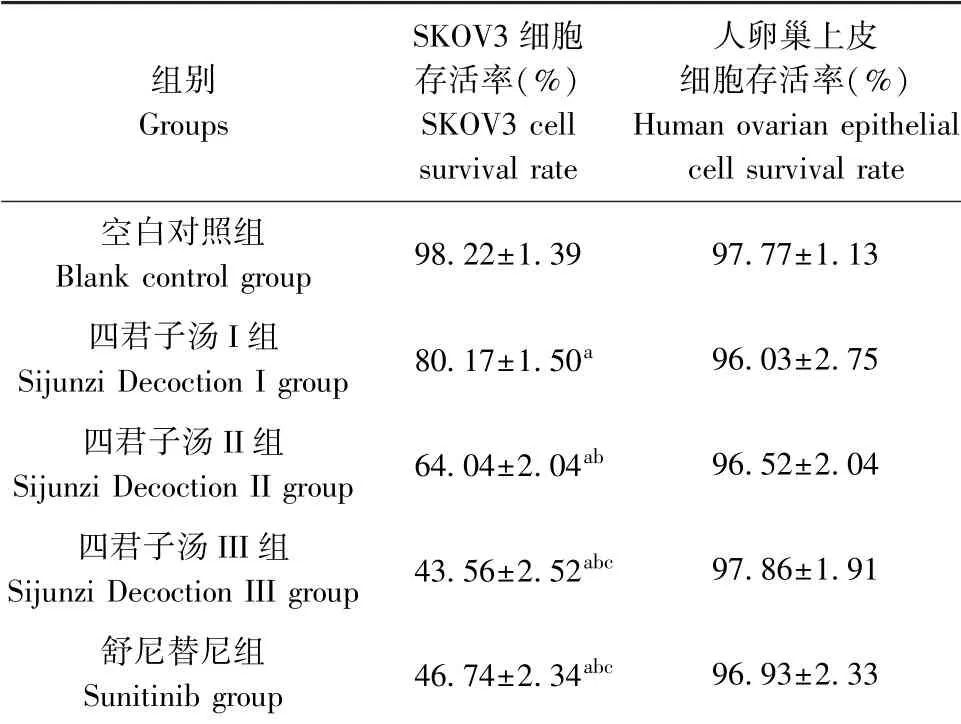
表2 各组SKOV3细胞及人卵巢上皮细胞存活率变化情况(¯x±s,n=6)Table 2 Changes in survival rate of SKOV3 cells and human ovarian epithelial cells in each group
2.2 四君子汤含药血清对SKOV3细胞迁移能力的影响
与空白对照组相比,舒尼替尼组SKOV3细胞划痕愈合率显著降低(P<0.05),四君子汤I、II、III组SKOV3细胞划痕愈合率依次降低(P<0.05),呈剂量依赖性。四君子汤III组与舒尼替尼组细胞划痕愈合率差异无统计学意义(P>0.05)。见图1、表3。

图1 各组SKOV3细胞迁移图片Figure 1 SKOV3 cell migration pictures of each group

表3 四君子汤含药血清作用后各组SKOV3细胞划痕愈合率(¯x±s,n=6)Table 3 Healing rate of scratches of SKOV3 cells in each group after the effect of Sijunzi decoction-containing serum
2.3 四君子汤含药血清对SKOV3细胞侵袭数量变化
与空白对照组相比,舒尼替尼组SKOV3细胞侵袭数量显著降低(P<0.05),四君子汤I、II、III组SKOV3细胞侵袭数量依次降低(P<0.05),呈剂量依赖性。四君子汤III组与舒尼替尼组细胞侵袭数量差异无统计学意义(P>0.05)。见图2、表4。

表4 四君子汤含药血清作用后各组SKOV3细胞侵袭数量(¯x±s,n=6)Table 4 Number of SKOV3 cell invasion in each group after the effect of Sijunzi decoction
2.4 四君子汤含药血清对SKOV3细胞EMT相关蛋白表达的影响
与空白对照组相比,舒尼替尼组SKOV3细胞E-cadherin蛋白表达显著升高(P<0.05),N-cadherin和Vimentin蛋白表达显著降低(P<0.05),四君子汤I、II、III组SKOV3细胞E-cadherin蛋白表达依次升高(P<0.05),N-cadherin和Vimentin蛋白表达依次降低(P<0.05)。四君子汤III组与舒尼替尼组细胞E-cadherin、N-cadherin和Vimentin蛋白表达差异无统计学意义(P>0.05)。见图3、表5。

表5 各组SKOV3细胞E-cadherin、N-cadherin和Vimentin蛋白表达情况(¯x±s,n=6)Table 5 E-cadherin,N-cadherin and Vimentin protein expression of SKOV3 cells in each group
2.5 四君子汤含药血清对RhoA、Rac1和Cdc42表达的影响
与空白对照组相比,舒尼替尼组SKOV3细胞RhoA、Rac1、Cdc42 mRNA和蛋白表达显著降低(P<0.05),四君子汤I、II、III组SKOV3细胞RhoA、Rac1、Cdc42 mRNA和蛋白表达依次降低(P<0.05)。四君子汤III组与舒尼替尼组细胞RhoA、Rac1、Cdc42 mRNA和蛋白表达差异无统计学意义(P>0.05)。见图4、表6。

表6 各组SKOV3细胞RhoA、Rac1和Cdc42 mRNA表达情况(¯x±s,n=6)Table 6 RhoA,Rac1 and Cdc42 protein expression of SKOV3 cells in each group

注:A:空白对照组;B:四君子汤I组;C:四君子汤II组;D:四君子汤III组;E:舒尼替尼组。图2 四君子汤含药血清对SKOV3细胞侵袭能力的影响(结晶紫染色)Note.A,Blank control group.B,Sijunzi Decoction I group.C,Sijunzi Decoction II group.D,Sijunzi Decoction III group.E,Sunitinib group.Figure 2 Effect of Sijunzi decoction-containing serum on the invasion ability of SKOV3 cells(Crystal violet staining)

注:A:空白对照组;B:四君子汤I组;C:四君子汤II组;D:四君子汤III组;E:舒尼替尼组。图3 各组SKOV3细胞E-cadherin、N-cadherin和Vimentin蛋白表达电泳图Note.A,Blank control group.B,Sijunzi Decoction I group.C,Sijunzi Decoction II group.D,Sijunzi Decoction III group.E,Sunitinib group.Figure 3 E-cadherin,N-cadherin and Vimentin protein expression electrophoresis of SKOV3 cells in each group

注:A:空白对照组;B:四君子汤I组;C:四君子汤II组;D:四君子汤III组;E:舒尼替尼组。图4 各组SKOV3细胞RhoA、Rac1和Cdc42蛋白表达电泳图Note.A,Blank control group.B,Sijunzi Decoction I group.C,Sijunzi Decoction II group.D,Sijunzi Decoction III group.E,Sunitinib group.Figure 4 RhoA,Rac1 and Cdc42 protein expression electrophoresis of SKOV3 cells in each group
3 讨论
OC具有骨盆腔广泛扩散的特征,癌细胞的转移是造成这种结果的重要原因[7]。目前,OC的治疗主要以外科手术治疗为基础,辅以化学疗法,但大多数患者会在术后阶段复发,导致OC的5年生存率仅为44%[8]。血清药理学是一种广泛用于中药和复方药物药效及药理机制研究的实验方法,已证实臭牡丹含药血清能够抑制肝癌细胞的增殖和迁移[9]。
四君子汤四君子汤来源于宋代《太平惠民和剂局方》,由人参、白术、茯苓和甘草组成,主要含有多糖、皂苷和黄酮类等有效成分,具有增强免疫、抗肿瘤和抗衰老等作用[10]。近来研究显示,四君子汤在抗肿瘤方面能够抑制肿瘤细胞的增殖、迁移和侵袭能力[11]。本研究结果显示,与空白对照组相比,四君子汤含药血清I、II、III组和舒尼替尼组人卵巢上皮细胞存活率差异无统计学意义,提示四君子汤含药血清对人卵巢上皮细胞存活率无影响。黄晓燕等[12]和洪亚群等[13]研究发现,四君子汤含药血清或其有效成分对肠癌SW480细胞或胃癌细胞具有增殖抑制作用。本研究发现,与舒尼替尼组相比,四君子汤III组SKOV3细胞存活率、愈合率、侵袭数量差异无统计学意义;与空白对照组相比,四君子汤I、II、III组SKOV3细胞存活率、愈合率、侵袭数量依次降低,提示四君子汤含药血清能有抑制人卵巢癌细胞的增殖、迁移和侵袭行为,高浓度的四君子汤含药血清和舒尼替尼作用相当。
上皮-间质化(epithelial-mesenchymal transition,EMT)是恶性肿瘤浸润转移的关键步骤,与肿瘤细胞的侵袭和迁移密切相关[14-15]。在该过程中,对上皮细胞黏附连接至关重要的E-cadherin蛋白表达下降,而间充质标记物N-cadherin和Vimentin表达升高[16]。本研究发现,与空白对照组相比,四君子汤I、II、III组SKOV3细胞E-cadherin蛋白表达依次升高,N-cadherin和Vimentin蛋白表达依次降低,提示四君子汤含药血清可以抑制人卵巢癌细胞的EMT进程。Liu等[17]研究显示,通过抑制EMT过程能够调节卵巢癌的转移能力,因此推测四君子汤含药血清可能通过抑制EMT进程,干预卵巢癌细胞的迁移和侵袭,可能为四君子汤应用于OC的辅助治疗提供了参考。
Rho家族小分子鸟苷三磷酸酶(Small GTPases of Rho family,Rho GTPases)包含小型GTpases的Ras超家族的子家族,能够诱导肌动蛋白细胞骨架动力学和基因转录的协调变化,驱动细胞黏附、迁移、形态变化等[18-19]。RhoA、Rac1和Cdc42是Ras超家族的三个重要成员,在调节细胞EMT进程中发挥重要作用[20]。在乳腺癌肿瘤细胞中,抑制RhoA、Rac1和Cdc42表达,能够促进细胞间质向上皮样转变,并促进E-cadherin表达[21]。本研究发现,与空白对照组相比,四君子汤I、II、III组SKOV3细胞RhoA、Rac1、Cdc42 mRNA和蛋白表达呈剂量依赖性降低,四君子汤III组作用效果与舒尼替尼作用效果相当,提示四君子汤对人卵巢癌细胞EMT过程的抑制作用,可能与抑制RhoA/Rac1/Cdc42信号通路相关。舒尼替尼是一种多靶点抗肿瘤药物,可以通过抑制多个受体的酪氨酸激酶活性参与实体瘤的发生发展,本研究发现舒尼替尼能够抑制RhoA/Rac1/Cdc42信号通路抑制卵巢癌细胞的生物学行为,推测舒尼替尼的抗肿瘤机制也可能与RhoA/Rac1/Cdc42信号通路或其相关蛋白有关,但四君子汤含药血清和舒尼替尼的具体作用靶点是否一致,仍待考究。另有研究显示[22],RhoA、Rac1和Cdc42表达下调可以抑制类风湿性关节炎中的成纤维滑膜细胞的迁移和侵袭,因此推测,四君子汤含药血清可能通过抑制RhoA/Rac1/Cdc42信号通路,抑制细胞EMT发生,从而抑制人卵巢癌细胞的增殖、迁移和侵袭。此外,四君子汤含药血清中含有人参皂苷Rb1、Re、Rg1、甘草酸、甘草次酸和甘草素葡萄糖醛酸六种化学成分[23-24],其中人参皂苷Rb1[25]和甘草酸[26]已分别被证实能够抑制乳腺癌细胞的EMT和迁移及侵袭,而人参皂苷Re对肿瘤细胞具有抑制作用[27],人参皂苷Rg1主要用于神经系统疾病的治疗[28],因此四君子汤含药血清中调控RhoA/Rac1/Cdc42信号通路的具体有效成分尚不明确,需进行更深入的研究和探索。
综上所述,四君子汤含药血清对人卵巢癌细胞的增殖、迁移和侵袭行为的抑制作用,可能与抑制RhoA/Rac1/Cdc42信号通路,抑制EMT发生相关,表明四君子汤在OC治疗方向具有潜在治疗或辅助治疗价值,可能为临床治疗OC提供了新的思路和方法。但鉴于OC发病机制及四君子汤中药成分的复杂性,本课题组将针对四君子汤中不同成分组合含药血清对卵巢癌细胞的作用效果,以及四君子汤含药血清有效成分对RhoA/Rac1/Cdc42信号通路及卵巢癌细胞的影响进行更深入的研究和探索,以期能够完善四君子汤含药血清对卵巢癌药理学分析。
