可用于伤口感染检测的新型敷料的研究进展
2021-09-15唐志敏唐丽琴曾羽佳
唐志敏, 唐丽琴, 曾羽佳, 李 彦, 王 璐
(东华大学 纺织学院,上海 201620)
伤口的延迟愈合会延长患者的痛苦和不适,影响患者的生活质量,增加并发症的风险,加重医疗负担。特别是慢性伤口(通常指2~4周后,伤口面积缩小少于20%~40%的伤口面积)已被广泛认为是一种无声的流行病,影响着越来越多人的正常生活[1]。据世界卫生组织统计,在美国大约有650万人患有某种形式的慢性伤口,每年用于伤口感染治疗的费用约为250亿美元。同时,医疗保健费用的持续上涨,人口老龄化严重以及糖尿病等患者急剧增加,预计治疗负担将相应急剧加重,对公共卫生构成了持续性重大威胁[2]。
伤口久治不愈往往与发生感染相关,临床表现为红斑、水肿、化脓、浮肿等。然而,在伤口感染初期,感染指征并不明显,尤其是在敷料的覆盖下鉴别困难。患者通常只有在出现严重症状,如黄色渗出液、伤口破裂、肉芽组织变色后,才会就医进行伤口干预,但此时往往因形成不可挽回的恶化性伤口环境而最终导致截肢、溃疡癌变等健康威胁事件。因此,预防和及时诊断治疗伤口感染、缩短治疗时间是至关重要的。
常见的敷料分类如下:
(1) 传统敷料。普通的纱布、脱脂棉、棉垫等均属于传统敷料。这些敷料通常联合局部应用抗生素等抑菌药物达到抑菌效果,透气、透湿性佳,但其易粘连伤口、不隔菌、易使伤口造成二次损伤。
(2) 天然生物敷料。①自体皮:排异反应小,但对于大面积皮肤损伤的患者,因自体皮来源有限,而无法应对临床巨大的需求量。②同种异体皮:来源受限且保存条件苛刻,具有抗原性和占位性,易使患者感染病原体。③脱细胞真皮基质:使用时需清除免疫排斥的抗原,透气性优异且效果好,但价格昂贵。④胶原类:具有弱抗原性和促凝血性质,有利于组织修复。⑤藻酸盐类:具有强大的液体吸收能力,可用于感染伤口,但会引起创面脱水和干燥,价格昂贵,力学强度低。
(3) 新型合成敷料。①薄膜类:透明易于观察伤口,能保持创面湿润,贴合性和透气性好,但几乎没有吸收性能,不适于渗液过多的创面,适合烧烫伤小面积伤口的上皮形成期,常选用聚氨酯、尼龙6、聚乙烯等作为原料。②水胶体类:薄而透明,可以吸收渗液且黏附性强,不与创面粘连,可促进自溶性清创,但易污染且需勤换药,易卷边导致伤口处疼痛,适用于浅表皮层损伤的止血或凝血阶段。医用水胶体敷料中使用的嵌段型共聚物热塑性弹性体主要是苯乙烯-异戊二烯-苯乙烯嵌段共聚物。③水凝胶类:柔软、可维持创面湿性愈合环境,与创面不粘连,可促进自溶性清创、抗菌,价格昂贵,适用于烧伤和压疮伤口。④泡沫类:透气好、舒适、吸收性能高,但易导致伤口周围皮肤浸渍且价格昂贵,适用于溃疡伤口止血或炎症阶段。⑤静电纺类:多孔结构、可吸收渗液、防止与伤口发生粘连,可方便负载或吸附抗菌药物并促进愈合。此外,可对电纺膜进行表面修饰或改性,减少药物突释,实现持续给药。
在伤口发生感染时,能够为并发症提供关键警告的标志物监测将是下一代智能敷料发展面临的关键挑战。通过监测诊断,评估伤口微环境如温湿度、pH值、酶等的变化,从而防御感染、缩短治疗时间并减少治疗成本。近几年来集成传统敷料特性开发出的具有实时监测、早期诊断和随需治疗的新型伤口敷料成为了研究的热点。
1 创面渗液酸碱度检测
1.1 pH值与伤口感染间的关联
正常的人体皮肤表面因代谢存留着尿酸、乳酸、氨基酸、游离脂肪酸等物质而呈现出弱酸性(pH值为4.0~5.5)。皮肤屏障受损时,伤口部位渗出液的pH值会随着炎症反应、胶原形成和血管生成等一系列病理变化而发生改变。
炎症反应阶段,伤口局部组织血管收缩引发供血不足,进而导致营养及氧气缺乏。糖酵解导致乳酸及CO2增加,pH值降低。若伤口处存在感染,致病菌过度分解细胞外基质并产生氨,从而使伤口呈碱性[3],氧合血红蛋白在碱性环境下释放的氧气减少,不利于愈合。未采取对应的干预措施时,中性粒细胞会迅速聚集,释放过量弹性蛋白酶,与伤口中坏死组织和失活组织作用,导致伤口处的代谢负荷增加,使得创面迁延不愈。酸性环境可使氧供应增加,诱导成纤维细胞增殖,有利于伤口愈合。临床研究[4]表明,慢性伤口的pH值为7.15~8.90,该范围是大多数病菌生长增殖的理想环境,如金黄色葡萄球菌适宜生存的pH值为7.0~7.5。因此,升高的pH值可被用作伤口发生感染的一个重要的指标。伤口愈合阶段急性和慢性伤口的pH值理想曲线如图1所示。
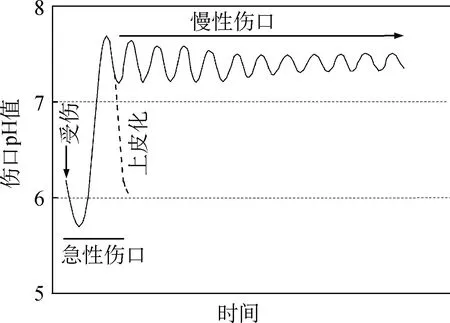
图1 伤口愈合阶段急性和慢性伤口的pH值曲线[5]Fig.1 The pH proles of the healing stage of acute and chronic wounds[5]
1.2 pH响应型敷料研究进展
当前,pH响应式敷料的构建主要围绕比色响应进行设计,通过在传统敷料中引入pH指示剂产生颜色变化感知伤口愈合环境。如Mohr等[6]和Schaude等[7]将生物相容性优异的指示剂染料共价连接到棉纤维、非织造布等纺织基材上,进而加工集成为医用棉签、绷带、纱布等常规传统敷料。随pH值升高,敷料由绿色变为红色,产生类似“交通信号”的光学响应。该类敷料价格低廉,无需仪器辅助,操作简单,广普大众的接受度高。但与此同时,考虑到临床使用中可能存在伤口渗液过少、过多或渗出液本身有颜色(血腥、化脓伤口等)干扰的情况,该类响应敷料的临床推广研究还在持续推进中。
Kassal等[8]将pH指示剂染料GJM-534通过共价键结合到纤维素颗粒上,然后嵌入聚氨酯基薄层作为pH指示传感的敏感层,并将此敏感薄层浇铸在常规绷带上,形成一种可检测伤口的智能绷带。利用微型光电探头与无线平台连接,并使用射频识别与外部读取单元进行通信,读取伤口渗出液的pH值。无线智能绷带的操作示意图如图2所示。这种响应敷料价格较低,但易受离子、基质材料等的影响[6, 9],适用于一次性传感敷料。类似地,Chen等[10]将装有环丙沙星的发光多孔硅(CIP-LuPSi)颗粒包埋在聚氨酯和壳聚糖薄膜中作为智能绷带,当pH值和活性氧含量升高时,LuPSi的表面被氧化使红色荧光降低,抗菌药物CIP释放,荧光变为蓝光,依靠肉眼或手机摄像头即可识别感染。
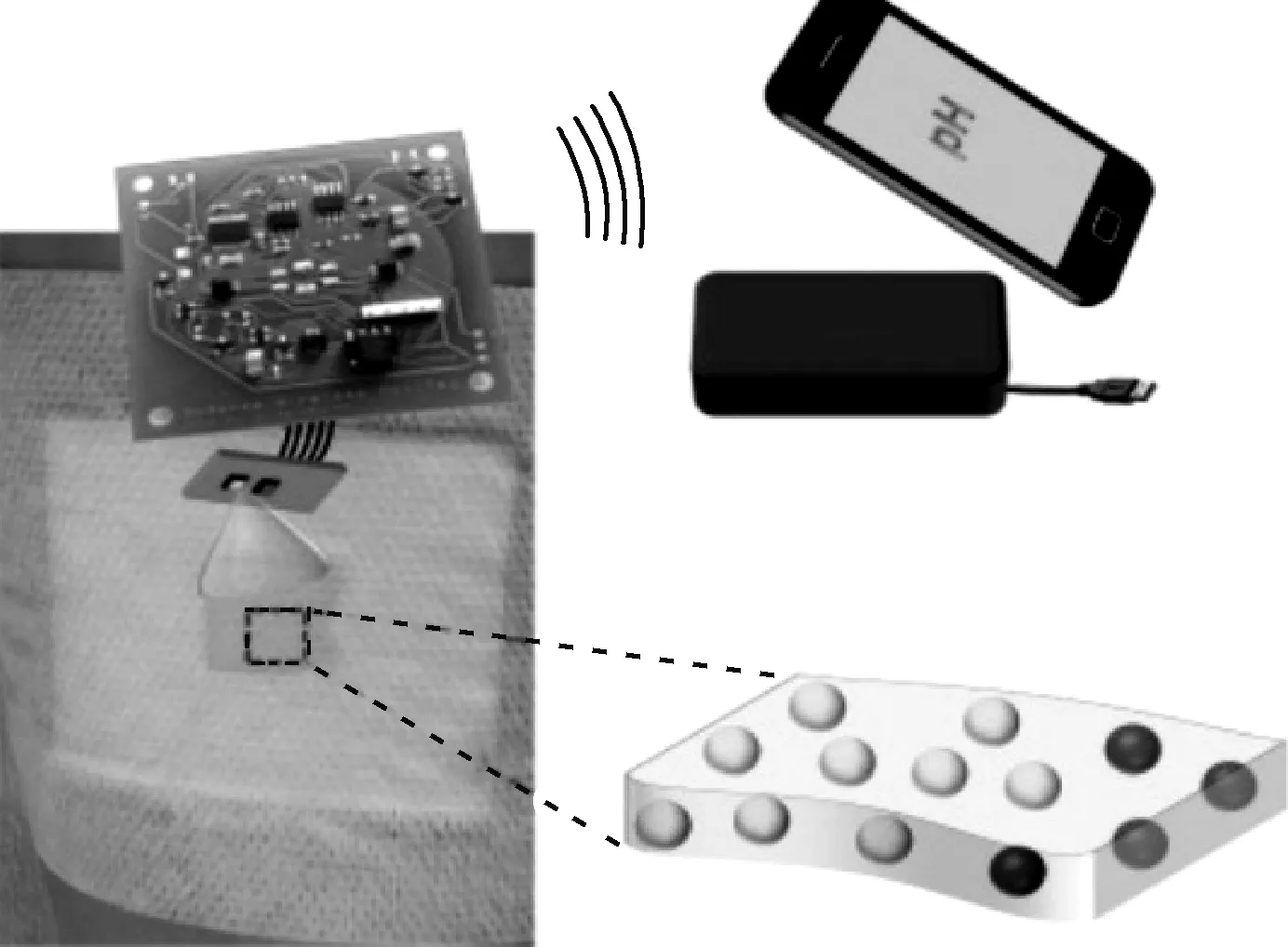
图2 无线智能绷带的操作示意图[8]Fig.2 Schematic showing operation of the wireless smart bandage[8]
水凝胶敷料表面光滑且生物相容性好,与创面接触时能发生反复水合作用,吸收创面渗出的组织液。与此同时,水凝胶敷料具有一定的黏性和延展性,能与创面紧密贴合,从而减少感染的发生。Zhu等[11]研制了一种新型两性离子聚羧基甜菜碱水凝胶敷料,以无毒性的苯酚红染料为酸碱指示剂,利用光学传感器,当pH值升高即发生伤口感染时,水凝胶由无色逐渐变为红色,从而达到实时监测伤口pH值以及较方便地预测伤口感染风险的目的。与市售“DuoDerm”敷料相比,Zhu等[11]研制的敷料具有更好的促愈合功能,但存在测量不够精确和染料易浸出的问题。
2 创面温度检测
2.1 温度变化与伤口感染间的关联
皮肤温度受内部生理因素和外部环境因素的影响,如环境温度、表面水分、身体位置等。发生伤口感染时,人体的免疫反应以及炎症细胞因子诱导的血管舒张和组织新陈代谢增加,这都会导致温度升高,而创面温度接近正常体温时,有利于细胞分裂。手术后第3天若温度仍持续上升,可被认为是伤口感染的标志[12]。临床上,通常将特定目标部位和对称的对侧参考点之间的皮肤温度差作为参考。根据经过验证的评估工具和临床判断,确定伤口是否发生感染[13-14]。
2.2 温度响应型敷料研究进展
据报道,麻省理工学院机械工程系的Sun等[15]设计了一款与隐形眼镜材质(硅水凝胶)类似的弹性水凝胶敷料,将离子交联的藻酸盐和共价交联的聚丙烯酰胺混合形成极易拉伸且坚韧的水凝胶网络。在此基础上,该研究团队为拓展其应用,在该水凝胶敷料内部嵌入可实现温度响应的电子装置,在伤口保持湿润的情况下实时监测伤口的温度。该款水凝胶敷料的主要特点是延展性极好,适用于膝盖或手肘等动作幅度大的部位,此外还能储药和输送药物,实现按需治疗,较符合可穿戴型伤口敷料的要求。Pang等[16]设计了具有双层结构的电子集成式伤口敷料,上层为柔性电子元件和温度传感器、紫外发光二极管,下层为紫外光响应的抗菌水凝胶,使用这种敷料对伤口处病理性感染进行早期预测,当检测到最高温度为40 ℃且持续超过6 h(被认为是感染)时,触发热响应性载体释放药物,实时监测、早期诊断和适度给药。该装置的原理示意图如图3所示,其具有良好的灵活性和兼容性、较高的监测灵敏度和耐久性等优势。这种将水凝胶与温湿度等传感器结合,并根据实时需要定量输送药物的方式将是新一代智能传感的发展方向。但因响应元件使用寿命较短,大多只能用作一次性敷料。

(a) 结构
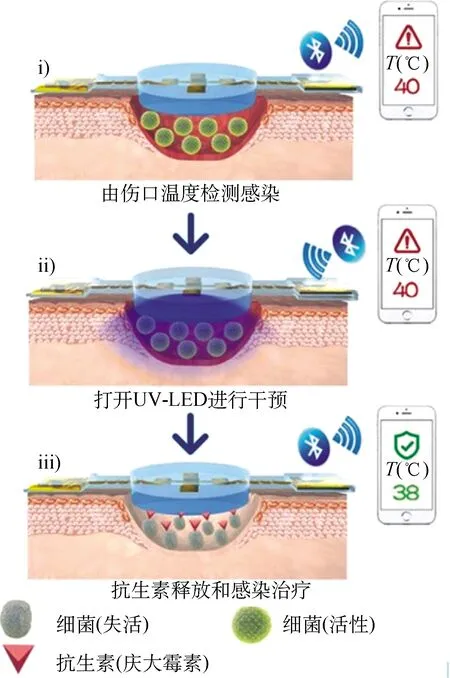
(b) 工作原理
爱尔兰廷德尔国家研究院、弗莱明医疗机构及荷兰霍尔斯特中心的研究团队研发了一款智能敷料,名为“DermaTrax”,以泡沫敷料为基材,在内层结合轻薄、灵活的传感器模块,可以远程自动监测伤口与敷料贴合处的温度、湿度和pH值,可全面替代定期复检、换药等常规治疗方法,极大地节省医疗成本并提高医疗效果。泡沫型敷料透水气性能好,但渗液过多也会导致伤口浸渍。“DermaTrax”智能敷料的结构图如图4所示。

图4 “DermaTrax”智能敷料的结构图Fig.4 Structure diagram of "DermaTrax" smart dressing
静电纺类敷料具有多孔结构,透气性好,结合热敏传感器可较长时间检测伤口温度。Gong等[17]改进并设计了一款可实时监测温度并按需释放药物的柔性透气热响应性聚合物纳米纤维敷料,其工作原理如图5所示。该敷料具有导电图案化的交联电纺负载药物的丝网印刷膜,电阻和温度呈线性关系,可实现诊疗一体化,这种复合方式可以因传感器的改变而实现不同检测指标的测量。同时,对敷料进行柔性化、增加渗透性改进,使用舒适感提升。
韩波[18]设计了一种新型的智能传感敷料,以商用“Tegaderm”薄膜敷料为基材,设计了一款以CC2440型芯片为基础的CPU控制模块、温湿度传感器模块、压力模块、蓝牙模块等单元的集成系统,初步实现了对创面温度、湿度以及压力等参数的监测,通过蓝牙与智能手机相连可实时显示所监测到的数据,并可对创面数据信息进行智能管理及长期保存,生物相容性好。对于以化学传感器为传感模块的伤口敷料,在检测代谢物上具有可靠、无创、小型化可移动且便宜的特点,可连续测量多个生化分析物,对复杂慢性伤口的检测治疗很有利。该敷料可改善创面的微环境,减少换药频率,使创面更快地愈合。
3 创面内源性伤口生物标记物检测
3.1 内源性伤口标记物与伤口感染间的关联
内源性伤口标志物是指人体受到病原体侵袭时,调动各种防御功能以消除病原体及其有毒产物,恢复身体的相对稳定性,从而表达出的各类免疫物质,包括尿酸、蛋白酶、调节因子、一氧化氮(NO)等。这些物质是人体对抗外界微生物入侵的先天性免疫应答反应的产物,因而可以作为伤口感染早期的监测指标。
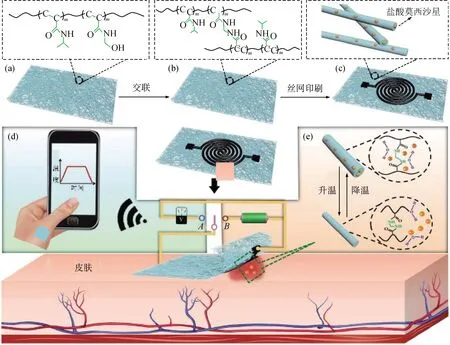
图5 按需释放药物的柔性、透气温度传感敷料示意图[17]Fig.5 Schematic diagram of a flexible, breathable temperature sensing dressing that can releases drugs on demand[17]
3.2 尿酸响应型敷料研究进展
由机械作用或化学干扰而导致的细胞损伤会使得三磷酸腺苷(adenosine triphosphate, ATP)释放到细胞外基质中。ATP逐步分解为腺苷单磷酸、肌苷单磷酸、腺苷、肌苷和次黄嘌呤,并在组织中积累。黄嘌呤氧化酶将次黄嘌呤转化为黄嘌呤,最终转化为尿酸(uric acid, UA),并释放有毒的超氧化物自由基[19],正常UA浓度为220~750 μmol/L。伤口内尿酸盐含量增加容易延长炎症期,并使愈合过程停滞甚至向慢性伤口发展。
黄嘌呤氧化酶是人体中唯一一种可催化产生UA的生物酶,来自垂死细胞的尿酸盐是“损伤相关”的分子触发因子,可导致中性粒细胞增殖和炎症加剧,因此UA可作为监测指标。
对于检测用敷料,通常将各种复杂的传感集成系统与传统绷带结合,主要检测伤口各项指标,绷带仅起到固定传感器的作用。如Phair等[20]设计了一种以大气压等离子体处理的导电、低模量碳纤维编织物绷带为基材,聚乙烯薄膜为伤口监测的机械柔性和导电传感材料,该材料在激光烧蚀后呈网状结构,电化学性能得到改善,可以高效检测伤口处的尿酸浓度。Kassal等[21]将尿酸酶和普鲁士蓝修饰的碳电极丝网印刷到商业绷带上,利用尿酸酶分解尿酸后引起电化学信号变化的特点,开发了一种非接触式无线连接的新型绷带,用于检测伤口渗出液的尿酸浓度。这种基于电化学的方法是使用最广泛的一种测量生物代谢物的敷料,但测量时干扰因素较多,需要对生理代谢物做全面了解,避免因其他物质的干扰而影响测量结果,因为此种敷料的使用寿命较短,需降低其成本。
3.3 NO响应型敷料研究进展
NO是细胞中最小的脂溶性信使分子之一,由一氧化氮合酶(NOS)催化L-精氨酸生成。外伤环境内存在的NO可由各种皮肤细胞或炎症细胞中诱导表达的NOS合成。NOS可保障外伤后皮肤正常的上皮生成。适量的NO可促进细胞间信号传递、血管生成、成纤维细胞和内皮细胞等的增殖和分化,调节基质的沉积和重塑,形成创面胶原,增强组织力学强度[22]。NO释放量可以反映伤口愈合状态。正常皮肤的NO浓度为(0.27±0.07) μmol/L,低浓度(0.01~0.25 μmol/L)可刺激细胞分裂,而浓度高于0.5 μmol/L会促进炎症和细胞凋亡[23]。Shao等[24]开发了基于毛细管的微量等离子体系统,可调节血浆成分的微等离子,在低操作温度下处理皮肤伤口,试验结果表明,适度提高NO浓度可加快伤口愈合。
Muthuraj等[25]合成了一种新型的荧光素-吲哚和Cu2+探针的水凝胶敷料,研究发现,Cu2+的存在可更加灵敏高效地选择性检测NO,同时结合水凝胶敷料,可以使创面处于保湿的状态,促进伤口愈合,探针的存在使得感染可以被肉眼识别。但其荧光响应具有一定的时间依赖性,对NO的测量只可达到半定量水平而存在一些误差,因此仍需要做进一步改进。
4 创面细菌代谢物检测
4.1 细菌代谢物与伤口感染间的关联
大多数病原细菌会分泌毒力因子,如:黏附素可使细菌黏附到宿主组织上并形成生物膜,保护微生物的生长,使细胞能够在不利的环境中生存并自我分散;透明质酸酶、蛋白酶和脂肪酶等可以降解组织成分以允许深层组织渗透;α-溶血素和白细胞介素可以造孔;凝固酶能够逃避或抑制宿主免疫系统的膜蛋白,进一步造成组织损伤。细菌的严重定植是伤口感染并导致延迟愈合的重要原因,检测伤口细菌代谢物可直接反映感染情况[26]。
4.2 细菌生物膜响应型敷料研究进展
近些年来,随着对生物膜了解的不断深入,研究人员发现生物膜的主要成分是细菌及其营养物质和代谢产物形成的聚集体,可以为细菌特别是多重耐药细菌的生存和繁殖提供物质保证,因此细菌生物膜是一种重要的伤口感染标志物。现有方法中多用接有凝集素的荧光染料标记多糖或接有特异性序列的染料标记蛋白质来指示细胞外基质聚合物的结构及含量,或直接检测细菌含量。
水凝胶敷料保水率高、吸湿性能好,其可很好地贴合伤口。据报道,对于慢性伤口而言,非渗透性敷料比渗透性敷料更容易使伤口形成酸性分泌物,而酸性分泌物在体外研究中显示具有抑制细菌生长和促进成纤维细胞生长的能力。因此,为了更好地治疗慢性感染伤口,Thet等[27]将含有囊泡的荧光染料用琼脂糖混合并分散在水凝胶基质中,然后铺在纳米多孔聚碳酸酯膜上,当细菌数量达到临界设定阈值后,水凝胶薄层会产生黄色荧光。这种自动变色智能敷料可以让患者和医护人员及时发现伤口感染,并作为细菌严重定植的重要警示,是生物膜检测的间接手段。He等[28]设计了对近红外激光有很强的响应能力的中空金银纳米壳水凝胶,利用近红外的热效应,促进血管扩张和血液循环,从而促进伤口愈合。将光热效应结合高灵敏、高分辨率的表面增强拉曼散射成像技术,可以实现多功能诊疗一体化。
4.3 细菌代谢酶响应型敷料研究进展
当伤口感染时,多种细菌代谢酶促进了组织的分解,延长了炎症时间。对于酶的检测,常使用抗原抗体的方法,其具有特异性强、高效的特点。Xu等[29]制备了电化学免疫传感器,将载有万古霉素的磺化透明质酸封端剂的磁性介孔二氧化硅纳米粒子与磁性玻璃碳电极结合,根据其特异性抗原抗体结合引起的电化学信号的变化检测金黄色葡萄球菌的数量,当细菌释放透明质酸酶并分解透明质酸时释放药物。该传感器特异性强,可以作为检测细菌分泌酶的方法,但这种检测方法是在体内进行的。
除了利用传感集成系统外,还可以利用酶与光敏剂的作用对伤口感染作出响应。Zhou等[30]使用色氨酸对天然光敏剂三联噻吩醛进行改性,使其水溶性增加的同时降低光毒性,并将改性光敏剂填充到囊泡中,最后将囊泡负载水凝胶上,当发生细菌感染时,菌体所释放的酶会使荧光团裂解并释放到水凝胶中,在紫外灯下水凝胶会发出蓝色荧光。此水凝胶敷料对多重耐药致病菌的实时检测与治疗有一定的指导意义。
5 创面挥发性有机物检测
5.1 挥发性有机物与伤口感染间的关联
细菌在伤口处代谢时会产生不同的挥发性化合物(如乙醇、乙酸、氨、丙酮、乙醛、2-丁酮和丁酸),检查伤口周围的挥发性化合物浓度可以监测伤口感染处细菌类型和生长阶段。
5.2 挥发性有机物响应型敷料的研究进展
通过设计一系列的传感器阵列,研究人员将人体健康皮肤表面与受伤伤口的响应信号进行对比并消除背景气味,检测细菌释放的气体。传感器阵列作为气体检测中较优异的检测方法而被广泛应用。如Bailey等[31]将导电聚合物膜电化学沉积到基底上,并行使用金属氧化物传感器和导电聚合物传感器的混合阵列系统,可有效监测氨。基于电子鼻的伤口感染病原菌检测方法,不需要复杂的样本处理,可结合绷带使用,具有无创、高效、实时诊断的特点。
对于多种挥发性有机物的测量,干扰因素较多,检测困难,因此常使用电子鼻传感器或借助仪器。如Allardyce等[32]用离子流管质谱扫描识别样品中存在的化合物,通过检测多种细菌释放在伤口周围空气中的挥发性有机气体混合物,进行伤口感染监测与细菌鉴别。徐姗等[33]利用金属氧化物半导体传感器,采用径向基神经网络和独立分量分析相结合进行识别,可对多种气体进行检测,准确率高,适用于临床细菌检测,并可与敷料结合使用。这类多传感系统设计复杂,干扰因素较多,但仍有较大的发展空间。
6 结 语
大多数创伤患者在就医前伤口已经发生细菌严重定植,错过了最佳治疗时机,而医疗人员常依据一些局部特征进行经验治疗,治疗效果有限。因此,对感染伤口实时诊断和按需治疗的诊疗一体化敷料将很有市场,其可直观地向患者或医务人员提供反馈,促使伤口自主进入愈合进程或使并发症最小化,减轻患者的身体不适与经济压力。
从材料看,智能传感敷料基材可为传统敷料(绷带等)、生物敷料(自体皮、同种异体皮、胶原类等)、新型合成敷料(水凝胶、泡沫等)。
从功能看,新型敷料追求个性化诊疗。舒适性方面,要求敷料柔软、透气性好;灵敏度方面,要求快速精准监测,避免各监测指标干扰;诊疗方面,要求将生物成分、理化检测器、敷料及远程监控终端结合起来,实现实时监控、早期诊断和按需治疗的多重功能。
从现有产品看,高端可穿戴电子设备力求与生物传感器结合,可同时检测伤口多重指标。目前,设备小型化、皮肤刺激最小化和测量高效便捷化的可穿戴设备较少,亟待解决传感器灵敏度、产品稳定性、成本和使用舒适性等问题,属于该研究领域的热点和难点,因此开发智能可穿戴式敷料具有广阔的前景。
