microRNA-23b对Aβ25-35导致神经细胞凋亡的作用及机制研究
2021-09-14潘可萌高向东姚文兵
潘可萌,陈 松,高向东,姚文兵
(中国药科大学生命科学与技术学院江苏省生物药物成药性研究重点实验室,南京211198)
阿尔茨海默病(Alzheimer′s disease,AD)是一种主要发生在老年人中的神经系统退行性疾病,临床表现为进行性认知能力丧失,晚期出现老年性痴呆[1]。主要病理特征表现为β-淀粉样蛋白(βamyloid protein,Aβ)组成的老年斑(senile plaques,SPs),以及过度磷酸化的tau蛋白构成的神经原纤维缠结(neurofibrillary tangles,NFTs)[2]。AD发病机制尚不清楚,目前治疗AD的药物都只能在一定程度上缓解AD的症状,对于AD的神经元损伤无法有效地清除和阻断,并不能完全治愈AD[3]。随着人口老龄化加剧,AD患病人数逐年增长,至2020年,全球AD患病人数将近5 000万,给社会和家庭带来巨大负担[4]。因此,关于AD发病机制研究和药物研发刻不容缓。
微小RNA(microRNAs,miRNAs)是一种高度保守的小片段非编码RNA,在转录后水平调控基因的表达[5]。miRNAs在中枢神经系统中广泛分布,对神经发育、分化、成熟发挥重要作用[6-8]。microRNA-23b(miR-23b)位于人类9号染色体长臂9q22.32,在该位点上以基因簇形式表达[9],呈现高度保守,参与细胞增殖、生长、凋亡、分化、细胞黏附以及细胞迁移等多种生命活动[10-12]。已有研究显示在AD患者的额叶皮层中miR-23b的表达水平下调,并且可以作为评估AD的生物标志物[13-14],但其在AD中的具体作用及机制需要进一步研究。
本研究采用Aβ25-35建立AD样损伤细胞模型,探究在该模型下miR-23b对神经细胞凋亡情况的影响,并进一步研究凋亡相关蛋白和自噬相关蛋白表达水平的变化,从而在细胞水平上探讨miR-23b对Aβ25-35导致AD样神经细胞凋亡的保护作用及机制。
1 材料
1.1试剂
miR-23b(上海吉玛制药技术有限公司);Aβ25-35(中国吉尔生化有限公司);Lipofectamine 3000转染试剂、蛋白酶和磷酸酶抑制剂、蛋白预染Marker(美国Thermo公司);RIPA细胞裂解液、一抗稀释液、BCA蛋白浓度检测试剂盒、线粒体膜电位检测试剂盒(中国碧云天生物技术研究所);Annexin V-FITC/PI细胞凋亡检测试剂盒、ECL试剂盒(南京诺唯赞生物技术有限公司);PVDF膜(美国Millipore公司);DMEM高糖培养基、胎牛血清(美国Gibco公司);氨苄青霉素、链霉素、牛血清白蛋白(中国Biosharp公司);胰蛋白酶、MTT(美国Sigma公司);Bax抗体、Bcl-2抗体、β-actin抗体(中国Abclonal公司);LC3B抗体、Beclin-1抗体、HRP标记的山羊抗兔IgG(美国Cell Signaling Technology公司);p62抗体(中国Proteintech公司);其他试剂均为市售分析纯。
1.2仪器
二氧化碳细胞培养箱、高速冷冻离心机、全波长酶标仪(美国Thermo公司);电泳仪、转膜仪(美国Bio-Rad公司);多功能凝胶成像系统(中国Tanon公司);倒置荧光显微镜(日本Olympus公司);流式细胞仪(美国BD公司)。
1.3细胞
神经母细胞瘤细胞SH-SY5Y细胞株购自美国菌种保藏中心(ATCC)。
2 方法
2.1 细胞培养
SH-SY5Y细胞在含有10%胎牛血清的DMEM高糖培养基中贴壁生长,放置于37℃含有5%CO2的细胞培养箱中培养,待汇合度达到80%左右进行实验。
2.2 Aβ25-35寡聚体的制备
称量Aβ25-35粉末5 mg,加至双蒸水5 mL中充分溶解,超净台中进行过滤除菌,37℃恒温培养箱内老化4 d,BCA法测定Aβ25-35寡聚体浓度,-20℃保存。
2.3 Aβ25-35致SH-SY5Y细胞损伤模型的建立
待细胞培养瓶内细胞汇合度达到80%左右时,进行胰酶消化,收集密度为每毫升5×104个的SH-SY5Y细胞悬浮液,充分混匀后以每孔100µL铺在96孔细胞培养板中,放置于37℃含有5%CO2的细胞培养箱中培养。12 h后以梯度浓度8,4,2,1,0.5,0.25µmol/L的Aβ25-35孵育SH-SY5Y细胞24 h,进行MTT法检测细胞活性。MTT法具体步骤:每孔加入MTT 10µL,放置于37℃含有5%CO2的细胞培养箱中,4 h后弃去培养基,每孔加入DMSO 150µL后置于摇床上振摇使结晶物充分溶解。使用酶标仪检测:570 nm为检测波长,630 nm为参比波长,检测各孔内吸收度。
2.4 细胞转染
实验分为空白对照组、Aβ25-35+miR-23b NC组和Aβ25-35+mi R-23b转染组。收集状态良好的SHSY5Y细胞,以每毫升5×104个细胞的密度接种于6孔板中,放置于37℃含有5%CO2的细胞培养箱中培养,待每孔细胞汇合度达到80%左右进行实验。弃去每孔培养基,加入无血清opti-MEM培养基,2~3 h后开始转染。具体转染步骤如下:使用opti-MEM培养基稀释Lipofectamine 3000与mi R-23b,Lipofectamine 3000 3.75µL用opti-MEM 125µL稀释,使用opti-MEM培养基稀释miR-23b至50 nmol/L,将miR-23b与稀释的Lipofectamine 3000等体积混合,室温静置10 min,弃去孔内opti-MEM培养基,加入混合物,每孔总体积2 mL,孵育6 h后更换为含有1%胎牛血清的DMEM高糖培养基,孵育24 h后,采用浓度为0.5µmol/L的Aβ25-35损伤SH-SY5Y细胞;继续培养24 h进行后续实验。
2.5 Annexin V-FITC/PI双染法检测miR-23b及Aβ25-35对SH-SY5Y细胞凋亡的影响[15]
细胞分组及转染具体实验步骤见“2.4”项。收集每孔细胞培养液,预冷PBS洗涤细胞3次后弃去,使用不含EDTA的胰酶消化贴壁细胞,终止消化后收集细胞,预冷PBS洗涤细胞2次后弃去;加入1×结合缓冲液100µL,轻轻吹匀至单细胞悬液;分别加入Annexin V-FITC染色液5µL和PI染色液5µL,轻轻吹匀,避光,室温孵育10 min,加入1×结合缓冲液400µL,轻轻混匀,过筛网,置于冰浴中,流式细胞仪检测各组细胞荧光强度。
2.6 JC-1探针法检测miR-23b及Aβ25-35对SHSY5Y细胞线粒体膜电位的影响
细胞分组及转染具体实验步骤见“2.4”项。取适量JC-1(200×)探针,按照每50µL探针加入8 mL超纯水的比例进行稀释,剧烈涡旋使之充分混匀,再加入JC-1染色缓冲液(5×)2 mL充分混匀;弃去细胞培养液,使用预冷的PBS洗涤1次,每孔加入细胞培养基1 mL,再加入JC-1染色工作液1 mL,充分混匀,放置于37℃含有5%CO2的细胞培养箱中孵育20 min,弃去JC-1染色工作液,使用JC-1染色缓冲液(1×)洗涤2次,每孔加入无血清培养基2 mL,全程避光,荧光显微镜观察并拍照。
2.7 Western blot检测mi R-23b及Aβ25-35对SHSY5Y细胞Bax、Bcl-2、p62、LC3B、Beclin-1蛋白表达量的影响
细胞分组及转染具体实验步骤见“2.4”项。提取各组细胞内总蛋白,具体步骤为:细胞板置于冰上,弃去孔内培养基,预冷PBS洗涤细胞3次,每孔加入RIPA细胞裂解液(按1∶100的比例加入蛋白酶和磷酸酶抑制剂混合液)100µL;细胞刮刀刮取细胞收集于EP管中,每5分钟充分涡旋1次,共6次;置于高速冷冻离心机中,4℃,12 000 r/min离心20 min后收集上清液即为细胞总蛋白。蛋白制样后进行SDS-PAGE电泳,上样后80 V恒压电泳,湿转恒流转膜,5%脱脂奶粉封闭2 h后,TBST洗膜3次,每次10 min,4℃孵育一抗过夜;TBST洗膜5次,每次5 min,室温孵育二抗2 h后,TBST洗膜5次,每次5 min,ECL显色成像,检测目的蛋白水平。
2.8 统计分析
实验数据采用GraphPad Prism 8.0分析软件进行处理,各项指标以xˉ±s表示,来源于至少3次独立实验,以One-Way ANOVA检验进行组间比较,以P<0.05表明差异有统计学意义。
3 结 果
3.1 Aβ25-35致SH-SY5Y细胞损伤模型的建立
Aβ25-35作为毒性片段,使用浓度梯度为8,4,2,1,0.5,0.25µmol/L的Aβ25-35损伤SH-SY5Y细胞24 h后,MTT法检测细胞活性。结果如图1所示,Aβ25-35可损伤SH-SY5Y细胞活性,并且呈现一定的浓度依赖性。当0.5µmol/L Aβ25-35作用于SH-SY5Y细胞24 h时,与对照组相比,细胞损伤率约为30%,选取该浓度为Aβ25-35的造模浓度。

Figure 1 Effects of different concentrations of Aβ25-35 on SH-SY5Y cell viability(xˉ±s,n=6)**P<0.01,***P<0.001 vs control group
3.2 miR-23b对Aβ25-35致SH-SY5Y细胞凋亡情况的干预作用
采用Aβ25-35对SH-SY5Y细胞进行损伤并转染miR-23b,收集细胞进行Annexin V-FITC/PI染色,流式细胞仪检测各组细胞凋亡水平的变化。结果如图2所示,与对照组相比较,Aβ25-35损伤SH-SY5Y细胞后,凋亡细胞数量明显增多,而转染miR-23b后凋亡细胞数量显著减少,说明miR-23b能够改善Aβ25-35诱导的SH-SY5Y细胞凋亡水平。
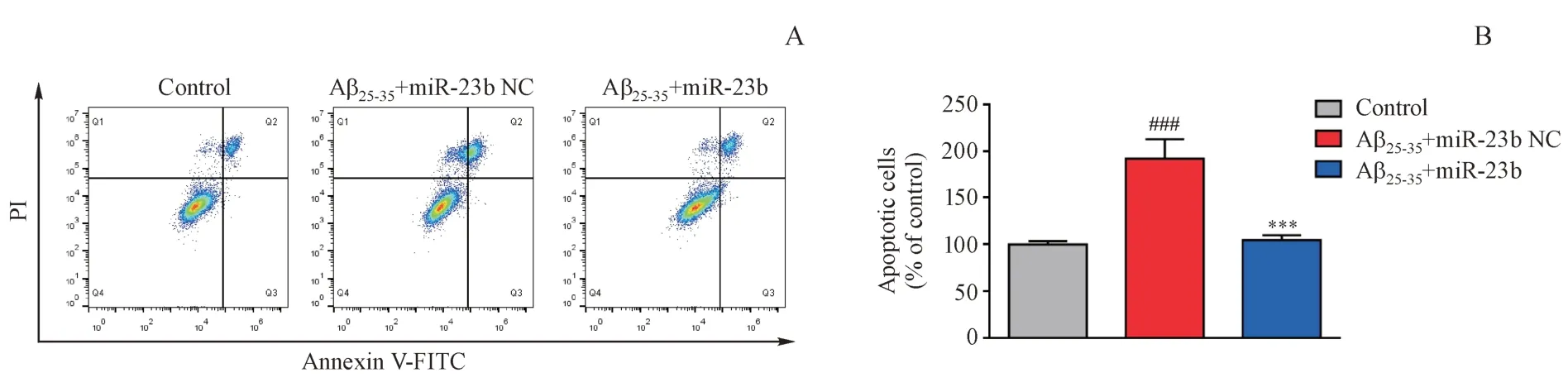
Figure 2 Effects of miR-23b and Aβ25-35 on apoptosis in SH-SY5Y cells(xˉ±s,n=3)A:Analysis of the apoptosis level of SH-SY5Y cells by flow cytometry;B:Quantification of the apoptosis level###P<0.001 vs control group;***P<0.001 vs Aβ25-35+miR-23b NC groupNC:Negative control
3.3 miR-23b对Aβ25-35诱导SH-SY5Y细胞内线粒体膜电位的影响
采用Aβ25-35对SH-SY5Y细胞进行损伤并转染miR-23b,JC-1检测试剂盒检测各组细胞线粒体膜电位情况。线粒体膜电位的下降说明细胞进入早期凋亡。当线粒体膜电位高时,JC-1形成聚合物,呈现红色荧光;线粒体膜电位低时,JC-1为单体形式,呈现绿色荧光。结果如图3所示,与对照组相比较,Aβ25-35损伤SH-SY5Y细胞后,细胞内绿色荧光较强,红色荧光减弱,说明Aβ25-35损伤神经细胞后线粒体膜电位降低;而转染miR-23b后细胞内出现较强的红色荧光,绿色荧光减弱,说明miR-23b能够缓解Aβ25-35诱导的SH-SY5Y细胞内线粒体膜电位异常。

Figure 3 Effects of miR-23b and Aβ25-35 on the mitochondrial membrane potential in SH-SY5Y cells(Scale bar:50µm)A:Fluorescence of mitochondrial membrane potential of SH-SY5Y cells;B:Quantification of the red/green fluorescence ratio(xˉ±s,n=3)###P<0.001 vs control group;***P<0.001 vs Aβ25-35+miR-23b NC group
3.4 mi R-23b对Aβ25-35诱导SH-SY5Y细胞内Bax、Bcl-2蛋白表达水平的影响
采用Aβ25-35对SH-SY5Y细胞进行损伤并转染miR-23b,Western blot检测各组细胞内Bax、Bcl-2蛋白表达水平。结果如图4所示,与对照组相比较,Aβ25-35损伤SH-SY5Y细胞后,SH-SY5Y细胞内促凋亡蛋白Bax表达量和抑凋亡蛋白Bcl-2表达量的比值显著上升,而转染miR-23b后促凋亡蛋白Bax表达量和抑凋亡蛋白Bcl-2表达量的比值明显下降,说明miR-23b可能通过调节Aβ25-35诱导SHSY5Y细胞内凋亡相关蛋白的表达水平,进而缓解神经细胞的凋亡。
3.5 miR-23b对Aβ25-35诱导SH-SY5Y细胞内p62、LC3B、Beclin-1蛋白表达量的影响
采用Aβ25-35对SH-SY5Y细胞进行损伤并转染miR-23b,Western blot检测各组细胞内p62、LC3B、Beclin-1蛋白表达量的变化。结果如图5所示,与对照组相比较,Aβ25-35诱导SH-SY5Y细胞损伤后,SH-SY5Y细胞内p62蛋白水平上升,LC3B-II/LC3B-I比值下降,Beclin-1蛋白水平下降,而转染miR-23b后能在一定程度上缓解Aβ25-35诱导SHSY5Y细胞内自噬相关蛋白水平表达的异常,说明miR-23b可能同时影响自噬相关蛋白的表达量,最终缓解神经细胞的凋亡。

Figure 5 Effects of miR-23b and Aβ25-35 on the protein levels of p62,LC3B and Beclin-1 in SH-SY5Y cells(xˉ±s,n=3)A:Detection of protein levels of p62,LC3B and Beclin-1 by Western blot;B,C,D:Quantitative analysis of protein levels of p62,LC3B-II/LC3B-I and Beclin-1##P<0.01,###P<0.001 vs control group;***P<0.001 vs Aβ25-35+miR-23b NC group
4 讨 论
AD主要发生在老年人群中,中国作为老年人口数量增长较快的国家,目前AD患病人数已经达到950万,60岁以上老人的平均患病率为5.4%[16]。然而AD发病机制复杂,目前尚未研究出针对AD的有效治疗药物[17]。miRNAs作为一种内源性小片段非编码RNA,能够与特定mRNA的3′UTR非编码翻译区靶向结合从而导致mRNA的降解或抑制翻译过程,最终调控基因转录后翻译表达[18]。miR-23b定位于9号染色体上,属于miR-23b/27b/24-1家族,其可靶向不同的蛋白从而在多种疾病中发挥作用[19-21]。已有研究显示在AD患者的额叶皮层中miR-23b的表达水平下调,并且可以作为评估AD的生物标志物[13-14]。然而,miR-23b在AD中的具体作用以及分子机制还有待进一步研究。在近几十年的研究中普遍认为Aβ的异常积累可能是导致AD的发病机制之一[22-23],Aβ聚集形成纤维化沉积,进而形成β淀粉样斑块最终引发突触损伤、tau蛋白异常磷酸化、胆碱能丢失、氧化应激和神经炎症等细胞损伤[24]。Aβ25-35因其能够迅速聚集,产生较强的神经毒性[25],诸多研究使用Aβ25-35建立AD模型[26]。同时SH-SY5Y细胞作为人类神经母细胞瘤细胞,其形态、神经化学和电生理特性与神经元相似[27],因此本研究采用Aβ25-35诱导SH-SY5Y神经细胞建立AD细胞损伤模型,探索miR-23b对SH-SY5Y神经细胞活性的影响。结果表明在24 h内,Aβ25-35对SH-SY5Y细胞活性损伤呈现一定的浓度依赖性,以浓度为0.5µmol/L的Aβ25-35诱导SH-SY5Y神经细胞建立AD样细胞损伤模型,给予miR-23b后能够缓解Aβ25-35所致神经细胞凋亡。说明miR-23b对AD样细胞模型发挥一定的保护作用。
凋亡作为生物体内细胞自主消亡的过程,对机体组织发育和体内环境平衡至关重要[28]。诸多研究显示凋亡参与多种主要的神经系统退行性疾病,包括AD、肌萎缩侧索硬化症、帕金森病和亨廷顿病等[29]。自噬作为一种选择性降解途径,通过降解细胞内受损的细胞器、蛋白质,提高细胞应对各种应激挑战的能力[30]。正常情况下细胞凋亡与自噬过程相互平衡,维持细胞内稳态,但在神经系统退行性疾病中凋亡与自噬平衡被打破[31-32]。本研究发现miR-23b可以缓解Aβ25-35导致的神经细胞内异常的线粒体膜电位,同时miR-23b显著改善Aβ25-35引起的异常的凋亡相关蛋白和自噬相关蛋白水平,说明miR-23b可能同时影响凋亡相关蛋白和自噬相关蛋白从而缓解神经细胞的凋亡,最终对Aβ25-35损伤的SH-SY5Y细胞发挥保护作用。本研究为防治AD提供了新的潜在靶点,为AD药物研发提供了新思路。
