创伤凝血病的诊疗进展
2021-09-14陈国芬彭国璇任廷果
陈国芬,彭国璇,任廷果,邓 进
1.贵州医科大学,贵阳 550004;2.贵州医科大学附属医院急诊科,贵阳 550004
创伤性凝血病(trauma induced coagulopathy,TIC)指严重创伤打破了机体凝血及纤溶系统的平衡,形成以出血量增加、出血及血栓形成风险增高为特点的凝血障碍性疾病[1],其影响因素多、发生机制复杂,各因素之间可相互协同促进,易合并“酸中毒、低体温”构成致命三联征[2],进一步促使病情恶化。数据表明,合并创伤性凝血病患者的死亡风险较高,是创伤死亡患者4~6倍,死亡比例占30%~40%[3-4]。早期识别其危险因素,并采取积极的综合处理措施是成功救治TIC的关键,因此本文综述了近年来TIC影响因素及诊疗进展,以期提高临床医师对TIC的早期识别能力,尽早对相关危险因素进行干预,降低患者病死率[5],改善其预后。
1 TIC的影响因素
凝血功能障碍是使严重创伤患者病情进一步加重的主要因素之一。近几年相关研究表明组织损伤、低体温、酸中毒、休克、血液稀释和消耗、炎症反应等危险因素与其发病过程密切相关[6-7],是TIC发生的影响因素。研究表明[8],创伤时热量丢失,产热减少和输液可导致体温过低,当多发伤患者机体体温在35℃时,凝血因子的活性均下降,当体温为32℃时,FⅪ、FⅫ的活性分别下降至17%、32%。另外,当患者发生酸中毒,pH<7.4时,血小板的功能和结构会发生改变、凝血因子活性降低、凝血酶产生受损、纤维蛋白原降解增加等,从而导致凝血功能异常,引起创伤性凝血病。休克引起机体交感神经系统兴奋,释放儿茶酚胺导致血管内皮细胞损伤而引起凝血功能障碍,因此对于合并颅脑损伤的患者,收缩压需达到110mmHg,其他部位损伤的患者,收缩压需达到90mmHg。颅脑损伤及格拉斯哥昏迷指数(GCS)≤6分、创伤严重程度评分(ISS)是TIC发生的独立危险因素[9],因此,临床工作者可以通过其相关危险因素对患者实施针对性的预后治疗,降低TIC的发生率,从而提高严重多发伤患者的生存率。
2 TIC的发病机制
发病过程涉及全身多个系统及凝血系统的多个方面。本综述从影响该病发生相关因素总结了其发病机制,各因素之间相互作用使凝血因子、血小板及纤维蛋白原等数量及功能发生异常,打破机体凝血、纤溶、抗凝的平衡,最终表现为TIC[10]。
2.1组织损伤 严重创伤导致机体组织受损,从而引起血管内皮细胞损伤,启动凝血、纤溶过程,是发生凝血功能障碍的基础[6-7]。严重的组织损伤可以通过细胞和体液机制消耗大量凝血因子及纤维蛋白溶解系统过度激活,从而造成凝血系统功能紊乱[11]。当血管内皮细胞受到损伤后内皮下的胶原蛋白Ⅲ被暴露并释放组织因子(tissue factor,TF),结合von Willebrand因子、血小板及Ⅶ因子等启动外源性凝血途径。组织损伤也可以通过活化蛋白C而影响相关凝血因子的活性,导致APTT/PT延长,降低血凝块的硬度,出血时间延长,同时合并酸中毒、血液稀释、低体温等危险因素,创伤早期形成以低凝高纤溶状态为主要特点的凝血功能紊乱[12]。另外,血管内皮损伤后可释放大量组织型纤溶酶原激活物增强纤溶功能使纤溶亢进[13],当纤溶亢进时,纤溶酶原系统被激活,血浆中纤维蛋白原和纤维蛋白被水解,抗凝作用增强,具有活性的纤溶酶对凝血因子Ⅱ、Ⅴ、Ⅷ、Ⅹ、Ⅻ等也有一定的降解作用,最终导致凝血功能显著下降,出血量增加,加重凝血功能障碍。相关报道显示组织损伤程度越重、ISS越高,TIC发生率越高[14-15],纤溶亢进是创伤早期凝血功能紊乱的主要特点,好发于病情进展迅速且没有得到及时有效控制的创伤患者[16]。
2.2低体温 严重创伤患者发生低体温的影响因素较多,如当多发伤患者发生低血容量性休克时,机体组织摄氧及氧利用能力降低,无氧酵解导致机体产热能力减弱,出现低体温[16]。低体温时氧消耗量及基础代谢率会出现显著降低,凝血因子活性、凝血酶活性及反应速率均受到抑制,纤溶亢进,从而延长出血时间,加重凝血功能障碍[17-19]。低体温还可引起血小板释放肝素样物质,增强抗凝作用,引起凝血功能障碍[20]。此外,创伤患者出现低体温引发交感神经兴奋,抑制凝血途径,进而增加凝血功能障碍的风险[21]。
2.3酸中毒 严重创伤患者易并发酸中毒,机体大出血造成全身组织低灌注,机体氧运输能力减弱,摄氧及氧利用量减少,细胞、组织无氧代谢增强,红细胞代谢产物增加等最终导致乳酸堆积,过重的乳酸负荷破坏了人体酸碱缓冲系统,酸中毒抑制凝血酶活性,导致凝血酶生成减少,影响血凝块的形成,机体发生代谢性酸中毒还可以引起血小板功能下降、抑制各种凝血因子活性、促进纤维蛋白原的降解等最终导致酸中毒性凝血病,并且据报道,酸中毒越严重,凝血块形成时间越长[22]。
2.4休克 创伤性休克(traumatic shock,TS)患者在入院时常伴发创伤性凝血病(trauma induced coagulopathy,TIC)[23]。创伤患者发生失血性休克合并组织低灌注时,激活血栓调节素-蛋白C通路启动全身抗凝系统,增强纤维蛋白溶解活性,引起凝血功能紊乱[24]。组织低灌注还可导致血管内皮细胞受损,从而释放血栓调节蛋白(thrombomodulin,TM)与凝血酶结合,抑制其活性,导致纤维蛋白生成减少,减弱凝血过程;血栓调节蛋白-凝血酶复合物同时还可以激活蛋白C途径,抑制纤溶酶原激活物抑制剂的活性,导致纤溶亢进的发生。
2.5凝血因子的消耗与稀释 创伤患者大量失血后,组织间液向血管内转移,大量纤维蛋白沉积和血小板聚集于毛细血管、小动脉及小静脉形成广泛的微血栓,导致纤维蛋白及血小板消耗性减少,循环功能和其他内脏功能障碍。创伤导致血管损伤出血,体内大量凝血因子及血小板直接丢失导致消耗性凝血病[25],创伤早期,机体处于低凝高纤溶状态,出血风险高,创伤48h以后由于纤溶抑制导致机体呈高凝状态,严重者易发展为DIC[26]。严重创伤失血患者大量输血、输液会过度稀释体内凝血因子,同时补充的胶体液可干扰血小板的功能,最终导致凝血功能和纤溶系统状态改变,影响纤维蛋白原的交联而使患者发生凝血功能障碍及出血,临床上称为稀释性凝血病[27-29],输液越多,稀释性凝血病风险越大,凝血因子稀释越多,凝血功能障碍及出血程度越重。
2.6炎性反应 凝血过程与炎症反应之间可相关联,创伤或出血时可引起促炎和抗炎因子、趋化因子、损伤相关模式分子的迅速大量释放以及补体途径的激活[30]。促炎因子可使血液中单核细胞和内皮细胞的组织因子数量增加,补体上调血栓调节蛋白(thrombomodulin,TM)表达与凝血酶结合形成TM-凝血酶复合物,可抑制纤维蛋白原的活化,使纤维蛋白生成减少,抑制血栓的形成及强度,还可以使蛋白C和血小板活化增强[31]。活化的蛋白C(activated protein C,APC)可抑制Va、Ⅷa因子的功能,激活抗凝系统导致凝血功能紊乱,被活化的血小板能释放大量炎症介质诱发免疫反应。凝血酶的激活过程可引起炎症反应,炎症反应可加重凝血功能障碍,导致内皮细胞损伤,内皮细胞受损及内皮细胞糖萼脱落释放的类肝素物质诱导了内源性肝素化,引起血液低凝状态,加重出血[32-33]。
3 TIC的诊断标准
目前TIC的诊断标准在国际上尚无统一定论,现临床上主要采用常规凝血实验(conventional coagulation tests,CCTs)及血栓弹力图仪(thrombelastography,TEG)两种常用的检测手段诊断TIC。TEG测定可以动态监测凝血过程[34],是反映血液凝固动态变化的指标,在指导临床用血方面具有积极作用[35-37]。通过TEG测定能够更早期诊断急性创伤性凝血功能障碍,TEG于创伤6h即可诊断TIC,CCTs为12h,且两者诊断TIC的结果一致。
据文献报道[38],如表1所示:各实验室指标中,总分≥5即诊断为TIC。如表2所示:采用TEG对TIC进行诊断,总分≥2分即诊断TIC。以上两种诊断标准在相关文献中也用于DIC的诊断。相关专家共识TIC的诊断标准为[39]:实验室标准(符合其中一项):(1)PT>18s;(2)APTT>60s;(3)TT>15s;(4)PTr>1.6;(5)需要血液制品或替代疗法的活动性或潜在性出血;(6)有明确创伤史。也有相关文献报道,TEG参数中血栓最大振幅(MA)和凝血指数(CI)比其他参数诊断价值高,MA<52.9mm或CI<-1.0可作为诊断TIC的阈值,而凝血反应时间R值指导输血的意义较大[40]。
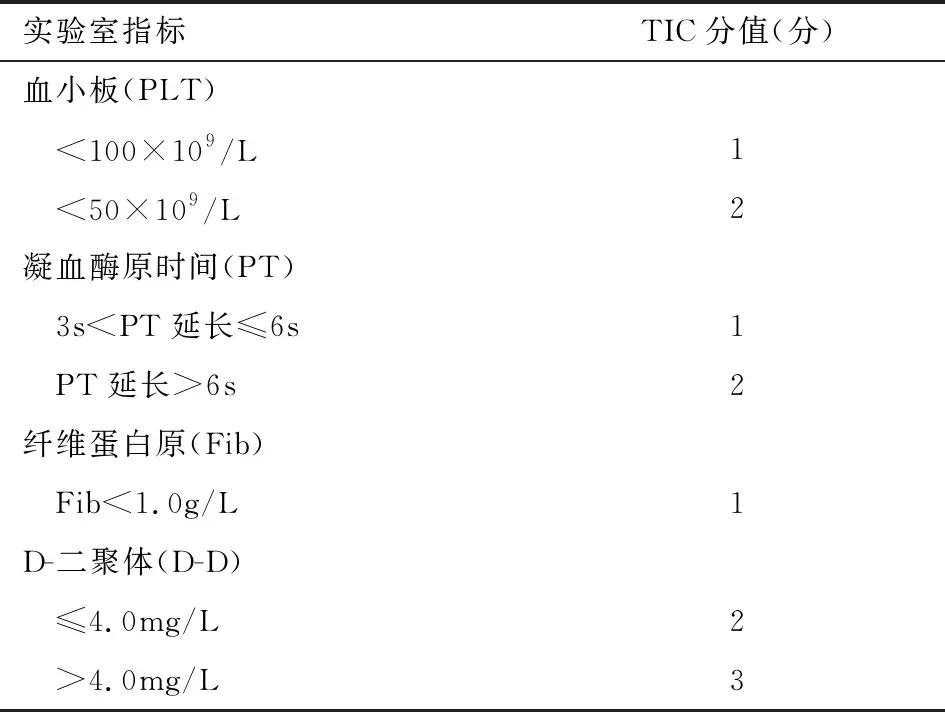
表1 血小板、凝血功能指标对TIC的诊断标准

表2 血栓弹力图(TEG)对TIC的诊断标准
4 TIC的救治
严重创伤患者的救治可总结为院前急救、抢救室处理、专科中心治疗、创伤中心急性处理等四个阶段。其中,及时止血、复苏是预防凝血病发生、降低患者病死率、改善预后的关键措施。在美国PROPPR研究的亚组分析中显示,尽早止血可以降低患者病死率和并发症发生率,控制出血或纠正凝血病所需的时间每减少15min,就能有效降低患者病死率和多器官功能衰竭风险[41]。
4.1早期复苏和止血 TIC治疗关键是及时止血、复苏预防凝血病的发生,目前广泛受临床关注的是损害控制复苏(damage control resuscitation,DCR)策略,DCR应用于TIC患者能促进休克恢复,改善凝血功能,减少并发症[42]。DCR为新型液体复苏方案,强调止血性复苏、低压复苏、限制性液体复苏三大复苏原则,被广泛应用于临床急诊救治中[43]。虽大量补液可快速恢复血压、维持机体脏器血液灌注量,但因血压升高速度过快可导致再灌注损伤[44],同时大量补液可稀释血液中凝血因子,导致继发性的DIC[42]。在严重创伤患者的早期,尽快有效止血是关键,用最快的速度控制出血在阻断“致命三联征”方面有举足轻重的意义,可在患者转运过程中开始进行止血复苏。近年来由于损害控制外科策略的发展,避免失血性休克危及患者生命,要求在最短时间内以最简单的方法进行有效止血,必要时可借助介入止血等,而在现场急救处理中,有效止血方法有手动止血、绷带及无菌敷料加压包扎止血、伤口填充、骨盆及四肢绷带固定、止血带止血等。DCR策略:在严重出血控制之前,对于无颅脑损伤患者,可将收缩压维持在80~90mmHg,平均动脉压(MAP)维持在50~60mmHg,合并严重颅脑损伤(GCS≤8分)的失血性休克患者,平均MAP≥80mmHg以保证脑灌注。
4.2组织氧合、液体管理和维持体温 严重创伤合并失血性休克时应进行严格的液体管理,为避免酸中毒的发生,需保证终末器官的血流灌注,改善组织器官的微循环维持组织氧合,减轻器官功能损伤,确保机体血液灌注及氧利用量。为避免高氯性酸中毒及加重凝血功能紊乱,首选液体为晶体液,慎用高渗液体及胶体液。由TIC发生机制可知,低体温对凝血病的发生影响及其重要,是“致命三联征”之一,同样可危及患者生命,及时复温可有效预防创伤患者并发症及降低患者病死率,临床上复温主要有快速复温及缓慢复温,快速复温主要有持续性血液透析治疗、温盐水灌洗、输入液体加温等,快速复温效果好,但后期易并发水电解质紊乱、心脏骤停等,缓慢复温方法主要是复温毯,并发症较少,因此在快速复温的同时要及时处理并发症。
4.3凝血功能的管理 (1)相关报道显示,创伤早期(伤后3h内)使用氨甲环酸 (tranexamic acid,TXA)治疗可使创伤患者出血发生率降低15%,总病死率降低约10%,而且血栓形成风险不会增加[42]。对出血量大及有大出血风险的患者尽早使用氨甲环酸1g静脉推注(至少10min),持续8h再静脉注射1g,可降低出血风险,改善预后,同时应在抗纤溶治疗的基础上联合纤维蛋白原替代治疗并维持FIB水平在1.7g/L以上[42]。(2)据报道[45],对于大出血或存在大出血风险以及急危疑难重症患者早期使用维生素B6联用丰诺安新疗法能快速恢复机体与肝内酶代谢,促使凝血因子的产生和内源性凝血途径的快速恢复,达到逐步止血的疗效,为创伤性凝血病患者争取关键性治疗的时间,及时挽救危重症患者的生命。(3)重症患者血钙容易降低,且大量输血进一步促使血钙丢失,故应适当补充钙剂并监测血浆钙离子浓度,使其维持在正常水平范围内。(4)建议对出血量大的患者尽早补充血液制品溶液,根据凝血功能监测结果调整血液输注成分,以补充足够的凝血因子。(5)重组活化人凝血因子Ⅶ:对创伤性凝血病患者注射凝血因子治疗可以改善患者凝血功能,缩短住院时间,减少输血量,总体治疗效果好,值得在临床上推广应用[46],但有可能增加患者并发血栓的风险,所以在危急时刻,建议作为“最后手段”谨慎使用。(6)对服用抗血栓药物患者合理运用拮抗药物。(7)注意血液高凝状态及血栓形成,预防并发症的发生。
5 展望
目前TIC患者的诊疗仍存在一些问题,对相关影响因素的认识不够全面、诊断尚无统一标准、综合救治能力不强等,导致多发伤患者致死率、致残率远远高于世界发达国家。而创伤后凝血功能障碍又使病情加重,增加了疾病救治的难度,使患者病死率进一步增高。提高TIC患者救治成功率仍是目前创伤急救领域的研究重点、难点问题。对于TIC的危险因素,需要早期干预,尽早监测相关指标,对伤情及危险因素充分评估,规范诊断和治疗过程,采取积极、合理的综合治疗措施,以提高临床救治成功率。