复合益生菌粉对小鼠免疫机能的影响研究
2021-09-13黄蕊蕊刘文正李亚楠
黄蕊蕊 刘文正 李亚楠
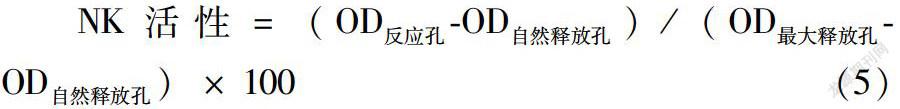

摘 要:目的:研究复合益生菌粉在增强免疫力功能方面的作用。方法:采用经口灌胃给予方式,设受试物组3组,分别为低、中、高剂量组,同时设阴性对照组(生理盐水),从小鼠体重指标、细胞免疫、体液免疫、单核—吞噬细胞活性、NK细胞活性等方面综合评价复合益生菌对小鼠体内免疫机能的影响。结果:与空白对照组相比,中、高剂量下的益生菌粉组中的小鼠抗体生成细胞数显著增加(P<0.05);低、中、高剂量益生菌组中的小鼠碳廓清功能显著提高(P<0.05);高剂量组的NK细胞活性比对照组有显著性提高(P<0.01)。不同剂量的益生菌给予期间,均未见益生菌粉对小鼠体重、脾脏/体重比值、胸腺/体重比值、足趾肿胀度、淋巴细胞增殖能力、半数溶血、巨噬细胞吞噬鸡红细胞能力有影响。结论:该复合益生菌粉能够增强体液免疫、单核—吞噬细胞活性和NK细胞的活性,具有一定的免疫增强功能。
关键词:益生菌粉;免疫机能;小鼠
近年来,益生元一直是国内外研究的热点,其功能和作用机制备受关注。许多研究发现,益生元在调节肠道菌群、预防慢性病、提高机体免疫力等方面具有一定的作用,是良好的免疫激活剂,不仅可以改善宿主肠道微生态平衡,还可以改善肠道黏膜表面的屏障功能,影响免疫代谢。益生元的摄入导致肠道微生物改变而发出的刺激信号可使各种免疫细胞信号通路改变,以促进免疫细胞的活化和免疫功能的产生,其中增强吞噬细胞功能现已广泛用于人类和动物保健与疾病预防治疗过程中[1-7]。已发现多种特异性益生菌菌株可增强先天性免疫反应,特别是吞噬活性和NK细胞杀伤活性,其中,双歧杆菌能够增强免疫球蛋白(IgA)的分泌,促使小肠粘膜上的淋巴细胞的分化及增殖[8],并激活自然杀伤细胞(NK)和巨噬细胞,生成白介素1(IL-1)、白介素6(IL-6)、白介素12(IL-12)、肿瘤坏死因子ɑ(TNF-ɑ)及干扰素Y等细胞因子,激活肠粘膜免疫系统,调节机体的免疫应答,进而增强机体免疫力[9]。植物乳杆菌不仅能够增强NK细胞的活性,在进入机体后激活肠黏膜免疫系统,还可作为一种外源性的营养素介导巨噬细胞的极化,起到抗突变和防癌、预防糖尿病和心血管疾病的作用[10-11],而益生元不仅能够刺激摄入益生菌的生长,还能够刺激结肠中固有益生菌的生长,提高机体免疫力,因此,益生菌和益生元组合对健康影响的机制更为复杂。基于益生元的多样性功能,虽然研究已经证实了其免疫保护增强的作用[12],但随着益生菌个性化精准补充的倡导,益生元与免疫系统的整体作用及其剂量依赖性有待进一步研究。
综上,对益生元及其对免疫功能影响的深入研究可为其功能的拓展应用积累数据,但目前针对复合益生菌粉特异性免疫的研究尚不完善。因此,本实验研究该实验条件下不同剂量的益生菌对增强小鼠免疫功能的影响,为益生菌微生态制剂产品的合理应用提供科学依据。
1 材料与方法
1.1 样品
益生菌粉:复合益生菌产品,本实验所用益生菌粉主要是由植物乳杆菌Lp90、长双歧杆菌BL21、嗜酸乳杆菌LA85和菊粉、低聚果糖等复配混合制成的,产品每袋含植物乳杆菌Lp90 1.0×107 CFU、长双歧杆菌BL21 1.0×107 CFU、嗜酸乳杆菌LA85 1.0×107 CFU,菊粉0.28 g、低聚果糖0.22 g。产品规格:2 g/袋,推荐食用方法和用量:每日2次、每次1袋。保存條件:密闭、置于干燥阴凉处,冷藏保存效果更佳,保质期:6个月。
1.2 实验动物
本实验中的SPF级雌性ICR小鼠由北京维通利华实验动物技术有限公司提供,共240只,其中60只,体重18~22 g,将小鼠随机分为4组,每组15只,分别进行免疫机制的研究实验,包括迟发型变态反应试验、脏器/体重比值、半数溶血值测定和抗体生成细胞能力、碳廓清试验、巨噬细胞吞噬鸡红细胞能力、ConA诱导小鼠淋巴细胞转化试验和NK活性测定等实验。
1.3 主要仪器与试剂
主要仪器:分析天平,冷冻离心机、生物安全柜、涡旋仪,二氧化碳培养箱、酶标仪、恒温水浴锅、倒置显微镜等。主要试剂:绵羊红细胞(SRBC)、鸡红细胞、0.9% NaCl 溶液、Hanks液(pH7.2)、RPMI1640培养基、FBS(血清)、双抗、刀豆蛋白A(ConA)、1%冰醋酸、YAC-1细胞、(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐、PBS、补体、SA缓冲液、碘硝基氯化四氮唑、吩嗪二甲基酯硫酸盐、氧化型辅酶I、印度墨汁、0.1%Na2CO3、Giemsa染液等。
1.4 剂量选择与受试物饲喂方式
益生菌粉的推荐成人每日摄入量为4 g/60 kg BW。本实验设定低、中、高剂量设为人体推荐摄入量的5、10、30倍,即0.333、0.667、2.000 g/kg BW,其中去离子水作为空白阴性对照组。称取0.333 g、0.667 g、1.000 g分别用去离子水定容至20 mL,各剂量组及阴性对照组均按20 mL/kg BW灌胃给药,连续给予受试物30 d,每周根据体重调整灌胃量,活杀小鼠并测定各项免疫指标。
1.5 实验方法[13]
1.5.1 小鼠脏器/体重比值测定实验[13] 将给与不同剂量益生菌粉的小鼠进行称重,处死后解剖得到脾脏和胸腺,置于生理盐水中洗去血液,并用滤纸吸干表面残留的血水,称重,计算脾脏/体重比值和胸腺/体重比值。
1.5.2 足趾增厚法(DTH)测定迟发型变态反应[13]取新鲜的羊血,玻璃棒沿同一方向搅拌去除纤维后,用生理盐水洗涤3次(2 000 r/min,10 min)后分别稀释至20%和2%(v/v)。于小鼠腹腔中注射2%的SRBC 0.2 mL,注射4 d后,精确测量小鼠的左后足趾厚度。然后在测量部位局部注射20% SRBC 20 μL,24 h后观察并精准测量左后足趾厚度,以注射前后小鼠足趾厚度的差值,即足趾肿胀度来表征DTH的程度。
1.5.3 ConA诱导的小鼠淋巴细胞转化实验[13] 将处死的小鼠置于75%酒精中灭菌10 min,无菌环境下取出脾脏,并加入灭菌后的Hanks液清洗3次,每次1 000 r/min离心10 min,计数活细胞数,调整细胞浓度为2*107个/mL,每孔加入0.2 mL细胞悬液,再加入培养基至1 mL,其中一孔中加入75 μL ConA液(7.5 μg/mL),另一孔作为空白对照,继续培养72 h。培养结束前4 h,弃掉上清液,并加入新鲜的 RPM1640不完全培养基,同时加入MTT(5mg/mL)50 μL,继续孵育4 h。结束后去掉上清液,每孔加入1 mL异丙醇,震荡溶解后,置于酶标仪上测定吸光度(570 nm)。
淋巴细胞的增殖能力=OD加ConA孔-OD不加ConA孔
1.5.4 改良玻片法检测抗体生成细胞[13] 取新鲜的羊血,玻璃棒沿同一方向搅拌去除纤维后,用生理盐水洗涤3次(2 000 r/min,10 min)后稀释至2%(v/v)。于小鼠腹腔中注射2%的SRBC 0.2 mL,4 h后,取出脾脏,制成单细胞悬液,并調整浓度至2*107个/mL,待用。将1 mL压积SRBC加入5 mL小鼠血清中,4℃下放置30 min,多次震荡,离心取上清,作为补体,待用。将表层培养基置于45 ℃保温,与等体积2倍浓度的Hank’s液混匀后,分装于试管中,每管加入0.5 mL,再加入10%(v/v)SRBC 50 μL和脾单细胞悬液20 μL,放入培养箱中继续孵育1.5 h,然后加入补体,置于玻片凹槽内,培养2.0 h后,计数溶血空斑数。
1.5.5 血清溶血素溶血值的检测[13] 取新鲜的羊血,玻璃棒沿同一方向搅拌去除纤维后,用生理盐水洗涤3次(2 000 r/min,10min)后稀释至2%(v/v)。于小鼠腹腔中注射2%的SRBC 0.2 mL,4 h后,摘眼球取小鼠血液于离心管中,静置1 h后,2 000 r/min离心10 min,收集上层血清。将血清稀释300倍后取 0.1 mL,置96孔板内,依次加入10%(v/v)SRBC 0.05 mL,补体0.1 mL,置于37 ℃水浴30 min后,置于冰上终止反应。1 500 r/min离心10 min,取上清液0.05 mL,加文齐氏试剂0.15 mL,同时,取10%(v/v)SRBC 0.0125 mL,加文齐氏试剂至0.2 mL,作为空白对照。用酶标仪(540 nm)测定各孔的吸光度。溶血素的量以半数溶血值(HC50)表示,按式(1)计算:
样品HC50=(OD样品/ODSRBC半数溶血)×稀释倍数(1)
1.5.6 小鼠碳廓清试验[13] 将印度墨汁用生理盐水稀释4倍后尾静脉注入小鼠体内,在注射墨汁后2 min和10 min,从小鼠眼内呲静脉丛取血20 μL,加到2 mL 0.1% Na2CO3溶液中,用酶标仪在600 nm波长处测定吸光度值,以Na2CO3溶液作空白对照。将小鼠进行称重后处死。取出肝脏和脾脏,置于生理盐水中洗涤后,滤纸吸干表面残留血污称重。按式(2)计算吞噬指数(a):
1.5.7 小鼠腹腔巨噬细胞吞噬鸡红细胞实验[13] 经小鼠腹腔注射5%的鸡红细胞悬液1 mL,2.5 h后,处死小鼠,仰位,注射生理盐水洗液2 mL至小鼠腹腔,转动小鼠1 min后,吸出生理盐水洗液1 mL,分别均匀的滴于2片载玻片上,移至37℃孵箱中孵育30 min。然后用生理盐水漂洗载玻片后干燥。在丙酮甲醇溶液(1:1)中固定后,用4%的Giemsa-磷酸盐缓冲液进行染色3 min,漂洗晾干。油镜下计数,通过观察巨噬细胞的形态,按式(3)~(4)计算。
吞噬率(%)[13]=吞噬鸡红细胞的巨噬细胞数/总巨噬细胞数×100(3)
吞噬指数[13]=被吞噬的鸡红细胞总数/总巨噬细胞数(4)
1.5.8 乳酸脱氢酶LDH法测定NK细胞活性[13] 将靶细胞YAC-1培养24 h后,弃掉上清,清洗3次后,消化收集制成细胞悬液(4*105个/mL)。小鼠处死后置于75%乙醇中灭菌,无菌条件下取脾,制成脾的单细胞悬液,作为效应细胞。然后用台盼蓝活细胞染色计数,调整效应细胞的浓度为2*107个/mL,效靶比为50:1。取靶细胞和效应细胞溶液各100 μL,加入U型96孔板中,其中靶细胞自然释放孔中仅加靶细胞100 μL和培养液100 μL,靶细胞最大释放孔加靶细胞100 μL和1%NP40 100 μL,均设3个平行孔,培养4 h后,离心5 min,吸取上清100 μL置于新的96孔板中,加入LDH基质液100 μL,避光反应10 min后,加入HCL溶液(1mol/L)30 μL终止反应,在492 nm处测定吸光度值。按式(5)计算NK活性:
NK活性=(OD反应孔-OD自然释放孔)/(OD最大释放孔-OD自然释放孔)× 100(5)
1.6 数据统计
数据用平均值±标准差表示,应用统计软件SPSS 10.0进行t检验及相关分析。
2 结果与分析
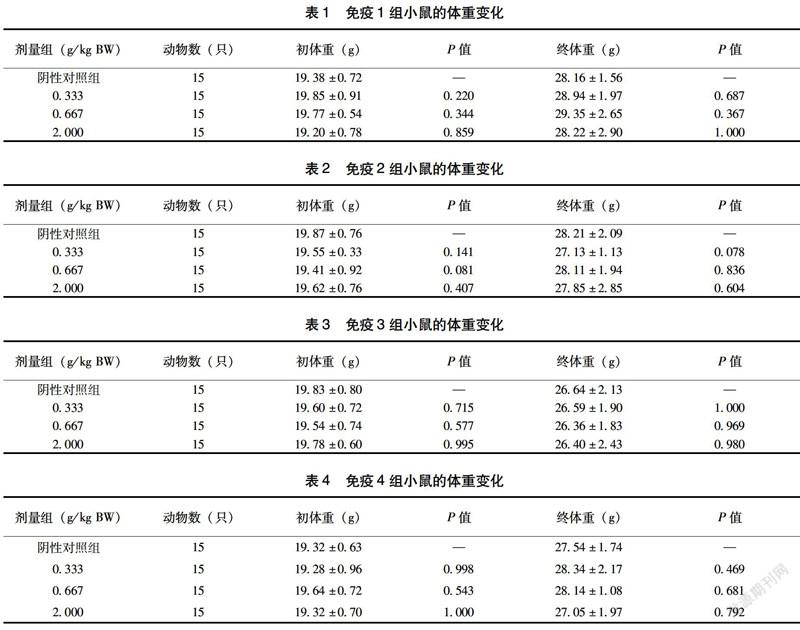
2.1 益生菌粉对小鼠体重的影响
饲喂益生菌粉期间,小鼠活动正常,生长发育良好,未观察到异常体征或死亡,由表1~4可见,小鼠在摄入不同剂量的益生菌粉30 d后,经统计学分析,其体重在各剂量组与对照组间比较无显著性差异(P>0.05),均表明体重增长正常,该益生菌粉长期口服安全性良好。
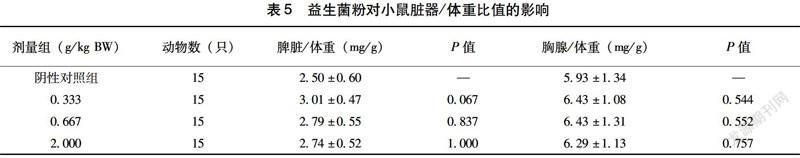
2.2 益生菌粉对小鼠脏器/体重比值的影响
如表5所示,小鼠在摄入不同剂量的益生菌30 d后,各组的脾脏/体重比值与对照组相比无明显差异(P>0.05),其胸腺/体重比值在各剂量组与对照组间比较无显著性差异(P>0.05)。
2.3 益生菌粉对小鼠细胞免疫机能的影响
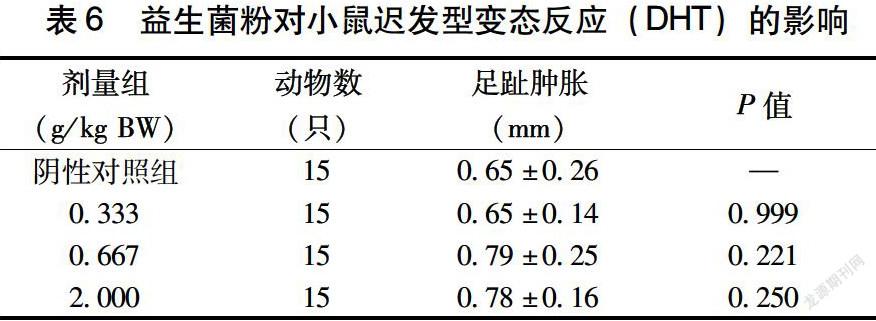
2.3.1 益生菌粉对小鼠迟发型变态反应的影响 如表6所示,各剂量组对小鼠迟发型变态反应无显著影响(P<0.01)。
2.3.2 益生菌粉对ConA诱导的小鼠淋巴细胞转化实验的影响 如表7所示,给小鼠喂食不同剂量的益生菌粉30 d后,各剂量组的益生菌粉对小鼠的淋巴细胞增殖能力无显著性差异(P<0.05)。
2.4 益生菌粉对体液免疫的影响
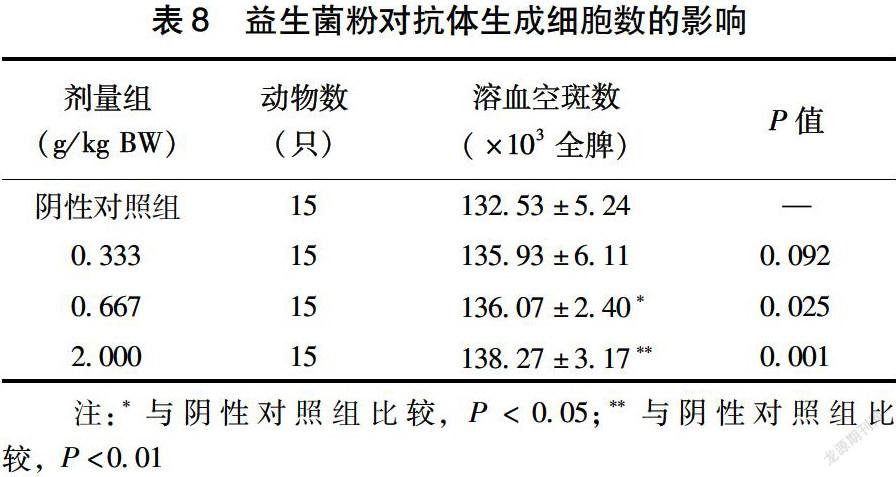
2.4.1 益生菌粉对抗体生成细胞数的影响 如表8所示,给小鼠喂食不同剂量的益生菌粉30 d后,其抗体生成细胞数在中、高剂量组中有显著性增加(中剂量P<0.05、高剂量P<0.01),表明随着益生菌粉摄入剂量的提高,抗体生成细胞数显著升高,具有一定的剂量依赖性。
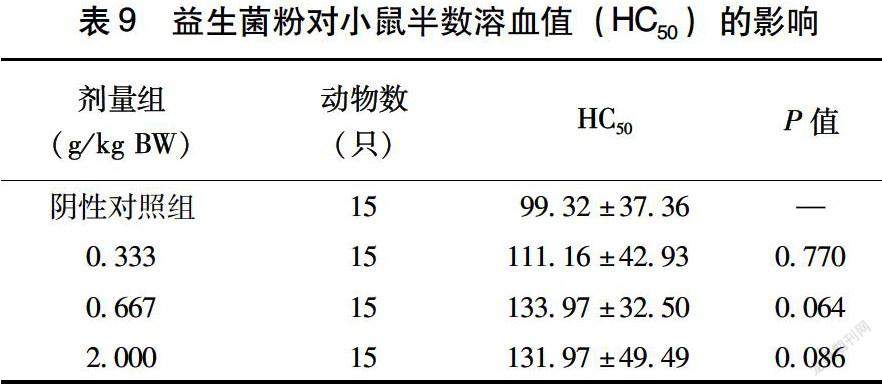
2.4.2 益生菌粉对小鼠半数溶血值(HC50)的影响由表9可见,给小鼠喂食不同剂量的益生菌粉30 d后,其半数溶血值(HC50)在各剂量组与对照组间比较无显著性差異(P>0.05)。
2.5 益生菌粉对小鼠单核—巨噬细胞吞噬功能的作用
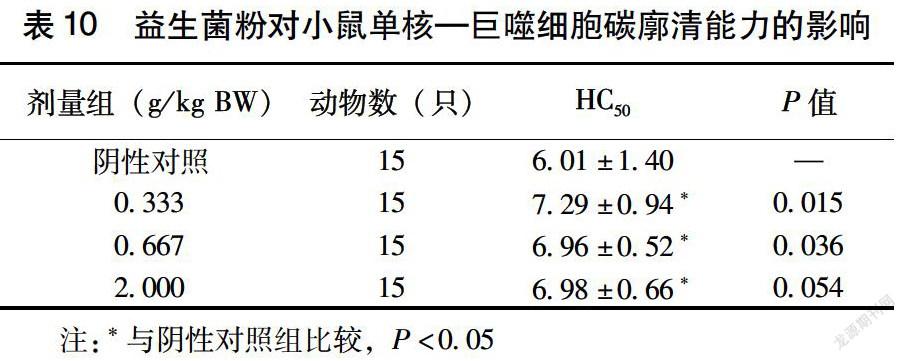
2.5.1 益生菌粉对小鼠单核-巨噬细胞碳廓清能力的作用 由表10可见,给小鼠喂食不同剂量益生菌粉30 d后,其碳廓清功能在低、中剂量组与对照组间相比具有显著的提高(P<0.05)。
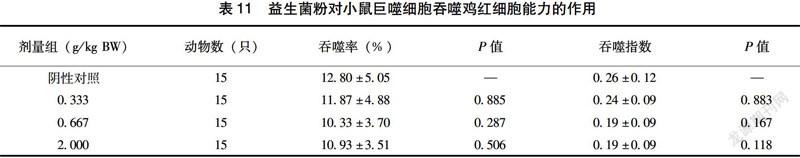
2.5.2 益生菌粉对小鼠巨噬细胞吞噬鸡红细胞能力的影响 由表11可见,给小鼠喂食不同剂量的益生菌粉30 d后,其吞噬率和吞噬指数在各剂量组之间以及与对照组相比均无显著性差异(P>0.05)。
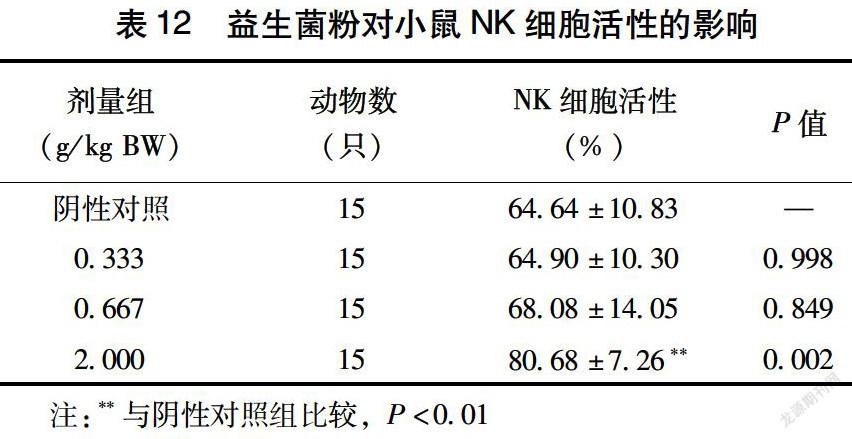
2.6 益生菌粉对小鼠NK细胞活性的影响
由表12可见,给小鼠喂食不同剂量的益生菌粉30 d后,高剂量益生菌粉组中小鼠的NK细胞活性有显著提高(P<0.01),而低剂量和中剂量组与阴性对照组无显著性差异,表明该复合益生菌粉增强NK细胞活性的能力具有一定的剂量依赖性。
3 讨论
益生菌和益生元的功能复杂多样,不同益生菌的免疫激活和调节机制不同,本研究中所用的复合益生菌粉对体液免疫、单核—巨噬细胞吞噬功能增强具有一定的增强作用,在本研究剂量下对细胞免疫和NK细胞活性的影响作用不显著,依据判定标准,上述四类实验中任两个结果阳性,可表明本益生菌粉具有增强免疫力的功能。
综上,给小鼠喂食不同剂量的益生菌粉30 d后,该益生菌粉对细胞免疫的调节作用不显著,而其抗体生成细胞数在中、高剂量组与对照组相比具有显著性差异(中剂量P<0.05、高剂量P<0.01),该结果提示,该复合菌粉可增强小鼠的体液免疫功能,其碳廓清功能在低、中、高剂量组与对照组相比均有显著性差异(P<0.05),而益生菌粉对小鼠巨噬细胞吞噬鸡红细胞能力在各剂量组与对照组均无显著性差异,两个实验中的任一实验的两个剂量组结果阳性可表明,该复合益生菌粉具有一定的单核—吞噬细胞的免疫增强作用;NK细胞活性仅在高剂量组显示与对照组具有显著性差异(P<0.01),该阳性结果依据不足,有待进一步研究。本次实验未见益生菌粉对小鼠体重、脾脏/体重比值、胸腺/体重比值、足趾肿胀度、淋巴细胞增殖能力有影响,主要原因可能是:动物自身对脏器指标和体重具有一定的自我调节能力,因此会在一定的范围内波动变化,除非在特殊生理状态下才会发生显著变化;免疫系统具有一定的动态性和自身调节性,也解释了本研究中淋巴细胞的增值未见明显差异的现象,而且免疫调节的机制通路复杂,该益生菌粉对细胞免疫的淋巴细胞增殖不显著表明其对特异性免疫的增强效果小于非特异性免疫的效果,有待进一步深入研究。
本研究中的益生菌粉主要是由植物乳杆菌Lp90、长双歧杆菌BL21、嗜酸乳杆菌LA85和菊粉、低聚果糖等复配混合制成,其多功能的免疫增强活性与其组成成分相关。本研究结果表明,复合益生菌粉对免疫力有有益调节的作用,与蔡玟[14]、潘香香[15]等的研究结果较一致。据报道,植物乳杆菌在口服后能够通过诱导IL-12的释放增强NK细胞的活性,通过穿孔素和颗粒酶的释放,保护机体免受感染源的侵袭[16]。Alberto Finamore等[17]研究发现,乳杆菌与长双歧杆菌的复合益生菌能够通过影响初始T细胞、记忆T细胞,B细胞、Treg和NK细胞,提高人体的免疫力,其中,两株益生菌的混合物并没有改变NK细胞的总数,但增加了NK的活性,从而改善了先天性免疫,与本研究结果一致。
益生菌粉实现上述四种免疫调节作用主要通过以下几种机理[18-19],首先,口服益生菌粉后,促进肠道粘膜细胞的修复,保证屏障功能的完整性,在维持肠道免疫平衡方面起着重要作用;其次,益生菌粉引起的肠道菌群的改变,可能会局部持续激活先天和获得性免疫,并调节IgA在肠道中的分泌,防止病原体的侵入和感染;此外,益生菌还可以直接刺激肠道中的抗原呈递细胞,刺激肠道免疫系统;最后,益生菌能够调节Treg细胞、CD4+T细胞、B细胞等,影响细胞因子的释放从而参与自身免疫或其他炎症性疾病。针对本研究中的复合益生菌粉的具体调节机制,与成分、剂量、和免疫系统自身调节的复杂性有关,相关具体机制有待进一步研究。
综上,该实验条件下的益生菌粉未对小鼠产生负面影响,并能够从多方面增强小鼠的免疫机能。
参考文献
[1]lilly DM,sillwell RH.Growthrpomoting factors produced by crooranisms[J].Science,1965(147):747-748.
[2]张欣媛.快速检测技术在食品微生物检测中的应用[J].食品安全导刊,2018,200(9):83.
[3]Gibson GR,Robert H,Sanders ME,et al.Expert consensus document:The International Scientific Associa-tion for Probiotics and Prebiotics (ISAPP)consensus state-ment on the definition and scope of prebiotics[J].Nature Reviews Gastroenterology & Hepatology,2017,14 (8):491-502.
[4]陈君石.益生菌和益生元对肠道健康的双效作用[J].中国食品,2015(21):118-119.
[5]Panigrahi P,Parida S,Nanda N C,et al.A randomized synbiotic trial to prevent sepsis among infants in rural India[J].Nature,2017(548):407-412.
[6]宋青龙,潘宝海,孙冬岩,等.微生态调节剂在水产养殖中的应用研究进展[J].新饲料,2007,7(4):19-22.
[7]殷溪莎,曲永利.乳酸菌制剂对家畜营养的作用概述[J].中国畜禽种业,2014(2):75-77.
[8]王长文,张岚,马洪波.双歧杆菌对肠粘膜黏附及免疫调节功能的研究进展[J].吉林医药学院学报,2010,31(1):42-45.
[9]李俊洁,陈庆森.双歧杆菌调理和改善肠道相关疾病作用的研究进展[J].食品科学,2012,32(23):326-332.
[10]Gibson GR,Roberfroid MB.Dietary modulation of the colonic microbiota:introducing the concept of prebiotics[J].Journal of Nutrition,1995(125):1401-1412.
[11]張颖.内蒙古乳制品中植物乳杆菌对小鼠肠道菌群及免疫功能的影响[D].呼和浩特:内蒙古农业大学,2007.
[12]Ashaolu T J .Immune boosting functional foods and their mechanisms:A critical evaluation of probiotics and prebiotics[J].Biomedicine & Pharmacotherapy,2020(130):110625.
[13]中华人民共和国卫生部.保健食品检验与评价技术规范[M].北京:中华人民共和国卫生部,2003.
[14]蔡玟,崔岸,黄琼,等.摄入含嗜酸乳杆菌 NCFM 和乳双 歧杆菌 Bi-07 的益生菌补充剂增强免疫功能的动物实 验研究[J].中国微生态学杂志,2008,20(1):17-19.
[15]潘香香,吴迪,徐淼,等.一种复合益生菌制剂对Balb/c小鼠特异性免疫功能的影响[J].食品与发酵科技,2016,52(6):27-30.
[16]Kawashima T,Hayashi K,Kosaka A,et al.Lactobacillus plantarum strain YU from fermented foods activates Th1 and protective immune responses[J].International Immunopharmacology,2011,11(12):2017-2024.
[17]Alberto Finamore,et al.Supplementation with Bifidobacterium longum Bar33 and Lactobacillus helveticus Bar13 mixture improves immunity in elderly humans (over 75 years)and aged mice[J].Nutrition,2019(s 63-64):184-192.
[18]杨锡强.益生菌对免疫功能的影响[J].中华实用儿科临床杂志,2010,25(9):623-625.
[19]Ding S,Yan W,Ma Y,et al.The impact of probiotics on gut health via alternation of immune status of monogastric animals[J].Animal Nutrition,2020,7(1):24-30.