微生物电化学技术去除水体中抗生素的研究进展
2021-09-13周乐安蒋倩孙士权张伟高阳王鑫
周乐安 蒋倩 孙士权 张伟 高阳 王鑫


摘 要:抗生素在各个行业中的广泛使用及其难降解性导致其富集进入水体而危害人类健康,越来越多的研究聚焦于水体中抗生素的去除。微生物电化学系统(BES)结合有机质生物降解和电信号刺激有效加速了废水中各类抗生素的去除。在现有文献的基础上,综述了BES对于各类抗生素去除的性能,阐述了BES系统在降解抗生素时,电极表面的电活性微生物组成、抗生素的微生物电化学代谢途径,总结了抗生素在BES系统中去除的影响因素,分析了各类传统废水处理技术与BES耦合技术对于抗生素的去除效率,并对BES在抗生素去除中的优缺点进行了总结。
关键词:抗生素;微生物电化学系统;电活性微生物;废水处理;资源回收
中图分类号:X703.1 文献标志码:A 文章编号:2096-6717(2021)06-0113-11
Abstract: Antibiotics are widely used in various industries, but due to its refractory properties, antibiotic sareenriched in water system and do harm to human health.Many researchers focus on the removal performance of antibiotics in water systems.Bioelectrochemical system (BES) combined with organic substrate biodegradation and electrical signals stimulation effectively accelerates the removal of all kinds of antibiotics in wastewater. Based on previous studies, in this review, the removal performance of antibiotics in BES are summarized. When BES are applied for antibiotic removal, the electroactive bacteria composition and metabolic pathways of electroactive biofilm on electrode surface are expounded. The factors which affecting the removal performance of antibiotics in BES are summarized. And the antibiotic removal efficiency of BES coupled with traditional wastewater treatment technologies are analyzed. Finally, this manuscript summarizes the advantages and disadvantages of BES in antibiotic removal.
Keywords: antibiotics;bioelectrochemical system (BES);electroactive bacteria; wastewater treatment; resource recovery
抗生素的發现与使用,极大地改善了人类健康状况,提高了现代农业与畜牧业的经济效率,促进了经济社会的高效发展。据报道,全世界范围内抗生素被广泛使用,世界卫生组织(WHO)推荐的抗菌药物应用率为30%,欧美发达国家约为10%,发展中国家约为42%[1]。报告指出,亚洲地区已经成为全球最大的抗生素用药市场,市场规模约占全球总量的37.9%(2016—2022年中国抗生素市场深度调查与未来发展趋势报告)。中国2013年抗生素消费总量约为16.2万t,其中,人类医疗消耗约48%,剩余部分则用于畜牧业[2]。2018年约70%的住院病人以及20%的门诊病人使用抗生素类药物,这一数据约为发达国家使用率的两倍[3]。抗生素经使用后,可通过不同途径进入到水体中(图1),其中,主要包括污水处理厂的出水排放、畜牧业禽畜的饲养、鱼类孵化场以及地表径流等。
1 水体抗生素污染及其处理方法
1.1 水体抗生素污染现状
抗生素的广泛使用,使得水体成为环境中抗生素最重要的归宿地之一。由于城市生活污水处理厂对于抗生素的降解效率较为低下,抗生素无法在处理过程中消除活性而进入环境,尤其是水环境中。据统计,抗生素经处理后大约仍有5.38万t排放进入环境[2]。研究指出,水产养殖中约80%的抗生素会在水环境中释放[5]。更为严重的是,抗生素排放进入环境中施加的选择性压力筛选并富集了环境中的耐药细菌和耐药基因(Antibiotic resistance genes,ARGs),加速了耐药细菌的不断进化,从而催生了各类耐药性的“超级细菌”,其危害堪比最新蔓延的新型冠状病毒(SARS-CoV-2)[6]。报道指出,美国每年约2.3万人死于耐药感染,而据保守估计,全球范围内每年死于耐药感染的人数高达70万。若抗生素随污水排放不加以控制,研究预计到2050年全球每年的死亡人数将额外增加1 000万[7]。因而,高效去除水体环境中的抗生素一直是现代废水处理技术研究的热点与难点[8]。
1.2 常见抗生素类废水处理方法
在过去几十年的研究中,水体抗生素常见的去除方法一般有物理、化学、生物等方法,进一步细化后可分为吸附法、电化学催化、臭氧氧化、芬顿类芬顿氧化、活化过硫酸盐、光催化、好氧生物与厌氧生物处理等[2, 9-10]。物理化学方法一般可以对废水进行简单预处理以实现物质回收与提高水质的可生化性。
在物理化学方法中,吸附法的基本原理为利用多孔固体材料表面的吸附能力对水体中抗生素类污染物进行络合、静电相互作用、形成氢键或化学键(π-π键)等多种方式吸附去除,使水体得以净化。研究至今,矿物质类(坡缕石、伊利石、蒙脱石、高嶺土、二氧化硅)、树脂类(大网格聚合物、磁性树脂)、金属与金属氧化物类(铝、铁的水合氧化物)、碳基材料(多壁碳纳米管、氧化石墨烯、活性炭、生物炭)以及生物污泥等均可作为吸附剂对抗生素进行吸附去除[11]。在使用过程中,吸附剂一般可以回收利用3~5次。吸附法较其他处理方法具有操作简单、成本低、效率高、重现性强、吸附剂种类多的优点。然而,吸附法并没有对抗生素进行降解去除,而仅仅是吸附存储的物理过程。此外,当水体中其他污染物存在时,吸附效果将明显受损。
电化学催化法则利用电极使废水中抗生素结构断裂或改变而转化为小分子产物,从而降低或消除其生物毒性。水体抗生素可直接在电极表面发生氧化还原反应得以去除,也可通过间接的电化学反应产生活性基团(如超氧自由基、双氧水、羟基自由基等)对抗生素进行矿化去除。在研究电化学催化降解抗生素时,影响其降解的主要因素有电极材料、抗生素初始浓度、pH值、电极两端施加的电流强度、溶液离子强度、温度、抗生素种类等[12]。高效、适用性广、降解彻底是电化学催化法的优点,但经济投入高、电极材料的选取与制备是限制其实际应用的难点。臭氧氧化技术中,利用臭氧的强氧化性直接或间接与有机污染物发生氧化反应,断裂抗生素的分子结构。在利用臭氧氧化处理抗生素的过程中,pH值具有关键性的作用。一般而言,臭氧在pH值较高的环境以及可溶性有机碳浓度较低情况下更具有适用性[13]。在相关研究中,一般为提高臭氧氧化的降解效率,UV、过氧化氢等辅助性催化剂利用较多。芬顿与类芬顿氧化法利用Fe2+与H2O2链式反应产生羟基自由基·OH对抗生素进行氧化分解[9]。芬顿法对抗生素降解效率较高,但在应用过程中,芬顿与类氧化法受催化剂用量、H2O2的浓度、温度、pH以及抗生素浓度影响,且氧化剂用量不易控制,抗生素降解容易产生不可预知的中间副产物,再次进入环境带来二次污染。活化过硫酸盐氧化法的基本原理为利用活化技术对过硫酸根离子进行活化,转化生成SO-4·的新型高级氧化技术。其活化技术一般有紫外活化、热活化、碱和超声活化以及过度金属离子活化等[14]。相对于芬顿技术,活化过硫酸盐氧化的pH范围更广,SO-4·在水溶液中存在时间相较于羟基自由基更长。研究表明,活化过硫酸盐对于抗生素去除具有较好的效果。然而,对于活化过硫酸盐氧化技术,寻求高效且环境友好型的螯合剂是其应用难点[14]。光催化作为高级氧化工艺(AOPs)中的一种,利用光照与环境条件对抗生素进行降解,是一类降解彻底且绿色的环境催化氧化技术[15]。然而,研究与发展高效的半导体材料是光催化降解抗生素的核心问题,另一个挑战是抗生素的完全光降解,即降低抗生素降解过程中副产物的毒性和环境持久性。
生物方法因其在原位应用方面的高灵活性而备受关注,通常地,生物法是一项耗时较长、降解彻底的抗生素处理技术。然而,厌氧的生物处理过程一般应用于高浓度有机废水处理,且所需时间较长,而好氧处理时曝气需要较高的能量输入,更有大量剩余污泥将产生[16]。
2 微生物电化学技术处理抗生素类废水
微生物电化学技术(Bioelectrochemical system, BES)具有污染物降解彻底、能耗低、操作简单等特点。在BES中,电活性微生物氧化分解有机质进行代谢活动,产生的电子一部分供自身增殖利用,剩余部分则通过胞外电子传递至终端电子受体,从而完成生物化学能量到电信号的转换[17-19]。微生物电化学技术结合有机质生物降解和电信号刺激,有利于废水中抗生素类污染物的去除。与好氧废水处理系统相比,BES的厌氧系统具有低能耗和低污泥产量的优势。利用BES技术加速厌氧废水处理时,难降解污染物的生物毒性将抑制电活性微生物的活性,因此,污染物的分子结构断裂将是影响整个废水处理性能的瓶颈[20]。在BES系统中可有效实现抗生素的去除,研究报道,对于β-内酰胺类与喹酮类抗生素,其去除率可高达98%以上,而四环素类、氯霉素、磺胺类等,其去除效率也均在80%以上[21]。至今利用BES技术进行抗生素类废水去除时,主要包括单一系统以及微生物电化学耦合传统废水处理技术。笔者就近年来微生物电化学在抗生素类废水处理领域的应用,包括微生物学组成、抗生素代谢途径、影响抗生素处理效率的相关参数,以及BES耦合传统废水技术,进行回顾与总结。
2.1 BES中抗生素的降解机制
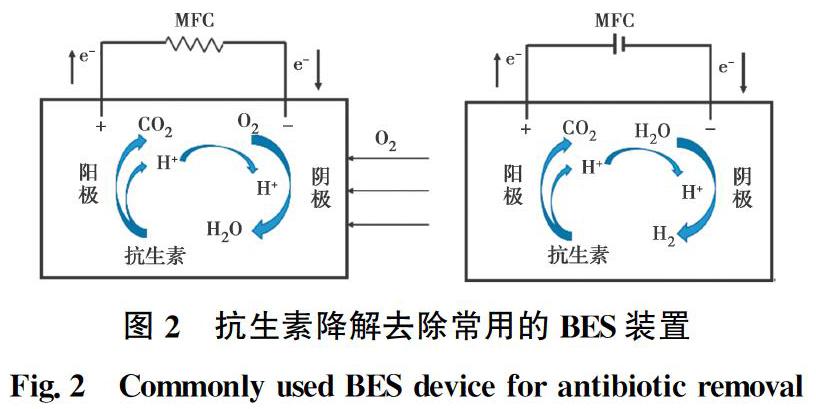
微生物电化学技术(图2),传统意义来讲主要包括微生物燃料电池(Microbial fuel cells, MFCs)和微生物电解电池(Microbial electrolysis cells, MECs),该技术结合微生物代谢和电极表面的电化学氧化还原反应对污染物进行降解[19, 22]。对于MFC系统,阳极均由生物阳极构成,而阴极可分为非生物阴极与生物阴极两种系统。在非生物阴极的系统中,一般以空气或者铁氰化钾作为非生物阴极的电子受体,废水中的抗生素等污染物质则作为生物阳极中电活性生物的碳源与电子供体。
当阴极催化剂转变为接受电子的电活性微生物后,即为生物阴极。在生物阴极MFC中,阴极电活性生物接受来自电极的电子,而阴极室中抗生素接受来自阴极的电子,并通过直接的电化学或微生物还原去除。与非生物阴极相比,循环伏安曲线 (CV) 显示生物阴极MFC具有更高的峰值电流和更低的过电位[23]。由于生物阴极的得电子属性,生物阴极一般应用于降解电子受体型抗生素。
MEC系统则是一个电驱动的析氢过程,通过外加电位,推动电活性微生物电子传递,提高电极表面微生物对抗生素的降解去除。在MEC系统中,电位是决定抗生素在MECs中降解效率的重要因素之一。抗生素在MEC中的降解机理则主要包括电化学直接还原和生物降解过程[24]。电子供体型抗生素可在阳极中被微生物氧化去除。而电子受体型抗生素即可接受阴极传递的电子进行还原,也可通过生物阴极表面的电活性微生物直接还原去除。
2.2 BES中抗生素的降解性能
对应于上述BES系统的降解机制,当以空气阴极运行MFC对土霉素(Oxytetracycline,OTC)进行降解时,OTC浓度为50 mg/L以下时,其降解效率可达90%以上[25]。而使用氰化铁钾溶液(50 mmol/L K3[Fe(CN)6]和20 mmol/L磷酸鹽缓冲液PBS)作为阴极液,以碳布为阳极,磺胺嘧啶(Sulfadiazine,SDZ)作为唯一电子供体,2周内SDZ降解效率在90%以上[26]。阳极室中抗生素的引入抑制了胞外产电菌的电活性,降低了阴极的氧还原速率,限制了MFC电能输出,但金霉素(Chlortetracycline,CTC)、罗红霉素(Roxithromycin, ROX)、诺氟沙星(Norfloxacin)以及SDZ的去除率可达99.9%甚至100%[27]。对于非生物阴极的MFC系统,抗生素浓度、种类以及阳极的电活性生物是抗生素降解的关键因素。
当利用生物阴极对氯霉素(Chloramphenicol, CAP)进行降解时,生物阴极微生物可以直接从阴极获得电子,参与CAP的硝基还原与脱氯反应,从而提高CAP的去除效率。CAP在生物阴极中的还原效率约为非生物阴极的3.2倍[28]。以32 mg/L 的CAP为目标污染物,当生物阴极运行4 h后CAP的转化率为87.1%,而当运行时间提升至24 h后,这一去除率可达96.0%[23]。此外,生物阴极的降解效率极大地受环境温度影响,当温度由室温(25 ℃)降低至10 ℃时,生物阴极的CAP还原效率显著下降[29]。
当BES以MEC运行时,电极电位调控着MEC中生物的电活性与生物膜形成速率,当电位由0 V增加到0.9 V时,磺胺嘧啶(SDZ)在36 h内的去除率由79.3%增加至91.4%[30]。此后当电位持续增加至1.5 V时,降解效率不再增加,表明此时电位的加速效应达到阈值。相比如-0.5 V,当阴极电位处于较低的水平时(-1.25 V),可以提供足够的电子供阴极还原CAP,此外,其微生物群落结构在更低的电位下同样也发生改变[31]。
综上,基于电活性微生物的BES技术,在进行抗生素类污染物去除时,无论生物还是非生物阴极或者MEC系统,都取得较高的去除率(80%)。而在这一过程中,生物的催化、降解作用是抗生素降解的关键,因而,BES电极表面的生物膜中生物组成将影响抗生素的去除效率与代谢方式。
2.3 BES中降解抗生素的微生物群落
报道显示,BES对各类抗生素降解时,电极表面生物组成主要分为两个部分:具有电活性的胞外产电菌群以及具有抗生素降解功能的菌群,两种菌群间复杂的相互作用对BES中抗生素降解和电能产出至关重要[21]。胞外产电菌利用抗生素等有机基质进行胞外呼吸产生电子,从而回馈加速厌氧降解过程。无论MFC与MEC系统,在进行抗生素类有机质降解时,其生物膜中的生物组成具有相似性,其基本组成为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)以及厚壁菌门(Firmicutes)等,而对于不同的抗生素种类,生物学组成在属或科水平具有差异性(见表1)。研究显示,利用BES系统对氯霉素(CAP)进行降解时,富集于电极表面电活性生物膜的优势菌属为Azonexus、Comamonas、Nitrososphaera、Chryseobacterium、Azoarcus、Rhodococcus以及Dysgonomonas等。其中,Azonexus与Comamonas为具有胞外产电功能的阳极电活性菌,而其他的优势属在厌氧条件下具有降解有毒或难降解有机质的作用[32]。有研究指出,对于土霉素的BES降解,其生物群落中Eubacterium spp.的丰度可高达91%以上[33]。在降解头孢唑啉(Cefazolin,CFZ)的BES中,常见的电活性菌Geobacter、Acinetobacter、Stenotrophomonas、Lysinibacillus与Dysgonomonas在阳极生物膜中得以富集[34]。以恩诺沙星(Enrofloxacin,ENR)与头孢噻呋(Ceftiofur,CEF)驯化电极生物膜显示,厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)的丰度相较于原始菌群出现下降,而变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)的丰度增加至80%~90%。属水平显示,Flavobacterium、Achromobacter、Stenotrophomonas 以及Chryseobacterium 在抗生素驯化体系中占据主导地位[35]。
在生物阴极表面,其优势菌属一般为α、β和γ-变形菌门(Proteobacteria)以及拟杆菌门(Bacteroidetes)[23]。进一步对其属水平分析显示,不同运行条件下的BES生物膜中,Methylobacillus、Pseudomonas、Anaerolineaceae以及 Brevundimonas优势明显[31]。进行抗生素呋喃西林(Nitrofurazone,NFZ)降解时,生物阴极表面兼具硝基芳烃还原能力与胞外产电能力的Klebsiella是重要的优势菌属[23, 37]。综上所述,抗生素的毒性与难降解性对BES系统中微生物活性影响较大,尽管在门水平差异不大,但在属或者种水平,其生物学趋向于多样化,逐步以抗生素驯化的电极电活性菌群对于抗生素的去除具有高效性。
2.4 BES中典型抗生素的降解代谢途径
生物学以及抗生素种类的差异性势必带来代谢途径的多样化,在以BES电活性微生物进行抗生素降解时,其代谢途径各有不同。金霉素(CTC)在BES中首先进行脱氢与脱卤反应,此后化学键逐步被打断即甲基以及—N(CH3)2等被氧化并最终转化为二氧化碳与水而去除[38]。土霉素(Oxytetracycline,OTC)的降解过程与CTC具有相似性,OTC的代谢同样是氢基于羟基的断裂形成anhydro-oxytetracycline(AOTC)开始,随后快速分解为αAPOTC与βAPOTC,经过氧化并发生开环反应生成3-羟基环己酮,最后,在羟基自由基的作用下分解为CO2和H2O[38]。在另一项利用BES进行OTC生物降解的研究中,OTC被微生物代谢,分子结构被破坏而转化为相对简单的苯环和碳链,从而消除OTC的抗性与毒性[39]。氯霉素(CAP)在生物阴极中的代谢主要有两类代谢中间产物,即硝基部分与3-羟基部分。其中3-羟基部分被乙酰化而转化为乙酰化CAP,硝基部分则转化为胺基,形成胺类中间产物(AMCl2)。此后乙酰化CAP在经历微生物进一步代谢后转化为AMCl2,最后AMCl2逐步通过多种微生物的meta-cleavage代谢途径转化为无毒小分子产物[23, 32, 40]。磺胺甲恶唑 (Sulfamethoxazole,SMX)降解时,首先发生S-N键的断裂形成4-氨基苯磺酸(4-amino benzene sulphinic acid)和3-氨基-5-甲基异恶唑(3-amino-5-methylisoxazole,3A5MI)(图3)。其中,4-氨基苯磺酸转化为苯磺酸或4-氨基苯硫酚,3A5MI的氨基则被微生物利用而转化为5-甲基异恶唑。伴随着N—O键和碳碳双键断裂,加之微生物耦合电刺激5-甲基异恶唑转化为异丙醇并最终在厌氧环境下降解为CH4去除[41]。此外,有研究显示SMX的代谢包括多种中间产物,表明其代谢途径的多样性,但不论何种代谢途径,SMX都将开环形成小分子的中间产物而毒性得以去除[36]。
磺胺嘧啶(SDZ)的化学结构由两部分组成:嘧啶和磺胺。BES中,SDZ的代谢分为两条途径,降解初期,随着S—N化学键的断裂,SDZ降解为嘧啶和苯胺[30]。进一步地,苯胺在微生物与电刺激下转化为苯且最终代谢产生甲烷,而嘧啶则随之转化为C4H8N2,并开环降解为小分子物质。此外,研究指出,SDZ的代谢产物可以作为微生物生长的能源、碳源或氮源等[30]。在另一项研究中指出水解是SDZ降解的第一步,而水解后的嘧啶部分通过羟基化过程进一步降解,磺胺部分(对苯胺磺酸)则主要通过还原和反硝化反应为主进行代谢去除[26]。综上所述,不同的抗生素种类驯化将引起电活性生物组成不同,从而进一步影响BES中代谢途径。因此,在考虑提升BES中抗生素的代谢效率时,生物接种来源、生物膜厚度以及环境因素包括温度、pH、离子强度等均在不同程度影响着BES的抗生素类废水处理性能。
2.5 影响BES中抗生素去除的因素
在利用BES技术对抗生素废水进行处理时,系统的电极材料、离子强度与pH值、电活性生物膜厚度、抗生素类别与起始浓度等都将影响BES的废水处理效率与电能回收。
电极材料决定了生物附着与电极的催化性能,阳极材料選择时一般考虑的因素包含比表面积、生物相容性、导电性、长期运行稳定性以及经济效益等,而阴极的选取则一般需要优先筛选其催化性能、导电性以及化学稳定性等[42],表2对比了不同电极材料对抗生素降解性能的影响。有研究对比了碳棒(CR)、泡沫铜(Cu)以及泡沫镍(NF)作为阴极时BES对氯霉素(CAP)的降解情况,结果显示,32 mg/L CAP在泡沫铜电极下12 h即可完全降解,而碳棒以及泡沫镍所需时间增加至24 h与120 h[43]。对比石墨与锰氧化物两种电极,系统对环丙沙星(Ciprofloxacin,CIP)的去除率均高达97.8%以上,然而在石墨电极BES中由于电极吸附作用,其出水中磺胺嘧啶(SDZ)的浓度较之更低,即出水水质更优[44]。
抗生素进入系统时,将在一定程度上抑制电极表面微生物活性,从而延长BES的启动时间,因此,接种源与生物驯化方式对于优化电活性生物膜组成,富集抗生素类降解菌具有重要作用。研究指出,以磺胺嘧啶(SDZ)为有机底物,12个周期后,系统能量输出回到最大值,6个月持续驯化后,BES能够高效去除SDZ,100 mg/L SDZ可在48 h内完全去除[26]。此外,生物膜在较厚条件下对污染物毒性具有一定的抵抗力[45]。最新研究显示,生物膜厚度可以调控物质在BES系统中的代谢途径,即生物膜厚度的代谢将出现空间异质现象[46]。生物膜增厚后对头孢唑啉(Cefazolin,CFZ)的耐受性更高[34]。生物膜在逐渐增厚的过程中,胞外聚合物不断累积,将微生物包裹而形成类似于堡垒的新型结构,从而提高生物的耐受性[47]。抗生素在一定的浓度范围内甚至能提高系统产能[48],增大污染物去除效率,但浓度过高时,毒性将对电活性生物膜造成伤害[26]。有研究对比了BES系统对不同浓度SDZ的降解效率,结果显示,20 mg/L SDZ在系统中被快速去除(3 h),而当浓度提高到160 mg/L时,这一去除时间增加至24 h[30]。由于中间毒性物质的产生,高浓度的起始抗生素浓度将抑制系统的性能。在去除SMX的研究中,当抗生素浓度分别为0.20、0.39、0.79 mmol/L时,其TOC去除量分别为约73%、53%和33%[36]。此外,不同抗生素种类的分子结构与官能团组成具有差异性,其微生物可利用性在BES中不尽相同,因而其去除效率具有较大的差异。研究显示,在BES中,相同浓度的抗生素(60 mg/L),OTC的降解速率高于CTC[38]。基于抗生素的生物可利用性,研究不同抗生素在BES系统中的产电性能,结果显示,以磺胺嘧啶(SDZ)为基质的电压输出高于金霉素(CTC)与罗红霉素(ROX),而诺氟沙星(NOR)电能输出最低[27]。
其他因素,如电极电位、离子强度、温度与pH值等同样对BES的降解性能具有重要影响。BES中的MEC需要额外的外接电位,电极电位的变化将影响着电活性微生物的胞外电子传递(EET)机制,从而引起电活性微生物种群的多样化发展[49]。因此,外接电位的适当改变可有效提高抗生素在BES中的去除效率[30]。电位的提高增加了系统的电子驱动力,强化抗生素的去除。当阴极电位由-0.2 V变化到-0.8 V时,呋喃西林(NFZ)的还原效率由约42%提高到约71%[37]。适度含盐废水(0.5%)的高导电性可有效促进BES中的氧化还原反应,加速废水中氯霉素(CAP)的去除,而当盐度提高到6%时,BES中CAP去除效率显著降低,表明高盐度对CAP去除率的抑制作用[50]。pH通过调节微生物酶的活性影响电活性生物膜的代谢效率、氧化还原电位和微生物产物的形成。在BES中,pH值对维持氧化还原反应的平衡也起着至关重要的作用。一般地,微生物电活性在pH值为7左右最佳,pH值过高或过低都将导致BES性能的显著下降[51]。BES中基质的生物电化学反应在调解电解液的pH值方面起着重要作用。质子的产生和消耗基本同时发生,微生物自身将依据初始pH值平衡外界pH值变化[52]。然而,由于质子生成反应和氢氧根离子生成反应的速率不同,将导致系统pH值失衡,从而引起潜在的能量损失,降低系统功率输出[53]。因而在BES中,通常采用磷酸盐缓冲液调节系统的pH值。50 mmol/L磷酸盐缓冲液时,抗生素逐步驯化10月后,72 h可将10 mg/L土霉素去除99%以上[33]。在20 mmol/L磷酸盐缓冲液下,BES在12 h内即可将20 mg/L抗生素磺胺甲恶唑(SMX)去除85%,相较于文献报道具有更高的降解效率[41]。温度对电活性生物膜形成以及电催化性能具有重要意义[54]。BES的运行温度对CAP的去除效率有一定的影响,当温度从25 ℃切换到10 ℃时,CAP的降解显著降低,生物阴极微生物葡萄糖发酵的乙酸和乙醇产率显著下降[29]。
2.6 BES耦合传统废水处理技术降解抗生素
近年来,由于水质的逐渐恶化,单一的废水处理技术已经不能满足废水处理的高效性、环境友好、资源回收与经济可利用性要求[55-56]。因此,研究者们开始聚焦于传统废水处理技术的耦合。BES技术与传统的污水处理技术,如人工湿地(Constructed wetland, CW)、膜生物反应器(Membrane bioreactor, MBR)以及高级氧化技术(Advanced oxidation process,AOPs)相结合,能够获得较高的抗生素降解效率。
微生物燃料电池耦合人工湿地(CW-MFCs)利用微生物学、电化学以及生态相关功能进行废水废物处理(图4(a))。有研究将BES技术与人工湿地耦合搭建CW-MFCs系统,结果显示磺胺嘧啶(SDZ)、卡马西平(Carbamazepine,CBZ)、萘普生(Naproxen,NPX)和布洛芬(Ibuprofen,IBP)等在CW-MFCs的闭合系统中,出水COD、NH+4-N以及废水中毒性得以有效降低[57]。在另一项关于CW-MFC去除抗生素的研究中,不同抗生素浓度条件下(200~800 μg/L),所有反应器中均输出较高的穩态电压,表明电压输出不受磺胺甲恶唑(SMX)与四环素(Tetracycline,TC)较低浓度所影响。在较高的抗生素浓度(1 600 μg/L)下,抗生素抑制了电活性微生物的活性,CW-MFCs的电能输出下降[58]。此外,有研究指出,CW-MFC系统对于环丙沙星(CIP)的去除率高达约97%,表明CW-MFC系统可以有效去除水体环境中的抗生素[44]。
当利用BES系统与传统的电化学类技术进行耦合时,一般利用BES电活性生物膜产生的电能驱动传统电化学系统进行反应。MFC耦合(光)电化学催化(PEC或EC)的研究中,使用镀有Fe0/TiO2的不锈钢(SS)阴极(图4(b))。在可见光照射120 min后,该体系对四环素溶液(初始四环素浓度:100 mg/L )中COD的去除率达到70%,而暗处理时,去除率降低了15%。电子自旋共振光谱研究表明,Fe0/TiO2产生的生物电活化的O2和活性氧(Reactive oxidation species, ROS)基团有效地降解了基质中的抗生素[59]。电吸附(ES)与MFC的耦合ES-MFC系统在进行土霉素(OTC)降解时(图4(c)),串联3组MFC作为电源,当OTC浓度为2 mg/L时,去除率可达98.8%。随着处理时间的增加,ES中的去除效率逐渐提高而MFC中则出现下降。在ES反应过程中,OTC通过静电吸附和阳离子交换所产生的化学吸附进行吸附去除。研究表明,耦合的ES-MFC系统对于废水中的抗生素去除具有高效性[60]。MBR和MFC系统的耦合具有污染物降解更为彻底、相较于传统MBR节能、相较于单一MFC出水质量更高等优点[61]。MBR-MFC的耦合(图4(d)),以碳纤维布涂布聚偏氟乙烯(PVDF)为阴极进行废水处理,其COD去除率为90%,NH+4-N去除率为80%。过氧化氢等活性氧化剂联合电驱动微生物对模型污染物盐酸四环素(OTC)的氧化去除率达90%。与其他电化学系统相比,MBR-MFC在废水处理中具有更加节能环保的优势[62]。综合考量各类因素,BES及其耦合技术结合生物学、电化学以及物理学等的相关原理可以有效去除水体中抗生素类污染物,回收资源。
3 结论与展望
综述了利用BES技术进行抗生素类废水处理的生物学组成、代谢去除方式以及影响BES中抗生素降解性能的各个参数。采用BES技术进行抗生素废水处理时,其优点主要有:
1)回收有用资源、经济效益好:抗生素去除不需要额外的能量输入,此外,抗生素降解同时伴随着能量的产生,将储藏在有机质中的物理化学能转化为电能。在生物阴极中不需要额外的还原剂和任何外部电源输入,BES表现出较高的抗生素去除效率。
2)环境友好、无副产物产生:抗生素在降解过程中,高毒性的中间产物鲜有检出,一般中间产物在BES中得以进一步降解而产生小分子物质。
3)多技术耦合兼容与高效性:BES与AOPs、吸附方法和人工湿地等相结合具有高效降解各类抗生素的功能。
然而,研究者目前为止主要聚焦于提升其去除效率、解决其电活性生物可利用性、探究其代谢去除机制等。在去除抗生素的研究中往往忽略了复杂的废水组成,而微生物催化反应的pH适应范围等对于实际应用也具有局限性。在未来的研究中,对功能菌群的进一步了解乃至功能基因的鉴定与富集,驯化具有pH广泛应用性的功能降解菌,综合考虑BES技术对于复合污染物的降解,考察多因素下的抗生素降解将有助于推动BES在实际抗生素类废水处理中的应用与发展。
参考文献:
[1]曾化松, 王艳琳. 抗生素滥用的现状及应对策略[J]. 中国卫生事业管理, 2012, 29(5): 341-343.
ZENG H S, WANG Y L. The present situation and countermeasures of overuse of antibiotics[J]. Chinese Health Service Management, 2012, 29(5): 341-343. (in Chinese)
[2]ZHANG Q Q, YING G G, PAN C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science & Technology, 2015, 49(11): 6772-6782.
[3]郭賀. 脉冲放电等离子体协同石墨烯金属氧化物催化降解抗生素的研究[D]. 大连: 大连理工大学, 2019.
GUO H. Research on pulsed discharge plasma coupled with graphene-metal oxides catalysis for degrading antibiotics[D]. Dalian, Liaoning: Dalian University of Technology, 2019. (in Chinese)
[4]李红燕, 陈兴汉. 环境中抗生素的污染现状及危害[J]. 中国资源综合利用, 2018, 36(5): 82-84.
LI H Y, CHEN X H. Pollution status and harm of antibiotics in the environment[J]. China Resources Comprehensive Utilization, 2018, 36(5): 82-84. (in Chinese)
[5]CABELLO F C, GODFREY H P, TOMOVA A, et al. Antimicrobial use in aquaculture re-examined: its relevance to antimicrobial resistance and to animal and human health[J]. Environmental Microbiology, 2013, 15(7): 1917-1942.
[6]段宇婧, 吴新颜, 陈则友, 等. 人体肠道耐药基因组的研究进展[J]. 生态毒理学报, 2020, 15(4): 1-10.
DUAN Y J, WU X Y, CHEN Z Y, et al. Advances in human gut resistome[J]. Asian Journal of Ecotoxicology, 2020, 15(4): 1-10. (in Chinese)
[7]CARVALHO I T, SANTOS L. Antibiotics in the aquatic environments: A review of the European scenario[J]. Environment International, 2016, 94: 736-757.
[8]滕菲, 杨雪莲, 李凤梅, 等. 微生物对环境中难降解有机污染物共代谢作用[J]. 微生物学杂志, 2016, 36(3): 80-85.
TENG F, YANG X L, LI F M, et al. Microbial Co-metabolism of persistent organic pollutants in environment[J]. Journal of Microbiology, 2016, 36(3): 80-85. (in Chinese)
[9]XU L Y, ZHANG H, XIONG P, et al. Occurrence, fate, and risk assessment of typical tetracycline antibiotics in the aquatic environment: A review[J]. Science of the Total Environment, 2021, 753: 141975.
[10]KHAN M H, BAE H, JUNG J Y. Tetracycline degradation by ozonation in the aqueous phase: Proposed degradation intermediates and pathway[J]. Journal of Hazardous Materials, 2010, 181(1/2/3): 659-665.
[11]YU F, LI Y, HAN S, et al. Adsorptive removal of antibiotics from aqueous solution using carbon materials[J]. Chemosphere, 2016, 153: 365-385.
[12]王慧晴, 李燕, 司友斌, 等. 电催化氧化降解水体中抗生素磺胺[J]. 环境工程学报, 2018, 12(3): 779-787.
WANG H Q, LI Y, SI Y B, et al. Electro-catalytic oxidative degradation of sulfonamide in water[J]. Chinese Journal of Environmental Engineering, 2018, 12(3): 779-787. (in Chinese)
[13]GMEZ-PACHECO C V, SNCHEZ-POLO M, RIVERA-UTRILLA J, et al. Tetracycline removal from waters by integrated technologies based on ozonation and biodegradation[J]. Chemical Engineering Journal, 2011, 178: 115-121.
[14]JI Y F, SHI Y Y, DONG W, et al. Thermo-activated persulfate oxidation system for tetracycline antibiotics degradation in aqueous solution[J]. Chemical Engineering Journal, 2016, 298: 225-233.
[15]CALVETE M J F, PICCIRILLO G, VINAGREIRO C S, et al. Hybrid materials for heterogeneous photocatalytic degradation of antibiotics[J]. Coordination Chemistry Reviews, 2019, 395: 63-85.
[16]周婧, 支蘇丽, 宫祥静, 等. 三类抗生素在两种典型猪场废水处理工艺中的去除效果[J]. 农业环境科学学报, 2019, 38(2): 430-438.
ZHOU J, ZHI S L, GONG X J, et al. The removal effect of three classes of antibiotics in two typical swine wastewater treatment systems[J]. Journal of Agro-Environment Science, 2019, 38(2): 430-438. (in Chinese)
[17]冯玉杰, 王鑫, 李贺, 等. 基于微生物燃料电池技术的多元生物质生物产电研究进展[J]. 环境科学, 2010, 31(10): 2525-2531.
FENG Y J, WANG X, LI H, et al. Progress in electricity generation from biomass using microbial fuel cell(MFC)[J]. Environmental Science, 2010, 31(10): 2525-2531. (in Chinese)
[18]卢娜, 周顺桂, 倪晋仁. 微生物燃料电池的产电机制[J]. 化学进展, 2008, 20(Sup2): 1233-1240.
LU N, ZHOU S G, NI J R. Mechanism of energy generation of microbial fuel cells[J]. Progress in Chemistry, 2008, 20(Sup2): 1233-1240. (in Chinese)
[19]LOGAN B E, RABAEY K. Conversion of wastes into bioelectricity and chemicals by using microbial electrochemical technologies[J]. Science, 2012, 337(6095): 686-690.
[20]ZHOU L A, YAN X J, YAN Y Q, et al. Electrode potential regulates phenol degradation pathways in oxygen-diffused microbial electrochemical system[J]. Chemical Engineering Journal, 2020, 381: 122663.
[21]ZHANG S, YANG Y L, LU J, et al. A review of bioelectrochemical systems for antibiotic removal: Efficient antibiotic removal and dissemination of antibiotic resistance genes[J]. Journal of Water Process Engineering, 2020, 37:101421.
[22]WANG H M, REN Z J. A comprehensive review of microbial electrochemical systems as a platform technology[J]. Biotechnology Advances, 2013, 31(8): 1796-1807.
[23]LIANG B, CHENG H Y, KONG D Y, et al. Accelerated reduction of chlorinated nitroaromatic antibiotic chloramphenicol by biocathode[J]. Environmental Science & Technology, 2013, 47(10): 5353-5361.
[24]JAFARY T, DAUD W R W, GHASEMI M, et al. Biocathode in microbial electrolysis cell: present status and future prospects[J]. Renewable and Sustainable Energy Reviews, 2015, 47: 23-33.
[25]WANG Y H, WU J Y, YANG S K, et al. Electrode modification and optimization in air-cathode single-chamber microbial fuel cells[J]. International Journal of Environmental Research and Public Health, 2018, 15(7): 1349.
[26]WANG L, YOU L X, ZHANG J M, et al. Biodegradation of sulfadiazine in microbial fuel cells: Reaction mechanism, biotoxicity removal and the correlation with reactor microbes[J]. Journal of Hazardous Materials, 2018, 360: 402-411.
[27]ZHOU Y, ZHU N W, GUO W Y, et al. Simultaneous electricity production and antibiotics removal by microbial fuel cells[J]. Journal of Environmental Management, 2018, 217: 565-572.
[28]SUN F, LIU H, LIANG B, et al. Reductive degradation of chloramphenicol using bioelectrochemical system (BES): A comparative study of abiotic cathode and biocathode[J]. Bioresource Technology, 2013, 143: 699-702.
[29]KONG D Y, LIANG B, LEE D J, et al. Effect of temperature switchover on the degradation of antibiotic chloramphenicol by biocathode bioelectrochemical system[J]. Journal of Environmental Sciences, 2014, 26(8): 1689-1697.
[30]YANG X L, ZHANG S, LI H, et al. Effects of voltage on sulfadiazine degradation and the response of Sul genes and microbial communities in biofilm-electrode reactors[J]. Ecotoxicology and Environmental Safety, 2018, 151: 272-278.
[31]GUO N, WANG Y K, YAN L, et al. Effect of bio-electrochemical system on the fate and proliferation of chloramphenicol resistance genes during the treatment of chloramphenicol wastewater[J]. Water Research, 2017, 117: 95-101.
[32]ZHANG Q H, ZHANG Y Y, LI D P. Cometabolic degradation of chloramphenicol via a meta-cleavage pathway in a microbial fuel cell and its microbial community[J]. Bioresource Technology, 2017, 229: 104-110.
[33]YAN W F, GUO Y Y, XIAO Y, et al. The changes of bacterial communities and antibiotic resistance genes in microbial fuel cells during long-term oxytetracycline processing[J]. Water Research, 2018, 142: 105-114.
[34]ZHANG E R, YU Q L, ZHAI W J, et al. High tolerance of and removal of cefazolin sodium in single-chamber microbial fuel cells operation[J]. Bioresource Technology, 2018, 249: 76-81.
[35]ALEXANDRINO D A M, MUCHA A P, ALMEIDA C M R, et al. Biodegradation of the veterinary antibiotics enrofloxacin and ceftiofur and associated microbial community dynamics[J]. Science of the Total Environment, 2017, 581/582: 359-368.
[36]MIRAN W, JANG J, NAWAZ M, et al. Biodegradation of the sulfonamide antibiotic sulfamethoxazole by sulfamethoxazole acclimatized cultures in microbial fuel cells[J]. Science of the Total Environment, 2018, 627: 1058-1065.
[37]KONG D Y, YUN H, CUI D, et al. Response of antimicrobial nitrofurazone-degrading biocathode communities to different cathode potentials[J]. Bioresource Technology, 2017, 241: 951-958.
[38]WANG J, ZHOU B Y, GE R J, et al. Degradation characterization and pathway analysis of chlortetracycline and oxytetracycline in a microbial fuel cell[J]. RSC Advances, 2018, 8(50): 28613-28624.
[39]CHEN J F, HU Y Y, HUANG W T, et al. Biodegradation of oxytetracycline and electricity generation in microbial fuel cell within situ dual graphene modified bioelectrode[J]. Bioresource Technology, 2018, 270: 482-488.
[40]BAJAJ A, MAYILRAJ S, MUDIAM M K, et al. Isolation and functional analysis of a glycolipid producing Rhodococcus sp. strain IITR03 with potential for degradation of 1,1,1-trichloro-2,2-bis(4-chlorophenyl) ethane (DDT)[J]. Bioresour Technol, 2014, 167: 398-406.
[41]WANG L, LIU Y L, MA J, et al. Rapid degradation of sulphamethoxazole and the further transformation of 3-amino-5-methylisoxazole in a microbial fuel cell[J]. Water Research, 2016, 88: 322-328.
[42]PANT D, VAN BOGAERT G, PORTO-CARRERO C, et al. Anode and cathode materials characterization for a microbial fuel cell in half cell configuration[J]. Water Science and Technology, 2011, 63(10): 2457-2461.
[43]WU D, SUN F Q, ZHOU Y. Degradation of chloramphenicol with novel metal foam electrodes in bioelectrochemical systems[J]. Electrochimica Acta, 2017, 240: 136-145.
[44]LI H, XU H, YANG Y L, et al. Effects of graphite and Mn ore media on electro-active bacteria enrichment and fate of antibiotic and corresponding resistance gene in up flow microbial fuel cell constructed wetland[J]. Water Research, 2019, 165: 114988.
[45]HOFFMAN L R, DARGENIO D A, MACCOSS M J, et al. Aminoglycoside antibiotics induce bacterial biofilm formation[J]. Nature, 2005, 436(7054): 1171-1175.
[46]ZHOU L A, JIANG Y H, WAN Y X, et al. Electron flow shifts from anode respiration to nitrate reduction during electroactive biofilm thickening[J]. Environmental Science & Technology, 2020, 54(15): 9593-9600.
[47]FLEMMING H C, WINGENDER J, SZEWZYK U, et al. Biofilms: An emergent form of bacterial life[J]. Nature Reviews Microbiology, 2016, 14(9): 563-575.
[48]ZHOU L A, LI T, AN J K, et al. Subminimal inhibitory concentration (sub-MIC) of antibiotic induces electroactive biofilm formation in bioelectrochemical systems[J]. Water Research, 2017, 125: 280-287.
[49]MOSCOVIZ R, TOLEDO-ALARCN J, TRABLY E, et al. Electro-fermentation: How to drive fermentation using electrochemical systems[J]. Trends in Biotechnology, 2016, 34(11): 856-865.
[50]GUO N, WANG Y K, TONG T Z, et al. The fate of antibiotic resistance genes and their potential hosts during bio-electrochemical treatment of high-salinity pharmaceutical wastewater[J]. Water Research, 2018, 133: 79-86.
[51]BUTTI S K, VELVIZHI G, SULONEN M L K, et al. Microbial electrochemical technologies with the perspective of harnessing bioenergy: Maneuvering towards upscaling[J]. Renewable and Sustainable Energy Reviews, 2016, 53: 462-476.
[52]VELVIZHI G, MOHAN S V. Biocatalyst behavior under self-induced electrogenic microenvironment in comparison with anaerobic treatment: Evaluation with pharmaceutical wastewater for multi-pollutant removal[J]. Bioresource Technology, 2011, 102(23): 10784-10793.
[53]OH S T, KIM J R, PREMIER G C, et al. Sustainable wastewater treatment: How might microbial fuel cells contribute[J]. Biotechnology Advances, 2010, 28(6): 871-881.
[54]PATIL S A, HARNISCH F, KAPADNIS B, et al. Electroactive mixed culture biofilms in microbial bioelectrochemical systems: The role of temperature for biofilm formation and performance[J]. Biosensors and Bioelectronics, 2010, 26(2): 803-808.
[55]CECCONET D, MOLOGNONI D, CALLEGARI A, et al. Biological combination processes for efficient removal of pharmaceutically active compounds from wastewater: A review and future perspectives[J]. Journal of Environmental Chemical Engineering, 2017, 5(4): 3590-3603.
[56]YAN W F, XIAO Y, YAN W D, et al. The effect of bioelectrochemical systems on antibiotics removal and antibiotic resistance genes: A review[J]. Chemical Engineering Journal, 2019, 358: 1421-1437.
[57]LI H, CAI Y, GU Z L, et al. Accumulation of sulfonamide resistance genes and bacterial community function prediction in microbial fuel cell-constructed wetland treating pharmaceutical wastewater[J]. Chemosphere, 2020, 248: 126014.
[58]ZHANG S, SONG H L, YANG X L, et al. Dynamics of antibiotic resistance genes in microbial fuel cell-coupled constructed wetlands treating antibiotic-polluted water[J]. Chemosphere, 2017, 178: 548-555.
[59]JIANG C J, LIU L F, CRITTENDEN J C. An electrochemical process that uses an Fe0/TiO2 cathode to degrade typical dyes and antibiotics and a bio-anode that produces electricity[J]. Frontiers of Environmental Science & Engineering, 2016, 10(4): 1-8.
[60]ZHAO W J, QU J, ZHOU Y J, et al. Continuous flow electrosorption-microbial fuel cell system for efficient removal of oxytetracycline without external electrical supply[J]. Bioresource Technology, 2019, 290: 121751.
[61]LI Y H, LIU L F, YANG F L, et al. Performance of carbon fiber cathode membrane with C-Mn-Fe-O catalyst in MBR-MFC for wastewater treatment[J]. Journal of Membrane Science, 2015, 484: 27-34.
[62]LI Y H, LIU L F, YANG F L. Destruction of tetracycline hydrochloride antibiotics by FeOOH/TiO2 granular activated carbon as expanded cathode in low-cost MBR/MFC coupled system[J]. Journal of Membrane Science, 2017, 525: 202-209.
(編辑 胡玲)
