不同大樱桃品种营养成分分析及体外抗氧化作用研究*
2021-09-12周小魏吕佳欣熊仁次王振华
郭 艳,周小魏,吕佳欣,熊仁次,王振华
(1 烟台市科技创新促进中心,山东264003)(2 塔里木大学植物科学学院)(3 烟台大学生命科学学院)
樱桃(Cerasusspp.),又名车厘子、英桃和莺桃,是蔷薇科(Rosaceae)樱属(CerasusMill.)植物。自古以来,樱桃就是果中之珍品,果实色彩鲜艳、小巧玲珑,为人们所喜爱[1]。中国樱桃原产于我国,在我国有2 000 多年的栽培历史,且分布广泛,主要生长于山东、河南、江苏、浙江、江西、四川等地[2]。樱桃果实成熟期早,享有“早春第一果”的美誉,其色彩亮丽,汁多肉厚,营养丰富。果实性温、味甜,有调气活血、调中益脾、平肝祛热之功效[3]。樱桃中含有丰富的花色苷、p-香豆酸、没食子酸、堪非醇、紫苏醇、褪黑激素和槲皮素等天然的具有保健功能的成分[4],具有抗氧化、缓解关节痛和痛风、降低心血管疾病的风险、防治癌症、控制糖尿病及其并发症、调节生理节律、提高睡眠质量及大脑保健等作用[5];另一方面,每百克樱桃中含铁多达59 mg,居于水果首位。樱桃中具有保健功能的成分被分离、分析与鉴定,研究发现樱桃具有相当高的抗氧化能力[6-8]。
本文通过分析山东省烟台市及其周边不同大樱桃品种的营养成分,并探索大樱桃粗提物对大鼠心肌细胞氧化损伤的保护作用,以期为大樱桃的加工利用提供参考。
1 材料与方法
1.1 试验材料
试验材料购买于山东省烟台市田园大樱桃专业合作社,分别采摘成熟期的‘意大利红’‘美早’‘先锋’‘红灯’‘水晶’‘拉宾斯’和‘萨米托’7个大樱桃品种,每个品种各15 kg,用于测定营养成分和提取花色苷等。
柠檬酸(Sigma)、硫酸(烟台双水化学有限公司)、钼酸铵(天津大茂有限公司)、冰乙酸(天津百世化工有限公司)、草酸(Sigma)、蒽酮(Sigma)、乙醇(山东禹王有限公司)等试剂均为分析纯。
1.2 试验仪器与设备
JJ-2 组织捣碎匀浆机,HH-2数显恒温水浴锅(金坛市科兴仪器厂),旋转蒸发仪RE-5205(上海亚荣生化仪器厂),真空冷冻干燥机(北京亚星仪科科技发展有限公司),AR2130电子天平(Ohaus Corp.Pine Brook,NJ,USA),Micro 21R 高速冷冻离心机(Thermo Fisher Scientific Inc),酶标仪(Molecular Devices Corporation),FACSAria 流式细胞仪(Becton Dickinson),恒温二氧化碳培养箱(SANYO)。
1.3 试验方法
1.3.1 营养指标的测定
总糖含量用蒽酮指示剂法测定,可滴定酸含量用酸碱滴定法测定,维生素C含量用钼蓝比色法测定,蛋白质含量采用考马斯亮蓝G250 染色法测定,总酚含量采用Waterhouse方法测定,类黄酮含量采用直接测定法以黄酮类化合物为对照测定其含量,总花色苷含量采用pH示差法测定。
1.3.2 总花色苷的提取
酸化乙醇法提取:选果30个左右,洗净、沥水、称重、去核,打浆放置于锥形瓶中,称取10 g匀浆液,柠檬酸浓度8 g/L(溶剂为50%乙醇),料液比1∶3,时间3 h,乙醇浓度50%,温度60 ℃,4 000 r/min 离心10 min,取上清液,减压浓缩至2~3 mL,膏状,真空浓缩干燥,得到大樱桃总花色苷提取物。
1.3.3 抗氧化能力的测定
(1)DPPH自由基清除试验。DPPH自由基清除活性,制备提取液,将0.1 mL 稀释至合适倍数的样品提取液或标准品溶液与3.9 mL 60 mmol/L DPPH测定液混匀后避光室温反应2 h,测定515 nm处的吸光值。标准曲线为Trolox 用甲醇(含1%甲酸)落解并稀释至25、50、75、100、125、150、175、200μg/mL 浓度梯度。DPPH自由基清除活性以mg Trolox/100 g 表示。
(2)羟基自由基清除试验。Fenton反应是生成羟基自由基的常用方法。分别取0.2 mol/L FeSO4溶液、2 mmol/L 水杨酸及稀释的2 mg/L 不同提取液各1 mL 混合,编号1~7号,以中国毛樱桃抗氧化提取物以及维生素C为对照,分别在8、9号管中加入1 mL 的2 mg/L 对照样品混合。最后分别加入6 mmol/L H2O21.0 mL,以蒸馏水定容至10 mL 启动反应,空白以蒸馏水代替。37℃水浴反应1 h后,在λ=520 nm 下测定OD 值。
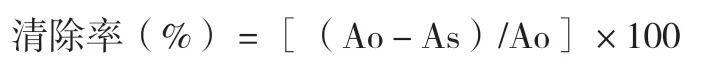
(3)超氧阴离子清除试验。取试剂a(1 mol/L HCl 48.0 mL,Tris 36.6 g,EDTA 0.23 mL,加蒸馏水定容至100 mL)与试剂b(0.14 g 过硫酸铵加蒸馏水定容至100 mL),按照1∶4混合产生超氧自由基。1 min后,分别吸取2 mL 混合液至编号为1~8号的试管中,分别加入1 mL 稀释的2 mg/L 的不同大樱桃品种的抗氧化提取物,以维生素C为对照,分别在9、10 号管中加入1 mL 的2 mg/L 对照样品。空白以蒸馏水代替,加10 mmol/L 盐酸羟氨胺0.4 mL混合,25℃反应30 min。再加入17 mmol/L 的对氨基苯磺酸和7 mmol/L α-萘胺各2 mL,25℃反应30 min。反应显色后加入7.4 mL 的正丁醇,充分摇匀,静置分层。取正丁醇相,在λ=520 nm下测定OD值。
1.3.4 对心肌细胞的保护作用试验
大鼠心肌细胞H9C2(购自中国科学院上海细胞库)以1×106个/mL 密度接种于6 孔板中,待生长至80%~90%融合度时,加入30 μg/mg 浓度大樱桃提取物(经0.45μm 微孔滤膜过滤除菌,空白组和模型组加入等量的DMEM培养基)孵育24 h后,再加入DCFH-DA探针孵育30 min 后,加入300 μmol/L 的H2O2溶液,处理2 h,488 nm、529/590 nm酶标仪荧光检测活性氧(Reactive oxygen species,ROS)的生成。
1.4 数据分析
试验数据采用GraphPad Prism 7 进行数据整理和作图。
2 结果与分析
2.1 营养成分的分析
由图1可知,总糖含量,‘水晶’最高,为29.68%,其他6 个大樱桃品种的总糖含量均为20.00%左右;可滴定酸含量,‘水晶’略低,为0.51%,其他6个大樱桃品种的可滴定酸含量为0.60%~0.90%;维生素C含量,‘先锋’最高,为400 mg/kg,其次为‘红灯’和‘拉宾斯’,含量略高于其他品种;类黄酮含量,‘意大利红’最高,达1.1 mg/g,而含量最低的‘水晶’为0.6 mg/g;总酚含量,‘先锋’和‘拉宾斯’较高,分别为2.6、2.5 mg/g,‘美早’的总酚含量最低,为1.6 mg/g;蛋白质含量,‘先锋’最高,‘水晶’最低。
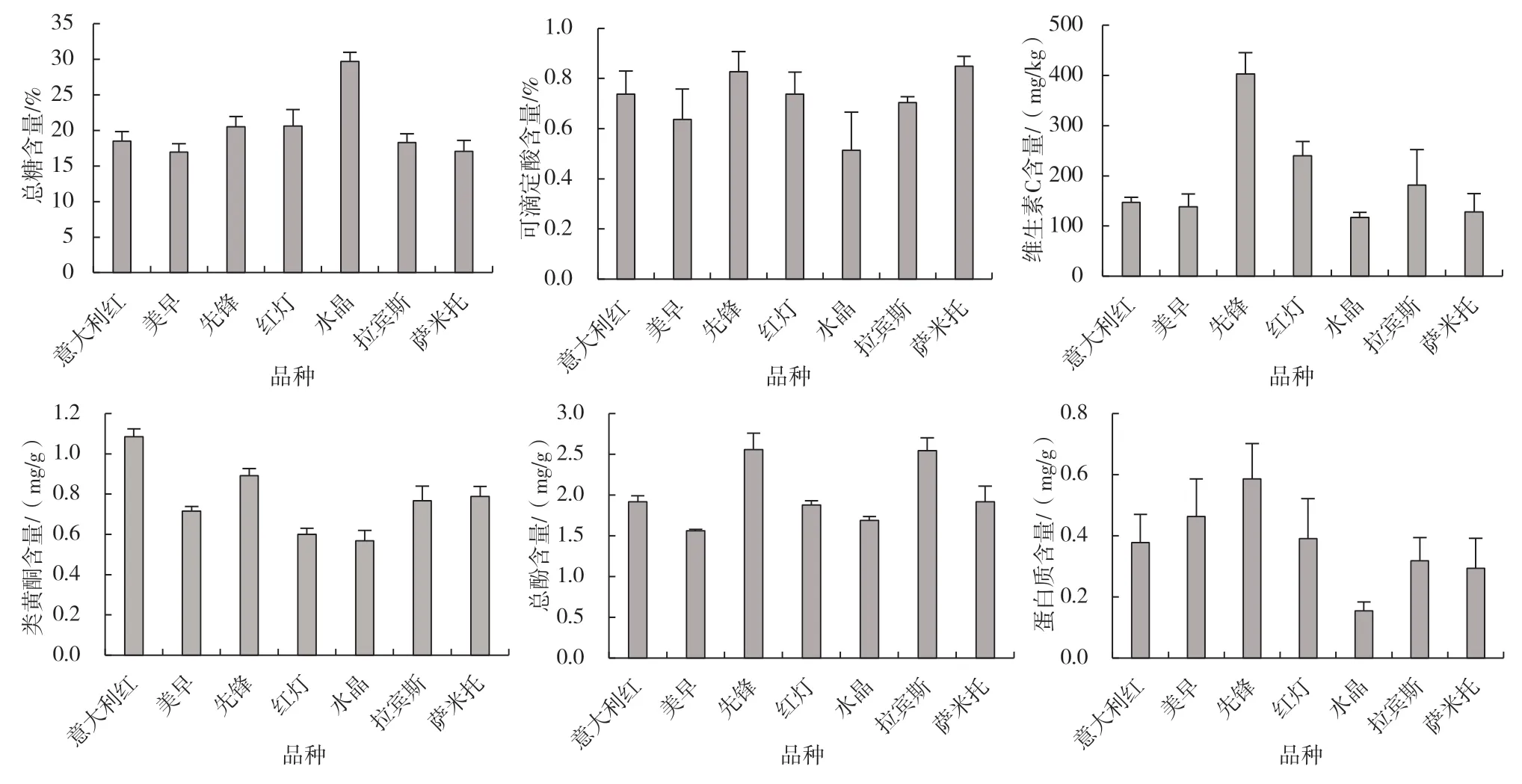
图1 7个大樱桃品种的营养成分
2.2 花色苷含量的比较
由图2 可以看出,7个大樱桃品种都含有一定量的花色苷,‘意大利红’含量最高,为9.04 mg/L,‘水晶’的花色苷含量最低。
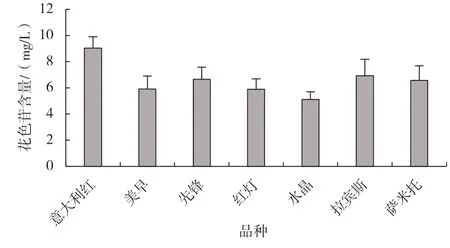
图2 7 个大樱桃品种的花色苷含量
2.3 抗氧化能力的测定
羟自由基清除率的大小可反映大樱桃提取物的抗氧化能力。由图3可以看出,‘意大利红’‘水晶’和‘拉宾斯’3个大樱桃品种有较强的羟自由基清除抗氧化能力,羟自由基清除率均超过了20%。在清除氧自由基的过程中,‘美早’和‘红灯’2 个大樱桃品种的清除率最高,这可能和其中的类黄酮、总酚以及花色苷等成分有一定的关系。通过检测待测物质和DPPH反应后的吸光度,获得反应前后DPPH 的浓度变化,可判断待测物质的清除DPPH自由基能力。7个大樱桃品种的提取物对DPPH 自由基都有一定的清除能力,其中‘拉宾斯’的清除能力最强。7个大樱桃品种的提取物对H2O2引起的心肌细胞氧化作用都有一定的保护作用。通过对30 μg/mg 浓度的粗提物进行试验,结果显示,7个大樱桃品种的提取物与空白组和对照组进行比较,DCF 荧光值较对照组有所降低。‘意大利红’和‘美早’2个大樱桃品种的提取物抗氧化能力略高于其他品种。
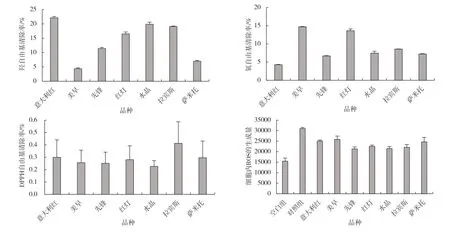
图3 7 个大樱桃品种体外抗氧化能力
3 结论
本研究通过测定7个大樱桃品种的6 个营养成分,并从清除羟自由基、氧自由基、DPPH自由基和细胞ROS 角度评价了大樱桃的体外抗氧化能力。在营养成分方面,‘水晶’的总糖含量最高,‘先锋’和‘萨米托’的可滴定酸含量最高,‘先锋’的维生素C含量最高,‘意大利红’的类黄酮含量最高,‘先锋’和‘拉宾斯’的总酚含量高于其他品种,‘先锋’的蛋白质含量最高,‘意大利红’的花色苷含量最高。
此外,通过体外心肌细胞试验,发现7个大樱桃品种都有一定的抗氧化能力,‘意大利红’清除能力最强。缺血性心脏病的发生和发展与氧化应激所致的细胞损伤密切相关,缺血心肌再灌注后机体产生大量氧自由基,导致机体氧化与抗氧化能力失衡,而线粒体作为ROS的主要产生场所,也是ROS最常攻击的部位,过量的ROS会引起线粒体功能损伤[9-11]。大樱桃中含有大量的花色苷类化合物,花色苷是花色素与糖以糖苷键结合而成的一类化合物[12-16],花色苷对羟自由基、超氧自由基、DPPH自由基等均有很好的清除作用,可防止大分子物质的氧化损伤[17-19]。综上,大樱桃是一种营养丰富的功能性食品原料,对细胞氧化损伤产生的ROS也具有较强的清除能力,因而本研究的结果可为大樱桃后期的食品加工利用提供一定参考。
