硫化氢对白桦悬浮细胞中IAA·ABA和次生代谢物累积的影响
2021-09-11叶子诺翟明霞周文洋肖婉莹詹亚光范桂枝
叶子诺 翟明霞 周文洋 肖婉莹 詹亚光 范桂枝


摘要 [目的]探究硫化氫(H2S)对白桦悬浮细胞中吲哚乙酸(IAA)、脱落酸(ABA)以及多酚和三萜等次生代谢物累积的影响。[方法]采用酶联免疫吸附法、实时荧光定量PCR和比色法等分析IAA和ABA含量及其关键酶基因表达水平、黄酮和三萜等次生代谢物含量。[结果]H2S供体硫氢化钠(NaHS)处理对白桦悬浮细胞中IAA、ABA的累积存在浓度和时间效应,其中1.0 mmol/L H2S供体NaHS处理12 h时ABA含量达最高值,比对照增加了196.46%,而IAA含量在0.1 mmol/L H2S供体NaHS处理3 h时达最高值,比对照增加了5.55%。ABA或H2S处理后白桦悬浮细胞中次生代谢产物积累呈增加趋势,而IAA处理则相反。1.0 mmol/L H2S供体NaHS与不同浓度的IAA和ABA分别处理白桦悬浮细胞24 h后,不同程度地提高了白桦悬浮细胞中多酚、黄酮、三萜含量。其中,1.0 mmol/L ABA与 NaHS共同处理后白桦悬浮细胞中多酚、黄酮、三萜含量均达到最大值,分别比NaHS单独处理增加了17.89%、14.74%和8.87%。[结论]H2S处理促进白桦悬浮细胞中IAA、ABA和次生代谢物的累积,H2S与IAA或ABA共同处理可进一步促进次生代谢产物的累积。
关键词 H2S;白桦;IAA;ABA;次生代谢产物
中图分类号 S792.153 文献标识码 A 文章编号 0517-6611(2021)17-0117-05
doi:10.3969/j.issn.0517-6611.2021.17.032
Abstract [Objective]The purpose of this study was to clarify the effect of hydrogen sulfide (H2S) on the accumulation of indoleacetic acid (IAA), abscisic acid (ABA) and secondary metabolites in birch (Betula platyphylla Suk.) suspension cultures.[Method]The colorimetric method, real-time quantitative PCR and enzyme-linked immunosorbent assay were used to analyze the contents of flavones, polyphenols, triterpenes, IAA and ABA, and the gene expression level of IAA and ABA-related key enzyme.[Result]The results showed the concentration and time effects of H2S donor sodium sulfide (NaHS) on the accumulation of IAA and ABA in the birch suspension cells. Among the cells, the highest level of ABA was at 1.0 mmol/L H2S donor NaHS after 12 h treatment, with increasing rates of 196.46% compared to the control.And the highest level of IAA was at 0.1 mmol/L H2S donor NaHS after 3 h treatment, with increasing rates of 5.55% compared to the control. The accumulation of secondary metabolites in the birch suspension cells showed an increasing trend after ABA or H2S treatment, while the opposite was observed after IAA treatment. Treatment on birch suspension cell with 1.0 mmol/L H2S donor NaHS and different concentrations of IAA and ABA for 24 h increased the polyphenols, flavones and triterpenes levels, respectively. Polyphenols, flavonoids and triterpenes reached maximum levels after combined treatment with 1.0 mmol/L ABA and NaHS; the levels increased by 17.89%, 14.74% and 8.87%, compared to NaHS treatment, respectively.[Conclusion]H2S treatment induced the synthesis of IAA and ABA and the accumulation of secondary metabolites in the birch suspension cells. Co-treatment with H2S and IAA or ABA respectively, could further promote the accumulation of secondary metabolites.
Key words H2S;Betula platypylla Suk.;IAA;ABA;Secondary metabolites
白桦(Betula platyphylla Suk.)为桦木科(Betulaceae)桦木属(Betulalinn)的落叶乔木,适应性强,在我国分布范围广[1]。白桦富含三萜类、黄酮类、多酚类等次生代谢物,其中白桦酯醇和白桦酯酸等三萜物质是白桦的代表性次生代谢物,具有抗菌、抗病毒、提高机体免疫力、抗肿瘤等多重功能[2-4]。为了安全并可持续地利用白桦次生代谢物资源,笔者前期利用组织培养技术建立了白桦悬浮细胞培养体系,并证实白桦悬浮细胞中含有白桦酯醇、白桦酯酸和齐墩果酸等三萜物质、多酚和黄酮等次生代谢物。同时发现,外源添加腐胺、一氧化氮、水杨酸、茉莉酸以及硫化氢(H2S)等诱导子可以显著地促进白桦悬浮细胞中黄酮、白桦酯醇等次生代谢产物的累积[5]。
H2S作为继一氧化氮与一氧化碳之后的新兴气体信号分子[6],在调节植物生长发育、延缓植物衰老等多种植物生理活动中发挥着重要作用。同时有研究证明,外源的H2S处理可以促进多种次生代谢产物的合成[7-9],但其机制却鲜见报道。有研究证明,植物体内H2S信号与吲哚乙酸(IAA)及脱落酸(ABA)之间存在着相互作用:H2S供体NaHS可以促进IAA缺陷型黄瓜的不定根生长,同时通过抑制IAA转运也可以逆转NaHS诱导的不定根生长[10];H2S介入ABA的信号转导引发保卫细胞的气孔关闭,同时外源的ABA处理可以明显提高植物内H2S含量[11]。由此推测,H2S引起的白桦次生代谢产物累积可能与IAA和ABA相关。为此,笔者以初期发现的促进白桦悬浮细胞中多酚、三萜等次生代谢产物累积的诱导子H2S为研究对象,分析H2S对白桦悬浮细胞中IAA和ABA累积的影响,探究H2S与IAA、ABA共同处理对白桦悬浮细胞内次生代谢产物累积的影响,以期为解决植物培养物中次生代谢物的低产问題提供理论依据。
1 材料与方法
1.1 材料
白桦悬浮细胞来自白桦组培苗茎段诱导的愈伤组织,白桦组培苗来自东北林业大学白桦强化种子园5~7 年生嫁接优树(接穗30年生)的腋芽。将白桦悬浮细胞接种于附加0.1 mg/L 6-BA+0.01 mg/L TDZ,1 g/L酸水解酪蛋白,20 g/L蔗糖的B5液体培养基中,pH为5.5~6.0。100 mL摇瓶内加入50 mL培养液,每瓶接种6 g白桦悬浮细胞,每隔7 d继代1次,培养温度为25~27 ℃,光照时间16 h/d,光照强度为2 000 lx,摇床转速为130 r/min。
1.2 方法
1.2.1 外源H2S和IAA、ABA处理。
将H2S供体硫氢化钠(NaHS)溶液加入到培养8 d的白桦悬浮细胞培养体系中,使其最终浓度分别为0.1、0.5、1.0、5.0 mmol/L,对照(CK)中加入等体积的无菌水,处理3、6、12、24、48、96 h后分别取样,每处理3次重复。
H2S分别与IAA、ABA共处理:将IAA、ABA、NaHS+IAA、NaHS+ABA溶液分别加入到培养8 d的白桦悬浮细胞培养体系中,使NaHS终浓度为1.0 mmol/L,IAA及ABA终浓度分别为0.1、0.5、1.0、5.0 mmol/L,对照(CK)中加入等体积无菌水,处理24 h后取样。
1.2.2 次生代谢产物的测定。
1.2.2.1 三萜含量的测定。采用比色法,取200 μL样品于5 mL试管中,置于70 ℃水浴蒸干,加入200 μL新配的5%香草醛冰醋酸溶液,再加入800 μL高氯酸混匀,置于70 ℃水浴15 min后冷却至室温。用乙酸乙酯定容至4 mL,利用分光光度计测定551 nm处吸光值。对照组加入200 μL乙酸乙酯,以白桦酯醇作为标准品制作标准曲线,得到回归方程为y=45.030x+0.041(R2=0.995),线性范围为0.004~0.024 mg/mL。
1.2.2.2 黄酮含量的测定。采用比色法,以硼酸-乙酸钠络合试剂(硼酸0.8%,乙酸钠1.0%,均为M/V)为显色剂,吸取2 mL提取液于10 mL离心管中,再加入2 mL络合试剂,混匀后于384 nm处测定吸光值。以试剂空白为对照,利用芦丁为标准品得到回归方程y=2.541x-0.030(R2=0.993),线性范围为0.058~0.348 mg/mL。
1.2.2.3 多酚含量的测定。采用比色法,取5 mL提取液,加入4%现配的香草醛-甲醇溶液,再加1.5 mL浓盐酸,用甲醇定容至10 mL,混匀后于500 nm处测定吸光值。以试剂空白为对照,用没食子作为标品,得回归方程y=100.700x+0.014(R2=0.998),线性范围0.001~0.006 mg/mL。
1.2.3 IAA及ABA含量的测定。
采用间接酶联免疫吸附法(enzyme-linked immuneosorbent ass-ays,ELISA)测定,ELISA试剂盒购自中国农业大学作物化学控制中心。按试剂盒操作说明在490 nm处测定OD值,各样品测定3次。以IAA为标品,回归方程y=-0.254 9x-0.198 6(R2=0.995 3);以ABA为标品,回归方程y=-0.643 8x+2.724 6(R2=0.988 4)。
1.2.4 IAA和ABA合成关键基因的表达量检测。
取新鲜的白桦悬浮细胞经Takara公司的MiniBEST Universal RNA提取试剂盒提取得到总RNA。测定浓度后,利用Oliga dt(18)和M-MLV逆转录酶(Takara)反转录合成cDNA(Takara,code No.2641A)后进行普通PCR电泳验证cDNA与引物质量。通过实时荧光定量PCR测定IAA调控基因GH3.5A、GH3.5B、GH3.9A和ABA合成基因NCED4、ZEP6的表达情况:以白桦微管蛋白基因TU(tublin)为内标参照基因,反应体系总计20 μL,循环40次,具体操作参照说明书。相关引物序列见表1,目的基因的相对表达量用公式2-△△Ct进行计算。
1.2.5 数据处理与作图。
使用Excel 2016进行数据整理,用SPSS 19.0(SPSS Inc.,Chicago)软件和Duncans的方法进行单因素方差分析(ANOVA)及数据的差异性检测。
2 结果与分析
2.1 H2S处理对白桦悬浮细胞中IAA含量及其调控关键酶基因表达的影响
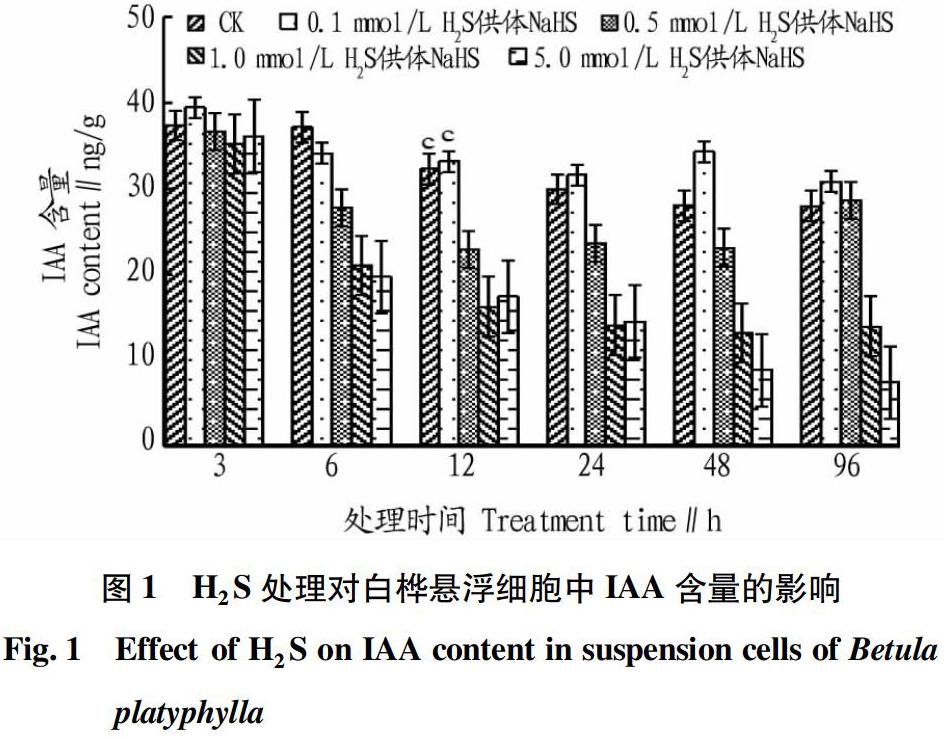
将0.1、0.5、1.0和5.0 mmol/L H2S供体NaHS分别加入到培养8 d的白桦悬浮细胞培养体系中,处理3~96 h,分别于3、6、12、24、48、96 h取样测定IAA含量,结果见图1。从图1可见,IAA含量随着处理时间的增加而降低。处理时间相同时,NaHS处理浓度越大,IAA含量越低,但0.1 mmol/L H2S供体NaHS处理时细胞中IAA含量比CK高。其中,0.1 mmol/L H2S供体NaHS处理3 h时IAA含量达到最高,较CK增加了5.55%;5.0 mmol/L H2S供体NaHS处理96 h时IAA含量最低,比CK降低了73.95%。
进一步利用荧光定量PCR技术测定IAA调控基因GH3的相对表达量,结果见图2~4。除5.0 mmol/L H2S供体NaHS处理GH3.5B基因表达水平呈下降趋势以外,GH3.5A、GH3.5B和GH3.9A对NaHS的响应基本相同,即随着处理时间增加,基因表达量都呈先上升后下降趋势。其中,5.0 mmol/L H2S供体NaHS处理6 h时GH3.5A基因表达水平达到最高,比CK增加了374.17%;5.0 mmol/L H2S供体NaHS处理24 h时GH3.5A基因表达水平降到最低,比CK减少了89.44%。1.0 mmol/L H2S供体NaHS处理24 h时GH3.5B基因表达水平最高,比CK增加了306.57%。5.0 mmol/L H2S供体NaHS处理96 h时GH3.5B基因表达水平最低,比CK降低了80.08%。1.0 mmol/L H2S供体NaHS处理24 h时GH3.9A基因表達水平最高,比CK增加了508.98%;5.0 mmol/L H2S供体NaHS处理96 h时GH3.9A基因表达水平最低,比CK降低了93.17%。
2.2 H2S处理对白桦悬浮细胞中ABA累积和ABA调控关键基因表达的影响
从图5可见,ABA含量随着NaHS处理浓度和处理时间的增加呈先升高后降低趋势,且浓度越高,峰值出现越早。其中,1.0 mmol/L H2S供体NaHS处理12 h时ABA含量最高,比CK增加了196.46%;1.0 mmol/L H2S供体NaHS处理3 h时ABA含量最低,比CK降低了15.26%。
进一步利用荧光定量PCR技术测定ABA调控基因的相对表达量,结果见图6、7。除5.0 mmol/L NaHS处理NCED4基因表达水平呈下降趋势以外,NCED4和ZEP6对NaHS的响应基本相同,呈先上升后下降趋势。其中,1.0 mmol/L H2S供体NaHS处理6 h时NCED4基因表达水平最高,比CK增加了540.72%,0.5 mmol/L H2S供体NaHS处理48 h时NCED4基因表达水平最低,比CK降低了92.13%;1.0 mmol/L H2S供体NaHS处理24 h时ZEP6基因表达水平最高,比CK增加了253.18%,0.5 mmol/L H2S供体NaHS处理96 h时ZEP6基因表达水平最低,比CK降低了76.61%。
2.3 H2S与激素(IAA和ABA)处理对白桦悬浮细胞中细胞产量和次生代谢物累积的影响
前人研究发现,1.0 mmol/L H2S供体NaHS处理24 h后白桦悬浮细胞中三萜和多酚等次生代谢产物积累最高[5]。为此,该研究选用1.0 mmol/L H2S供体NaHS与不同浓度IAA、ABA共处理白桦悬浮细胞,分析NaHS与IAA或ABA共同处理对白桦次生代谢物积累的影响,结果见表2。由表2可知,经1.0 mmol/L H2S供体NaHS处理24 h后,白桦悬浮细胞中多酚、黄酮和三萜含量分别比CK提高了38.74%、33.85%和47.64%。0.1、0.5、1.0和5.0 mmol/L ABA处理可增加白桦悬浮细胞中的多酚、黄酮和三萜含量,增幅在2.18%~29.88%;0.1、0.5、1.0和5.0 mmol/L IAA处理降低白桦悬浮细胞中的多酚、黄酮和三萜含量,降幅在2.65%~21.09%。NaHS与不同浓度的IAA、ABA分别处理后不同程度地提高了白桦悬浮细胞中多酚、黄酮和三萜含量,其中0.1 mmol/L IAA+1.0 mmol/L NaHS共同处理黄酮、三萜含量达到最大值,分别比0.1 mmol/L IAA处理增加了33.98%和12.50%;0.5 mmol/L IAA+1.0 mmol/L NaHS共同处理多酚含量达到最大值,比0.1 mmol/L IAA处理增加了67.81%。1.0 mmol/L ABA+1.0 mmol/L NaHS处理多酚、黄酮和三萜含量达到最大值,分别比1.0 mmol/L ABA单独处理增加了34.23%、18.25%和34.76%,比1.0 mmol/L H2S供体NaHS处理增加了17.89%、14.74%和8.87%。由上述结果可知,在经NaHS处理的白桦悬浮培养体系中添加适当浓度的外源IAA或ABA可进一步促进其次生代谢物的积累。
3 讨论
(1)IAA是发现最早的一类天然植物激素,在植物的组织分化、器官发育、向性表现与成熟衰老等方面发挥着重要作用[12-14]。研究表明,拟南芥H2S信号与IAA之间存在相互作用,IAA参与外源H2S介导的拟南芥主根发育抑制过程[15],同时外源H2S通过影响IAA转运蛋白的表达减少IAA在拟南芥根尖的分布[16]。而白桦悬浮体系中H2S对IAA的影响是否与拟南芥报道相同尚未明确。文献报道GH3基因是植物生长素初期响应基因家族之一[17],同时有研究证明,桦树GH3.5[18]、GH3.6、GH3.9和GH3.3基因参与调节IAA含量,其表达量与IAA含量呈负相关[17]。为此,该研究分析了H2S对白桦悬浮体系中IAA含量和GH3调控基因转录水平的影响,发现低浓度NaHS处理促进IAA的合成,但在NaHS浓度为0.5 mmol/L及以上时IAA含量持续降低,其中5 mmol/L NaHS处理96 h时IAA含量最低,仅为CK的26.05%。而GH3.5A、GH3.5B、GH3.9A 3个GH3基因的转录水平在H2S处理6~48 h时呈增加趋势,其中1.0 mmol/L H2S处理24 h时GH3.5A、GH3.5B和GH3.9A表达量最高,分别比对照提高了126.84%、257.96%和436.17%。由此推测,外源H2S处理后介导白桦悬浮细胞中GH3家族蛋白合成并与细胞内IAA结合,氨基化使IAA失活[19],导致IAA含量降低。
(2)ABA参与植物生长和发育的各个过程,在营养生长、芽休眠、气孔运动以及应答盐、低温、渗透胁迫等方面发挥着多重作用[20-24]。研究表明,蚕豆内H2S参与ABA的信号转导,同时ABA处理可以提高H2S含量[11]。而白桦悬浮体系中H2S对ABA的影响是否与蚕豆报道相同尚未明确。有文献报道玉米黄质环氧酶(ZEP)、醛氧化酶(AAO)和9-顺-环氧类双加氧酶(NCEDs)在ABA间接途径合成中发挥主要调节作用[25],同时也有研究证明,白桦ZEP和NCEDs是ABA合成途径中的关键酶及主要控制节点[26]。为此,该研究分析了H2S对白桦悬浮体系中ABA含量和ZEP6及NCED4调控基因转录水平的影响,结果表明,NaHS处理后,细胞内ABA的含量先升高后下降,并且峰值集中在6~12 h。其中1.0 mmol/L H2S供體NaHS处理12 h时ABA含量达到最高值,较对照增加了196.46%,而在96 h时下降到对照的80.86%。而NCED4和ZEP6基因转录水平分别在H2S处理3~12 h和12~48 h时呈增加趋势,1.0 mmol/L H2S供体NaHS处理12 h分别比对照增加了431.00%和99.49%。由此推测,NCED4是H2S处理诱导ABA合成增加的主要基因,外源H2S通过上调白桦悬浮细胞中NCED4的转录水平进而诱导ABA合成增加,与李丹丹等[27]研究得出的NaHS通过上调黄瓜幼苗叶片的NCED活性以促进ABA合成的结果一致。
(3)H2S在植物抗逆中具有不可或缺的作用,外源H2S处理可以激活植物细胞防御机制,促进植物细胞内多种次生代谢产物积累[7-9],同样该研究在初期也发现,H2S处理可以促进桑黄和白桦悬浮体系中次生代谢物的累积[5],但其促进机制尚未明确。大量研究表明,H2S在植物体内通过与一氧化氮(NO)、IAA、ABA、乙烯(ETH)等信号分子发生相互作用,从而协助植物对抗逆境,以利于其生长发育。陆健敏等[28]研究发现,H2S与ETH发生交互作用从而加速了大豆种子的萌发;在蚕豆中,H2S与ABA共同作用调节其气孔的闭合,并且这种闭合是ABA依赖性的[11];于立旭等[29]用H2S处理黄瓜,发现了黄瓜不定根的生长,同时IAA含量也有短暂提高。因此,对植物生长发育起到重要作用的植物激素IAA、ABA可能介导H2S在植物细胞内引起次生代谢物的合成。为此,该研究进一步对比分析了H2S、IAA、ABA、H2S与ABA和H2S与IAA对白桦次生代谢物累积的影响。研究发现,H2S处理不同程度地提高了白桦悬浮细胞中的多酚、黄酮、三萜含量,分别比对照提高了38.74%、33.85%和47.64%,0.1~5.0 mmol/L ABA处理也增加了白桦悬浮细胞中的多酚、黄酮和三萜含量,增幅在2.18%~29.88%,而0.1~5.0 mmol/L IAA处理降低了白桦悬浮细胞中多酚、黄酮和三萜含量,降幅在2.65%~21.09%。但是,0.1 mmol/L IAA与NaHS共同处理后白桦悬浮细胞中黄酮、三萜含量达到最大值,分别比IAA单独处理增加了33.98%和12.50%,0.5 mmol/L IAA与NaHS共同处理后白桦悬浮细胞中多酚含量达到最大值,比IAA单独处理增加了67.81%。同样,1.0 mmol/L ABA与NaHS共同处理后白桦悬浮细胞中多酚、黄酮和三萜含量上升至最大值,分别比NaHS单独处理增加了17.89%、14.74%和8.87%。由上述结果可知,H2S与IAA或ABA互作处理可进一步促进白桦悬浮细胞中次生代谢物的积累,但其机制还需进一步利用基因工程等技术进行研究。
(4)综上所述,外源H2S处理促进了白桦悬浮细胞培养体系中ABA的合成,抑制了IAA的合成,进而对多酚、黄酮和三萜等的积累分别起到促进或抑制作用,同时H2S与IAA或ABA互作可进一步促进次生代谢物合成。
参考文献
[1] 杨洋.白桦BpTCP7基因的功能研究[D].哈尔滨:东北林业大学,2016.
[2] 傅增辉,金艳,林再红,等.白桦脂醇对慢性应激抑郁模型大鼠行为及神经营养因子表达的影响[J].解剖学杂志,2020,43(3):200-205.
[3] 段晓玲,王海英,杨国亭,等.白桦叶精油的抑菌和抗氧化活性成分分析[J].安徽农业科学,2014,42(33):11746-11748,11777.
[4] 王跃华,刘益丽,马良良,等.TTC—脱氢酶还原法测定滇重楼细胞活力优化条件筛选[J].成都大学学报(自然科学版),2011,30(1):1-3.
[5] 周文洋.H2S诱导白桦悬浮细胞中次生代谢物累积的激素生理机制的初步研究[D].哈尔滨:东北林业大学,2015.
[6] 金竹萍,乔增杰,张丽萍,等.硫化氢通过抑制镉离子内流降低拟南芥体内的镉毒性[J].中国生物化学与分子生物学报,2020,36(1):61-70.
[7] ZHANG H,HU L Y,HU K D,et al.Hydrogen sulfide promotes wheat seed germination and alleviates oxidative damage against copper stress[J].Journal of integrative plant biology,2008,50(12):1518-1529.
[8] LISJAK M,SRIVASTAVA N,TEKLIC T,et al.A novel hydrogen sulfide donor causes stomatal opening and reduces nitric oxide accumulation[J].Plant physiology and biochemistry,2010,48(12):931-935.
[9] WANG Y Q,LI L,CUI W T,et al.Hydrogen sulfide enhances alfalfa(Medicago sativa)to-lerance against salinity during seed germination by nitric oxide pathway[J].Plant and soil,2012,351(1/2):107-119.
[10] 汪伟,张伟,朱丽琴,等.植物硫化氢生理效应及机制研究进展[J].中国农学通报,2013,29(31):78-82.
[11] 刘菁,侯智慧,赵方贵,等.H2S介导ABA诱导蚕豆气孔运动的生理机制研究[J].西北植物学报,2011,31(2):298-304.
[12] SCARPELLA E,MARCOS D,FRIML J,et al.Control of leaf vascular patterning by polar auxin transport[J].Genes & development,2006,20(8):1015-1027.
[13] 金敏,张倩,陶书田,等.IAA及其运输载体PIN对库尔勒香梨萼片脱落与宿存影响的研究[J].现代农业科技,2020(8):46-49.
[14] KERR I D,BENNETT M J.New insight into the biochemical mechanisms regulating auxin transport in plants[J].The biochemical journal,2007,401(3):613-622.
[15] 罗琼.H2S影响拟南芥根系发育的生理及分子调控机制[D].西宁:青海师范大学,2016.
[16] JIA H L,HU Y F,FAN T T,et al.Hydrogen sulfide modulates actin-dependent auxin transport via regulating ABPs results in changing of root development in Arabidopsis[J].Scientific reports,2015,5(1):707-735.
[17] 孙涛,柴团耀,张玉秀.拟南芥GH3基因家族启动子序列分析[J].中国科学院研究生院学报,2010,27(6):847-852.
[18] YANG G,CHEN S,WANG S,et al.BpGH3.5,an early auxin-response gene,regulates root elongation in Betula platyphylla×Betula pendula[J].Plant cell,tissue and organ culture,2015,120(1):239-250.
[19] ZHANG R S,WANG Y C,WANG C,et al.Time-course analysis of levels of indole-3-a-cetic acid and expression of auxin-responsive GH3 genes in Betula platyphylla[J].Plant molecular biology reporter,2011,29(4):898-905.
[20] 李紅,李波,杨曌.外源ABA对苏打盐碱胁迫的紫花苜蓿内源激素含量的影响[J].黑龙江畜牧兽医,2020(6):103-106,111.
[21] 郭文雅,赵京献,郭伟珍.脱落酸(ABA)生物学作用研究进展[J].中国农学通报,2014,30(21):205-210.
[22] SEO M,KOSHIBA T.Complex regulation of ABA biosynthesis in plants[J].Trends in plant science,2002,7(1):41-48.
[23] 姚侠妹,偶春,张源丽,等.脱落酸对盐胁迫下香椿幼苗离子吸收和光合作用的影响[J].东北林业大学学报,2020,48(8):27-32.
[24] WASILEWSKA A,VLAD F,SIRICHANDRA C,et al.An update on abscisic acid signaling in plants and more…[J].Molecular plant,2008,1(2):198-217.
[25] 朱攀攀,刘长英,赵爱春,等.桑树脱落酸生物合成相关基因的鉴定及转录表达分析[J].中国农业科学,2015,48(5):1011-1022.
[26] ZHANG R S,YANG C P,WANG C,et al.Time-course analyses of abscisic acid level and the expression of genes involved in abscisic acid biosynthesis in the leaves of Betula platyphylla[J].Molecular biology reports,2012,39(3):2505-2513.
[27] 李丹丹,张晓伟,刘丰娇,等.H2S与ABA缓解低温胁迫对黄瓜幼苗氧化损伤的交互效应[J].园艺学报,2018,45(12):2395-2406.
[28] 陆健敏,沈芮同,李忠光.硫化氢和乙烯交互作用对大豆种子萌发的影响[J].种子,2018,37(1):88-90.
[29] 于立旭,尚宏芹,张存家,等.外源硫化氢对镉胁迫下黄瓜胚轴和胚根生理生化特性的影响[J].园艺学报,2011,38(11):2131-2139.
