奶牛早期妊娠诊断分子筛选研究
2021-09-11李志明王彦平郭勇王春伟王相国倪和民
李志明 王彦平 郭勇 王春伟 王相国 倪和民

摘要 [目的]探究整合素αv β3、TGF-β、HSP10、PAG、IL-10等妊娠因子在荷斯坦奶牛早期妊娠过程中的规律,筛选奶牛早期妊娠诊断标志因子。[方法]选取49头荷斯坦奶牛,在输精后第7、14、21、28天取外周血,采用荧光定量PCR方法分析整合素αv β3的表达趋势和变化规律,采用酶联免疫吸附试验(ELISA)方法分析TGF-β、HSP10、PAG、IL-10的表达趋势和变化规律。60 d后通过直检对50头荷斯坦奶牛进行怀孕检测。[结果]50头奶牛中有23头受孕、26头未受孕。通过分析受孕和未孕奶牛血液中整合素αv β3基因的表达量,发现整合素αv β3基因在受孕奶牛血液中的表达量高于未孕奶牛,特别是输精后第21、28天受孕奶牛的表达量显著增高(P<0.05);TGF-β、HSP10、PAG、IL-10蛋白质表达量变化在28 d内不能有效区分怀孕奶牛与未孕奶牛。[结论]整合素αv β3可作为奶牛早期妊娠诊断标志因子,理论上可将孕检的时间窗口提前到早期妊娠阶段的第21天。
关键词 荷斯坦奶牛;整合素αv β3;血液;早期妊娠;诊断
中图分类号 S823 文献标识码 A 文章编号 0517-6611(2021)17-0088-04
doi:10.3969/j.issn.0517-6611.2021.17.024
Abstract [Objective] To study the regularity of pregnancy factors such as integrin αv β3, TGF-β, HSP10, PAG, IL-10 in the early pregnancy of Holstein cows, and screen out the marker factors for the early pregnancy diagnosis of dairy cows.[Method] 49 Holstein cows were selected and peripheral blood was taken on the 7th, 14th , 21st, and 28th days after insemination. Fluorescence quantitative PCR was used to analyze the expression trend and change laws of integrin αv β3, and the enzyme-linked immunosorbent assay (ELISA) method was used to analyze the expression trend and change laws of TGF-β, HSP10, PAG, and IL-10. After 60 days, 50 Holstein cows were tested for pregnancy by using rectum examination.[Result] Among 50 detected Holstein cows, 23 cows were pregnant and 26 cows were not. By analyzing the expression of integrin αv β3 gene in the blood of pregnant and non-pregnant dairy cows, it was found that the expression of integrin αv β3 gene in the blood of pregnant dairy cows was higher than that of non-pregnant dairy cows,especially the expression level of dairy cows on the 21st and 28th days after insemination increased significantly(P<0.05) . Through analyzing the expression level changes of TGF-β, HSP10, PAG, IL-10 within 28 days, pregnant cows could not effectively distinguished from non-pregnant cows.[Conclusion] Integrin αv β3 could be used as a diagnostic marker for early pregnancy of dairy cows.In theory, the time window for pregnancy examination could be advanced to the 21st day of early pregnancy.
Key words Holstein cows;Integrin αv β3;Blood;Early pregnancy;Diagnosis
對于奶牛养殖行业而言,配种效率将直接影响企业效益[1],主要表现为产奶量降低、护理成本增加2个方面。因此,对输精奶牛是否妊娠作出尽可能早的判断对于奶牛养殖具有实际意义。母牛在输精后应尽早确定是否妊娠,这对于养殖场的经济效益是非常重要的[2]。经过早期妊娠诊断,可以给妊娠母牛提供更符合孕期所需要的营养与环境,加强饲养管理,使胎儿更好地发育,避免胚胎的早期死亡或流产;可以对未妊娠的母牛及时采取措施进行二次配种;对于多次配种不孕的母牛及时淘汰,通过缩短产犊间隔来降低奶牛的饲养成本。提前检测出奶牛受孕情况能够有效减少孕期奶牛饲料和人工成本,提高经济效益[3-4]。目前诊断奶牛妊娠的直接方法有直肠触诊法、超声波检查法,间接方法有孕酮、早期妊娠因子等[1]。以上诊断方法表现优劣各异,但最早精确诊断的窗口时间为输精后的第28天[5-6]。
因此,越来越多的研究聚焦于寻找新型指示早期妊娠诊断的血液因子。细胞应激源(如热、炎症、转化和胚胎分裂)可以迅速诱导热休克蛋白水平[7]。热休克蛋白10(HSP10)在怀孕期间定位于细胞外,细胞外HSP10通常被称为早孕因子(EPF),因为它在怀孕的第一阶段释放,参与妊娠的建立、胚胎发育以及细胞的增殖和分化[8]。牛妊娠相关糖蛋白(PAG)是对奶牛进行间接早期妊娠诊断的试验中发现的。牛PAG已经被免疫定位于胎儿子叶绒毛中存在的滋养层双核细胞,并从滋养外胚层向子宫上皮的双核细胞迁移,允许含有颗粒的、具有胞吐作用的PAG进入母体循环[9]。TGF-β的生物学活性极其广泛,无论是在早期胚胎发育、胞外基质的合成、软骨和骨的形成过程中,还是在间质纤维化、炎症、免疫和内分泌功能的调节、肿瘤的形成和发展阶段中都发挥着重要的作用[10]。白细胞介素-10(IL-10)在维持免疫耐受方面起到至关重要的作用。研究表明,通过免疫治疗增加 IL-10 的表达量有利于维持妊娠[11]。整合素αv β3是一种异二聚体的跨膜糖蛋白,可在多种细胞中表达,分布较为广泛[12],主要参与细胞黏附、信号转导、炎症反应、血液凝集、肿瘤血管生成等过程。子宫内膜容受态的建立与整合素αv β3在胚胎着床过程中的表达有关[13]。研究表明,对人的子宫而言,整合素αv β3与其配体的检测可以区别其容受态和非容受态[14-16]。在常见动物的早期妊娠研究中也发现整合素與子宫容受态的建立有一定的关联[17-18]。
牛胚胎附植过程发生在输精后20 d前,在这一时间段体内会发生很多改变,可以通过检测奶牛外周血液中整合素αv β3、TGF-β、HSP10、PAG、IL-10等在基因和蛋白质水平的表达差异来诊断奶牛是否妊娠,成为输精后20 d左右检测奶牛是否妊娠的理论依据。
1 材料与方法
1.1 试验材料
1.1.1 主要仪器与设备。RT-PCR仪(Eppendorf,AG00246),电热恒温烘箱(上海一恒科技仪器有限公司,DHG-9075A),高压锅(合肥华泰医疗设备有限公司,AutocLare-G182M),制冰机(Sanyo),移液枪(GiLson),低温离心机(Backman CouLtek,ALLegraTM 64R Centrifuge),微量紫外分光检测系统(ALphaspec Innotech,ALpha SpecTM),手掌离心机(Bratt),紫外可见分光光度计(优尼科仪器有限公司,WFZ-μ-2000型),酶联免疫检测仪(美国BIO-RAD公司)。
1.1.2 主要试剂与耗材。TRLzoLReagent总RNA提取试剂(Invitrogen USA LTD,200 mL/瓶),GoScriptTM反转录系统(Promega),ultra SYBR Mixture(High ROX)(北京康为世纪生物科技有限公司,5 mL/盒),RBC Lysis buffer(北京康为世纪生物科技有限公司,100 mL/瓶),牛白细胞介素10(IL-10)ELISA检测试剂盒(泉州科诺迪生物科技有限公司),牛妊娠相关糖蛋白(PAG)ELISA检测试剂盒(泉州科诺迪生物科技有限公司),牛热休克蛋白10(Hsp-10)ELISA检测试剂盒(泉州科诺迪生物科技有限公司),牛转化生长因子β(TGF-β)ELISA检测试剂盒(泉州科诺迪生物科技有限公司)。
1.2 样品选取与采血方法
于北京首农畜牧发展有限公司奶牛中心选取50头第二次受孕的荷斯坦奶牛,使其同期发情并后期观察记录其受孕情况。
采用牛尾采血法,在距牛尾10 cm处进行乙醇消毒、抽血,将血液转移到提前准备好的抗凝管中保存。
1.3 实时荧光定量PCR
1.3.1 引物。使用Primer-BLAST设计引物,由生工生物工程(上海股份有限公司)北京合成部合成。αv基因的正反向引物分别为CAAGAGCAGCGAGGACTTTG和GCCGATAAACACATATGCGT,合成的片段大小为158 bp;β3基因的正反向引物分别为TGGGGCTGATGACTGAGAGAAG和ACGCACTTCCAGCTCTATT,合成的片段大小为206 bp;β-actin基因的正反向引物分别为CCTGCGGCATTCACGAAACTA和ACTCCTGCTTGCTGATCCACTC,合成的片段大小为148 bp。
1.3.2 TrizoL法提取RNA与反转录。
1.3.2.1 均质化处理。取4 mL新鲜奶牛血液,加入12 mL红细胞裂解液,冰上孵育15 min 并混匀,4 ℃下10 000 r/min离心1 min后收集白细胞,弃上清;于沉淀中加入8 mL红细胞裂解液,充分重悬白细胞,4 ℃下10 000 r/min离心1 min后收集白细胞,吸弃上清液;加入1 mL TrizoL重悬细胞。
1.3.2.2 分层。加入Trizol后用涡旋机振荡5 min,使样品完全裂解(在-80 ℃下保存),静置5 min后加入200 mL氯仿振荡15 s,充分混合液体,4 ℃下12 000 r/min离心15 min,溶液分为3层,上层水相为RNA。
1.3.2.3 RNA沉淀。将200 μL 水相小心吸取转移到新的离心管中,避免吸入下层液体,并在室温下加入 500 μL异丙醇,冰上静置 10 min。4 ℃下12 000 r/min离心10 min后,弃去上清液,RNA沉淀在管底。
1.3.2.4 RNA漂洗。RNA沉淀中加入85%冰乙醇,并用手指弹起沉淀;4 ℃ 7 500 r/min下离心6 min,弃上清,此操作重复2次。
1.3.2.5 溶解 RNA。室温晾干残余的乙醇,然后加入10 μL无RNA酶水轻弹管壁充分溶解RNA。
1.3.2.6 测定RNA浓度。使用微紫外分光光度检测系统的OD260/OD280,测定RNA浓度(单位μg/mL)。
1.3.2.7 合成cDNA。分别加入RNA 3 μL、Oligo(dT)15 Primer 1 μL和Random Primers 1 μL后,在70 ℃下温育5 min后置于冰上5 min。
依次加入GoScriptTM 5X Reaction buffer 4 μL、MgCl2 3 μL、PCR Nucleotide Mix 1 μL、Recombinant RNasinRibonuclease Inhibitor 0.5 μL、GoScriptTM Reverse Transcriptase 0.5 μL和6 μL Nuclease-Free Water并在25 ℃下孵育5 min,于42 ℃下孵育1 h后獲得cDNA。
1.3.3 实时荧光定量 PCR 反应 PCR反应体系。
①添加1 μL Forward Primer,10 μmol/L 1 μL Reserve Primer、10 μmol/L 2 μL Template DNA,25 μL 2×ultraSYBR Mixture(High ROX),用ddH2O补足50 μL。离心10 s后充分振荡3 min,再次离心10 s,确保试剂沉于管底并确保液体无气泡。
②提前打开荧光定量PCR预热15 min。
③PCR反应程序:预变性95 ℃ 10 min;95 ℃ 10 s、59 ℃ 30 s、72 ℃ 32 s,循环40次;第三阶段,95 ℃ 15 s、60 ℃ 1 min、95 ℃ 15 s、60 ℃ 15 s。
1.4 ELISA
从怀孕和未孕奶牛中随机选取5头牛外周血样,使用ELISA试剂盒分别检测TGF-β、HSP10、PAG、IL-10的蛋白表达量。先将用EDTA作为抗凝剂,采集新鲜血液,并将血液在采集后的30 min内于4 ℃1 000×g离心15 min,取上清即可检测。
①所需板条须在室温平衡60 min后使用。
②设置标准品孔、空白孔和样本孔,分别添加不同浓度的标准品50 μL、待测样本50 μL和样本稀释液50 μL。
③各反应孔中加入100 μL辣根过氧化物酶(HRP)标记抗体,用封板膜封住,于37 ℃恒温箱中温育1 h。
④使用洗涤液重复洗板5次。
⑤显色:各反应孔中加入底物A、B溶液各50 μL,37 ℃下避光孵育15 min。
⑥终止反应:于各反应孔中加入终止液50 μL,15 min内测定各孔在波长450 nm处的OD值。
⑦根据标准品曲线,计算各样本浓度值。
1.5 数据统计与分析
使用Excel和SPSS 22.0软件进行数据处理。试验数据均以平均数±标准差表示。
2 结果与分析
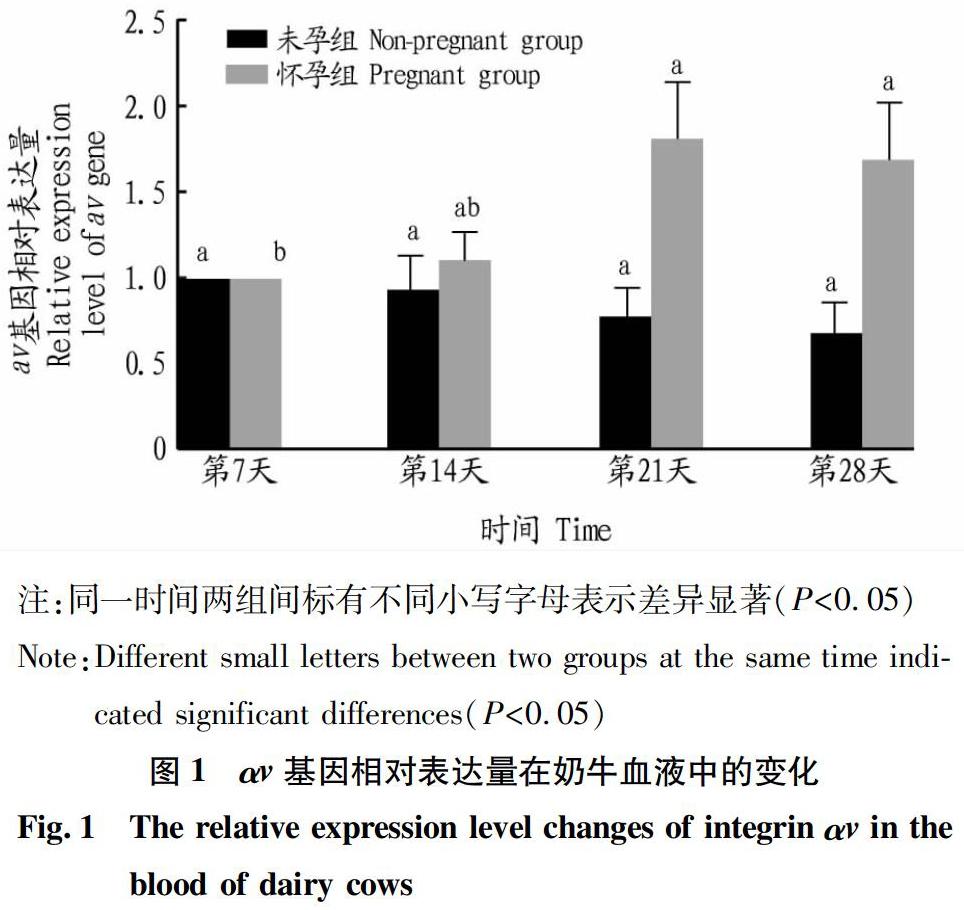
2.1 血液中αv基因相对表达量的变化
如图1 所示,怀孕奶牛在输精后的第21、28天时αv基因表达量显著高于未孕奶牛,同时怀孕奶牛第21、28天表达量显著高于第7天(P<0.05),未孕奶牛αv基因表达量没有显著变化。
2.2 血液中β3基因相对表达量
如图2所示,怀孕奶牛在输精后的第28天时β3基因相对表达量比未孕奶牛明显升高,同时未怀孕奶牛第28天β3基因相对表达量较第21天明显降低,怀孕奶牛的表达量没有显著变化。
2.3 怀孕与未孕奶牛中HSP10蛋白的相对表达量
如图3所示,怀孕奶牛血液中HSP10相对表达量与未孕奶牛相比无显著差异(P>0.05)。
2.4 怀孕与未孕奶牛中PAG的相对表达量
如图4所示,怀孕奶牛血液中PAG相对表达量与未孕奶牛相比无显著差异(P>0.05),并未孕奶牛PAG相对表达量在第7天显著低于第14、28天(P<0.05)。
2.5 怀孕与未孕奶牛中TGF-β的相对表达量
如图5所示,怀孕奶牛血液中TGF-β相对表达量与未孕奶牛相比无显著差异(P>0.05)。
2.6 怀孕与未孕奶牛中IL-10的相对表达量
如图6所示,怀孕奶牛血液中IL-10的相对表达量与未孕奶牛相比无显著差异(P>0.05)。
3 讨论
奶牛的妊娠诊断在实际畜牧生产中具有重要地位,尽早发现奶牛妊娠能够减少其配种次数、降低胚胎死亡率、提早发现空怀现象、缩短产犊间隔时间,提高奶牛繁殖率。经直肠子宫触诊是目前最广泛采用的妊娠诊断方法,可在45 d准确检出;超声检测在人工授精后28~35 d其妊娠诊断的敏感性和特异性才能准确,因此最早的妊娠检测窗口为28 d。该研究旨在探究TGF-β、HSP10、PAG、IL-10、整合素αv β3在奶牛妊娠早期表达量的变化,从而进行奶牛早期妊娠诊断分子筛选,使早期妊娠检测窗口提前至21 d,可及早采取有效措施,提高产犊率和经济收入。
整合素对胚胎着床时滋养细胞(囊胚)与子宫上皮的黏附具有重要作用。该试验探究整合素αv β3在奶牛妊娠早期表达量的变化,探讨其与奶牛妊娠率之间的关系。据报道,整合素αv表达减少会使细胞黏附滋养层球体的能力降低[19]。Tei等[20]研究表明整合素αv β3表达量与受孕结果具有相关性,且整合素αv β3的蛋白表达量增加,母猪总胎儿数和活胎数分别增加[21]。该研究结果表明,整合素αv β3也呈现相似的结果,整合素αv在怀孕奶牛输精后的第21天达到峰值,因此有可能将检测窗口提前到21 d。
在基因水平找到了相关性后,试验将目标转向TGF-β、HSP10、PAG、IL-10蛋白质水平的表达。相关研究证实,早孕因子(EPF)最早是由Ohnuma等[22]在母马中使用玫瑰花样细胞团的抑制滴度(RIT)确定怀孕和未怀孕母马的血清EPF水平有显著差异。Takagi等[23]报道妊娠母马的EPF水平在胚胎去除后降低,在胚胎成功移植受体母马后其EPF水平再次上升;1993年,Wegmann等[24]在妊娠大鼠試验中发现,外周血单个核细胞分泌的细胞因子中 IL-4、IL-5、IL-10的相对表达水平提高,而γ-干扰素的相对表达水平降低。Manjari等[25]研究表明IL-10从怀孕第8天开始呈上升趋势,并在整个孕期保持高水平表达。Rappolee等[26]首次证实转化生长因子-β、转化生长因子-α和血小板衍生生长因子-A在小鼠着床前胚胎中的表达。Watson等[27]也证实生长因子TGFα、TGFβ1、TGFβ2、胰岛素样生长因子-I、胰岛素样生长因子-Ⅱ和血小板衍生生长因子-A在反刍动物着床前并且胚胎中在1-细胞期就有表达,并持续表达到胚胎本身和滋养细胞中(至妊娠30 d)。在绵羊受孕期,已知可诱导上皮间充质转换的转化生长因子β1(TGFβ1)、TGFβ2或TGFβ3的表达在第18天及以后开始增加[28]。研究表明,与未怀孕的奶牛相比,在怀孕的第24天母体血液循环中PAG浓度有所增加[29],在授精后的第24~26天母体血液循环中PAG增加[30-31]。综上所述,TGF-β、HSP10、PAG、IL-10的蛋白质表达量会在妊娠早期发生变化,具有作为早期妊娠诊断分子的潜质。该试验结果表明,TGF-β、HSP10、PAG、IL-10的相对表达量在怀孕和未孕奶牛输精后相同时间内没有差异,认为在取样时奶牛的数量和时间间隔对试验结果造成了不同程度的影响,在后续试验中应扩大奶牛品种选择和奶牛数量,选择不同地区饲养场和缩短采样时间。
4 结论
经试验初步证实整合素αv β3可作为有价值的早期妊娠检测的标志因子。
参考文献
[1] 张飞龙,姚凤桐.奶牛养殖的成本收益分析:以呼和浩特市为例[J].内蒙古科技与经济,2016(13):48-49.
[2] 张榆敏,薛翠云.谈谈家畜早期妊娠诊断的意义及方法[J].畜禽业,2016(2):40-42.
[3] 马林,王凤珍.奶牛繁殖管理的若干措施[J].现代畜牧科技,2018(4):44.
[4] 甄志刚,王春强,吴思思.三种奶牛早期妊娠诊断方法临床应用效果比较[J].现代畜牧兽医,2015(10):35-37.
[5] 徐迪.奶牛的配种、妊娠及分娩[J].畜牧兽医科技信息,2018(9):83-84.
[7] POLEJAEVA I A,CHEN S H,VAUGHT T D,et al.Cloned pigs produced by nuclear transfer from adult somatic cells[J].Nature,2000,407(6800):86-90.
[7] CAVANAGH A C.Identification of early pregnancy factor as chaperonin 10:Implications for understanding its role[J].Rev Reprod,1996,1(1):28-32.
[8] MORTON H.Early pregnancy factor:An extracellular chaperonin 10 homologue[J].Immunol Cell Biol,1998,76(6):483-496.
[9] WOODING F B.The synepitheliochorial placenta of ruminants:Binucleate cell fusions and hormone production[J].Placenta,1992,13(2):101-113.
[10] PASCHE B.Role of transforming growth factor beta in cancer[J].J Cell Physiol,2001,186(2):153-168.
[11] CHENG S B,SHARMA S.Interleukin-10:A pleiotropic regulator in pregnancy[J].Am J Reprod Immunol,2015,73(6):487-500.
[12] 詹同彤.牛孤雌激活和体外受精囊胚共培养前后IFNAR 和整合素 αvβ3 的表达变化[D].北京:北京农学院,2018.
[13] LESSEY B A.Implantation defects in infertile women with endometriosis[J].Ann N Y Acad Sci,2002,955(1):265-280.
[14] MAKKER A,SINGH M M.Endometrial receptivity:Clinical assessment in relation to fertility,infertility,and antifertility[J].Med Res Rev,2006,26(6):699-746.
[15] STROWITZKI T,GERMEYER A,POPOVICI R,et al.The human endometrium as a fertility-determining factor[J].Hum Reprod Update,2006,12(5):617-630.
[16] PEDERSEN H G,SCHMIDT M,SANGILD P T,et al.Clinical experience with embryos produced by handmade cloning:Work in progress[J].Mol Cell Endocrinol,2005,234(1/2):137-143.
[17] MISICA-TURNER P M,OBACK F C,EICHENLAUB M,et al.Aggregating embryonic but not somatic nuclear transfer embryos increases cloning efficiency in cattle[J].Biol Reprod,2007,76(2):268-278.
[18] DUNNE L D,DISKIN M G,SREENAN J M.Embryo and foetal loss in beef heifers between day 14 of gestation and full term[J].Animal Reprod Sci,2000,58(1/2):39-44.
[19] PAULE S,ALJOFAN M,SIMON C,et al.Cleavage of endometrial α-integrins into their functional forms is mediated by proprotein convertase 5/6[J].Hum Reprod,2012,27(9):2766-2774.
[20] TEI C,MARUYAMA T,KUJI N,et al.Reduced expression of αvβ3 integrin in the endometrium of unexplained infertility patients with recurrent IVF-ET failures:Improvement by danazol treatment[J].J Assist Reprod Genet,2003,20(1):13-20.
[21] ZHU J L,ZENG X F,PENG Q,et al.Maternal N-carbamylglutamate supplementation during early pregnancy enhances embryonic survival and development through modulation of the endometrial proteome in gilts[J].J Nutr,2015,145(10):2212-2220.
[22] OHNUMA K,YOKOO M,ITO K,et al.Study of early pregnancy factor(EPF)in equine(Equus caballus)[J].Am J Reprod Immunol,2000,43(3):174-179.
[23] TAKAGI M,NISHIMURA K,OGURI N,et al.Measurement of early pregnancy factor activity for monitoring the viability of the equine embryo[J].Theriogenology,1998,50(2):255-262.
[24] WEGMANN T G,LIN H,GUILBERT L,et al.Bidirectional cytokine interactions in the maternal-fetal relationship:Is successful pregnancy a TH2 phenomenon[J].Immunol Today,1993,14(7):353-356.
[25] MANJARI P,REDDI S,ALHUSSIEN M,et al.Neutrophil gene dynamics and plasma cytokine levels in dairy cattle during peri-implantation period[J].Vet Immunol Immunopathol,2016,173:44-49.
[26] RAPPOLEE D A,BRENNER C A,SCHULTZ R,et al.Developmental expression of PDGF,TGF-alpha,and TGF-beta genes in preimplantation mouse embryos[J].Science,1988,241(4874):1823-1825.
[27] WATSON A J,HOGAN A,HAHNEL A,et al.Expression of growth factor ligand and receptor genes in the preimplantation bovine embryo[J].Mol Reprod Dev,1992,31(2):87-95.
[28] DOR J J JR,WILKINSON J E,GODKIN J D.Ovine endometrial expression of transforming growth factor beta isoforms during the peri-implantation period[J].Biol Reprod,1996,54(5):1080-1087.
[29] REESE S T,PEREIRA M H C,EDWARDS J L,et al.Pregnancy diagnosis in cattle using pregnancy associated glycoprotein concentration in circulation at day 24 of gestation[J].Theriogenology,2018,106:178-185.
[30] POHLER K G,GEARY T W,JOHNSON C L,et al.Circulating bovine pregnancy associated glycoproteins are associated with late embryonic/fetal survival but not ovulatory follicle size in suckled beef cows[J].J Anim Sci,2013,91(9):4158-4167.
[31] GREEN J A,PARKS T E,AVALLE M P,et al.The establishment of an ELISA for the detection of pregnancy-associated glycoproteins(PAGs)in the serum of pregnant cows and heifers[J].Theriogenology,2005,63(5):1481-1503.
