含氰废水选择性浸出酸化渣中铜的试验研究
2021-09-10张建元李名新王洪凯孙宏志顾维鹏
张建元 李名新 王洪凯 孙宏志 顾维鹏


摘要:针对某黄金冶炼企业酸化渣中铜的回收进行研究,提出利用含氰废水浸出酸化渣中的铜。通过控制浸出条件(浸出温度、初始pH和浸出时间)以抑制锌、铁浸出,达到溶液净化的目的,便于后续铜的富集与回收。利用热力学计算和浸出试验相结合,研究酸化渣中铜的浸出和锌、铁净化反应路径。热力学计算结果表明:在碱性条件下,当n(总氰化合物)/n(Cu)=1.71时,硫氰化亚铜被游离氰化物络合全部转化为Cu-CN络合物;当n(总氰化合物)/n(Cu)=5.0时,与锌络合的氰化物被铜全部占据形成Cu-CN络合物。在浸出温度333.15 K,初始pH值11.0,浸出时间120 min和液固比100∶1的条件下,铜浸出率可达99.72 %;浸出液中锌和铁质量浓度几乎为零,二者主要以Na2Zn3[Fe(CN)6]2沉淀形式进入浸出渣中。
关键词:含氰废水;酸化渣;铜;碱性浸出;净化
中图分类号:TD926.5文献标志码:A
文章编号:1001-1277(2021)05-0072-07 doi:10.11792/hj20210516
引 言
氰化法作为一种重要的湿法冶金方法,广泛应用于矿石中贵金属(金和银)提取[1]。由于该方法具有成本低、浸出率高和工艺简单等特点,目前世界90 %以上的黄金冶炼采用氰化法[2-3]。然而,金通常与含铜、铁等硫化矿物伴生,在氰化浸出过程中,部分铜、铁与氰根离子络合形成相应的稳定金属氰化络合物进入浸出液中[4-6]。提金后的氰化贫液通常返回浸出工序循环使用,溶液中的铜、铁会不断富集;铜的不断积累及总氰化合物与铜摩尔比的降低,易造成金浸出率下降及浸出剂消耗量增加[7-8]。因此,从技术和经济性角度出发,通常需要对氰化贫液进行净化以实现有效循环利用。
酸化-吹脱-再生(AVR)工艺广泛用于高浓度含氰废水中氰化物的回收和重金属杂质的净化[9-10]。溶液中金属杂质(Cu、Zn和Fe)在酸性条件下主要以CuCN、CuSCN、Zn2[Fe(CN)6]和Cu2[Fe(CN)6]或其他亚铁氰化物的复合沉淀(根据不同的离子浓度)形式析出。AVR处理后的滤液经中和调浆后返回浸出工艺;含铜AVR沉淀渣(酸化渣)送至堆存场或无害化处理后外售。目前除火法外,未见行之有效的酸化渣处理方法。然而,火法冶炼过程中会产生有毒气体(如NOx、SO2、HCN和(CN)2)[11-12],从而增加了后续尾气处理负荷。本研究利用含氰废水从酸化渣中选择性浸出铜,以提高溶液中铜浓度,便于后续从溶液中回收铜。通过物种优势区分布计算和浸出试验,分别研究了金属杂质Fe、Zn的去除途径,以及Cu-CN-SCN、Cu-Zn-CN和Zn-Fe-CN体系物种转化关系,并通过浸出试验验证方法的可行性。
1 试验部分
1.1 原料与试剂
含氰废水和酸化渣由某黄金冶炼企业提供,其化学成分分析結果见表1和表2,酸化渣X射线衍射(XRD)谱图见图1。该含氰废水pH值为9.48,含盐量为10.12 %。由表2和图1可知,酸化渣中主要物相为CuSCN和Zn2[Fe(CN)6]·3H2O。
试剂:硫酸95.0 %~98.0 %(GR,天津市致远化学试剂有限公司),氢氧化钠(AR,天津科密欧化学试剂有限公司),硝酸、磷酸(AR,天津市富宇精细化工有限公司),乙二胺四乙酸二钠盐(AR,天津市大茂化学试剂工厂),硝酸铁(AR,天津市恒兴试剂有限公司),试银灵指示剂(AR,天津市致远化学试剂有限公司)。
使用超纯水(Milli-Q水净化系统)制备分析溶液。
1.2 试验原理与方法
1.2.1 试验原理
由亚铜-氰化物体系的热力学计算和相关综述文献[13-14]可知,氰化物水溶液中的物种分布主要取决于n(总氰化合物)/n(Cu)和pH。然而,实际生产中的含氰废水通常含有[Fe(CN)6]4-、Zn-CN络合物和大量的SCN-。因此,研究这些物质分布和转化过程对浸出和含氰废水的净化至关重要。
1)Cu(Ⅰ)-CN-SCN体系。在总氰化合物浓度为0.173 mol/L(5.47 g/L)、Cu浓度为0.032 8 mol/L(2.19 g/L)、SCN-浓度为0.078 mol/L(4.41 g/L),不考虑活度系数的条件下,借助Medusa-Hydra化学计算软件,计算出Cu(Ⅰ)-CN-SCN体系物种分布随pH和总氰化合物浓度的变化,结果见图2。
由图2-a)可知:在pH<2.5条件下,铜氰络离子完全转化为CuSCN而不是CuCN[5,15-16],这与酸化渣XRD分析结果一致。当10.0>pH>4.5时,CuSCN和CuCN迅速溶解,形成铜氰络离子(见式(1)、式(2))进入溶液。随着pH进一步增加,主要物种分布没有显著变化。基于此,在pH=12.0时,绘制了lg c总氰化合物为-3.0~0时铜物种分布(见图2-b))。由图2-b)可知:当总氰化合物浓度低于0.025 mol/L(lg c总氰化合物=-1.60)时,会析出氧化亚铜(Cu2O)(见式(3)、式(4));当总氰化合物浓度超过0.056 mol/L(n(总氰化合物)/n(Cu)=1.71,lg c总氰化合物=-1.25)时,不溶物(Cu2O、CuSCN和CuCN)将逐渐溶解。此外,当总氰化合物浓度为0.072 2 mol/L(n(总氰化合物)/n(Cu)=2.2,lg c总氰化合物=-1.14)时,[Cu(CN)2]-和[Cu(CN)3]2-占比均约为48 %,其余为CuCN(约2 %)和[Cu(CN)4]3-(约2 %)。基于该值,固定浸出试验阶段n(总氰化合物)/n(Cu)=2.2。
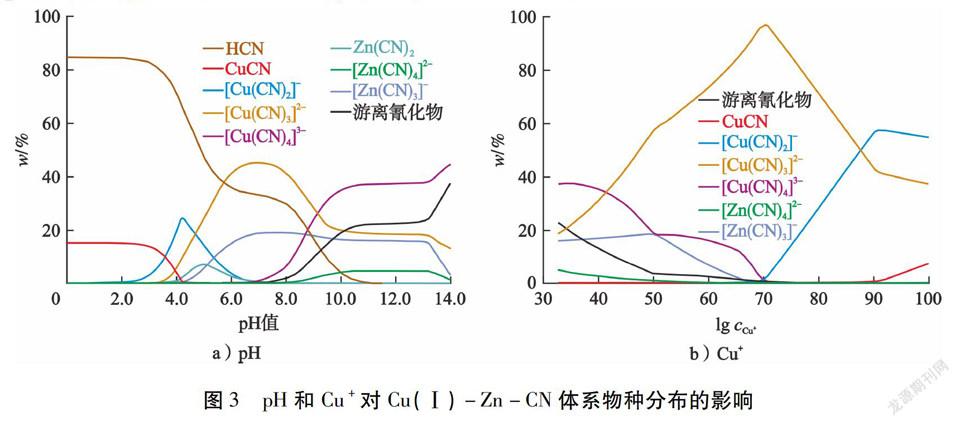
2)Cu(Ⅰ)-Zn-CN体系。在碱性条件下,锌氰络离子和铜氰络离子在氰化溶液中能够稳定存在。了解
Zn2+和Cu+在Cu(Ⅰ)-Zn-CN体系中的物种分布,对Zn2+去除具有重要作用。在恒定离子浓度下,总氰化合物物种分布随pH的变化见图3-a)。由图3-a)可知:当pH<4.0时,总氰化合物主要为HCN,以及少量亚铜和锌的低阶络合物;当pH值为6.0~8.0时,[Cu(CN)3]2-和[Zn(CN)3]-占比超过60 %;当pH>8.0 时,二者进一步转化为高阶络合物。但是,pH值为10.0~13.0时,总氰化合物物种分布没有明显变化。随后,在固定其他离子浓度和pH值为12.0的条件下,考察了亚铜离子浓度对总氰化合物物种分布的影响,结果见图3-b)。由图3-b)可知:亚铜离子浓度从0.032 8 mol/L增加到0.088 0 mol/L时,[Cu(CN)4]3-、[Zn(CN)3]-和[Zn(CN)4]2-明显转化为[Cu(CN)3]2-和[Cu(CN)2]-。此外,当n(Cu)/n(Zn)超过5.0时,没有出现任何Zn-CN络合物,Zn2+形成氢氧化物沉淀或氢氧化络合物。值得注意的是,铜浓度高于 0.088 mol/L(n(总氰化合物)/n(Cu)<2.0)时,[Cu(CN)3]2-和[Cu(CN)2]-的减少伴随少量CuCN的析出。综上可以得出,与Zn-CN和[Cu(CN)4]3-络合的氰离子很容易被亚铜离子捕获而在碱性条件下形成低阶铜氰络合物。
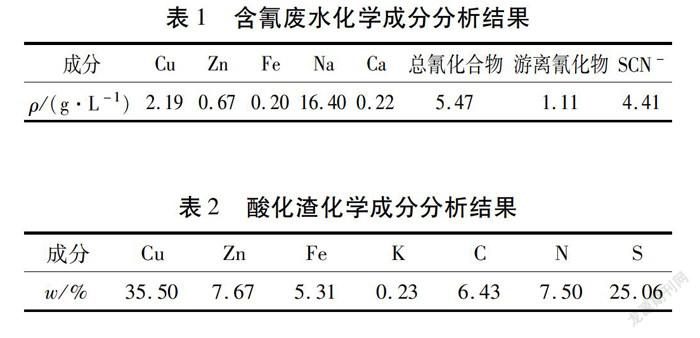
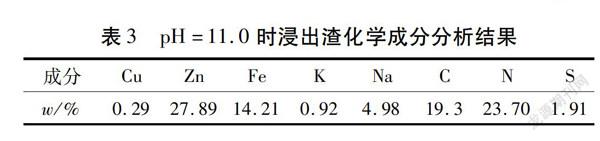
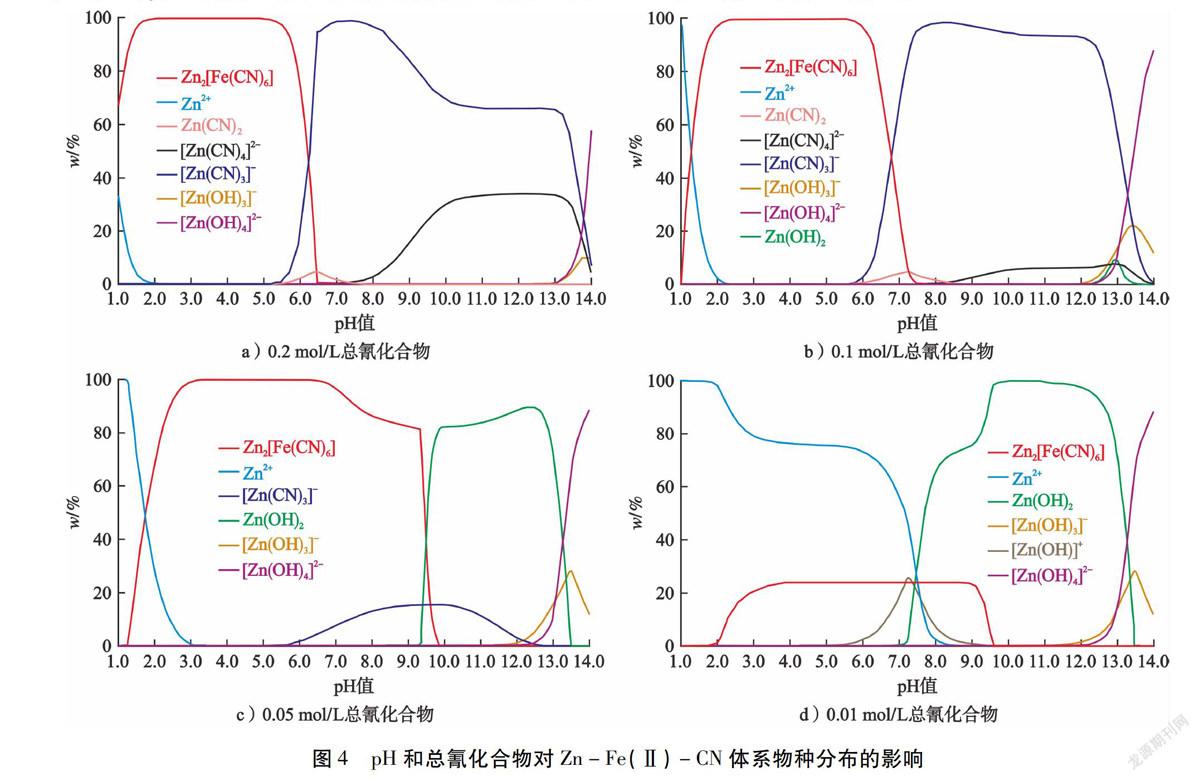
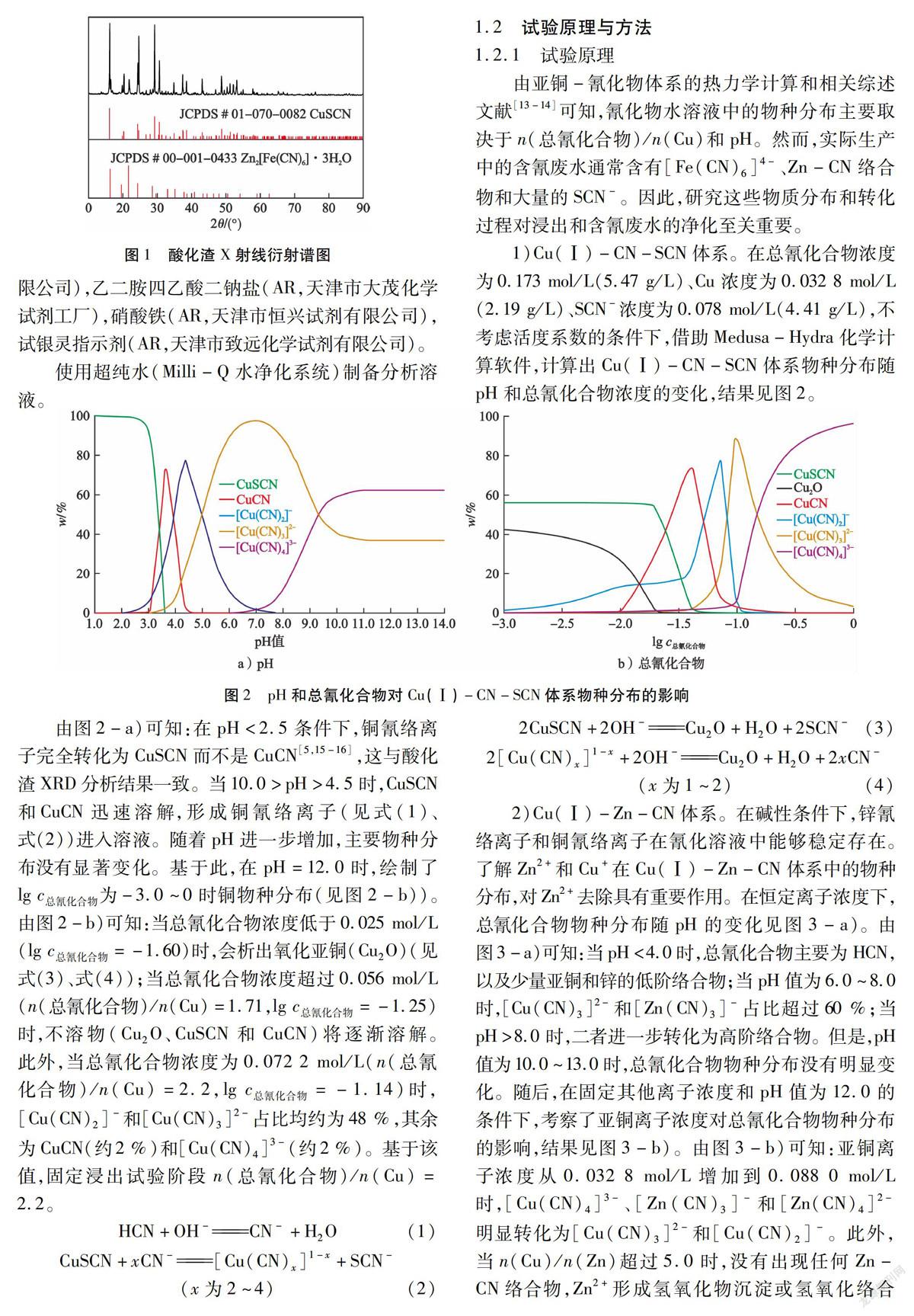
3)Zn-Fe(Ⅱ)-CN体系。酸化渣中除了CuSCN外,残余物相为Zn2[Fe(CN)6]·3H2O,这是从含氰废水中选择性去除Fe和Zn的关键物质。因此,建立了Zn-Fe(Ⅱ)-CN体系主要物种分布随pH和总氰化合物的变化规律(见图4)。由图4-a)可知:pH值为1.0~6.2时,Zn2[Fe(CN)6]主要区域的形成可归因于弱酸离解型(WAD)氰化络合物——锌氰络合物的解离[17]。但是,pH值超过13.0时,[Zn(CN)4]2-和[Zn(CN)3]-可能转化为氢氧化络合物。通过比较图4-a)、图4-b)和图4-c)中Zn2[Fe(CN)6]、Zn-CN和Zn(OH)2的主要区域在整个pH范围内变化趋势,总氰化合物浓度降低显著增加了Zn2[Fe(CN)6]和Zn(OH)2的稳定区域。因此,在相对较低的总氰化合物浓度(0.01 mol/L)下(见图4-d)),所有与Fe2+络合的氰化物与Zn2+结合形成Zn2[Fe(CN)6],而残留的Zn2+在酸性条件(pH<5.6)下主要以Zn2+形式存在;相反,在pH值为8.16~13.30时,Zn2+以Zn(OH)2沉淀形式析出。
根据以上计算可得,CuSCN在碱性溶液中很容易被游离氰化物络合溶解。此外,游离氰化物与亚铜的亲和力强于碱性介质中的Zn2+,从而阻碍了Zn-CN络合物的形成,溶液中的Zn2+以Zn(OH)2或亚铁氰化锌复合沉淀除去。因此,利用含氰废水从酸化渣中选择性浸出铜并同时净化溶液的方法理论上是可行的。
1.2.2 试验方法
浸出试验前,将含氰废水过滤以除去悬浮固体颗粒;酸化渣烘干,磨碎(-0.074 mm大于98 %)。取1 L滤液加入烧杯中并加热至所需温度,调节pH,采用机械搅拌器搅拌,之后添加酸化渣(10 g),浸出,每隔一段时间取样分析。浸出结束后,立即过滤,并将残余物用水洗涤2次,置于烘箱中105 ℃干燥。分析浸出渣和滤液中的铜,计算铜浸出率(φ),计算公式为:
φ=mp-mrmp×100 %(5)
式中:mp和mr分别为酸化渣和浸出渣中铜质量(g)。
2 结果与讨论
2.1 浸出温度
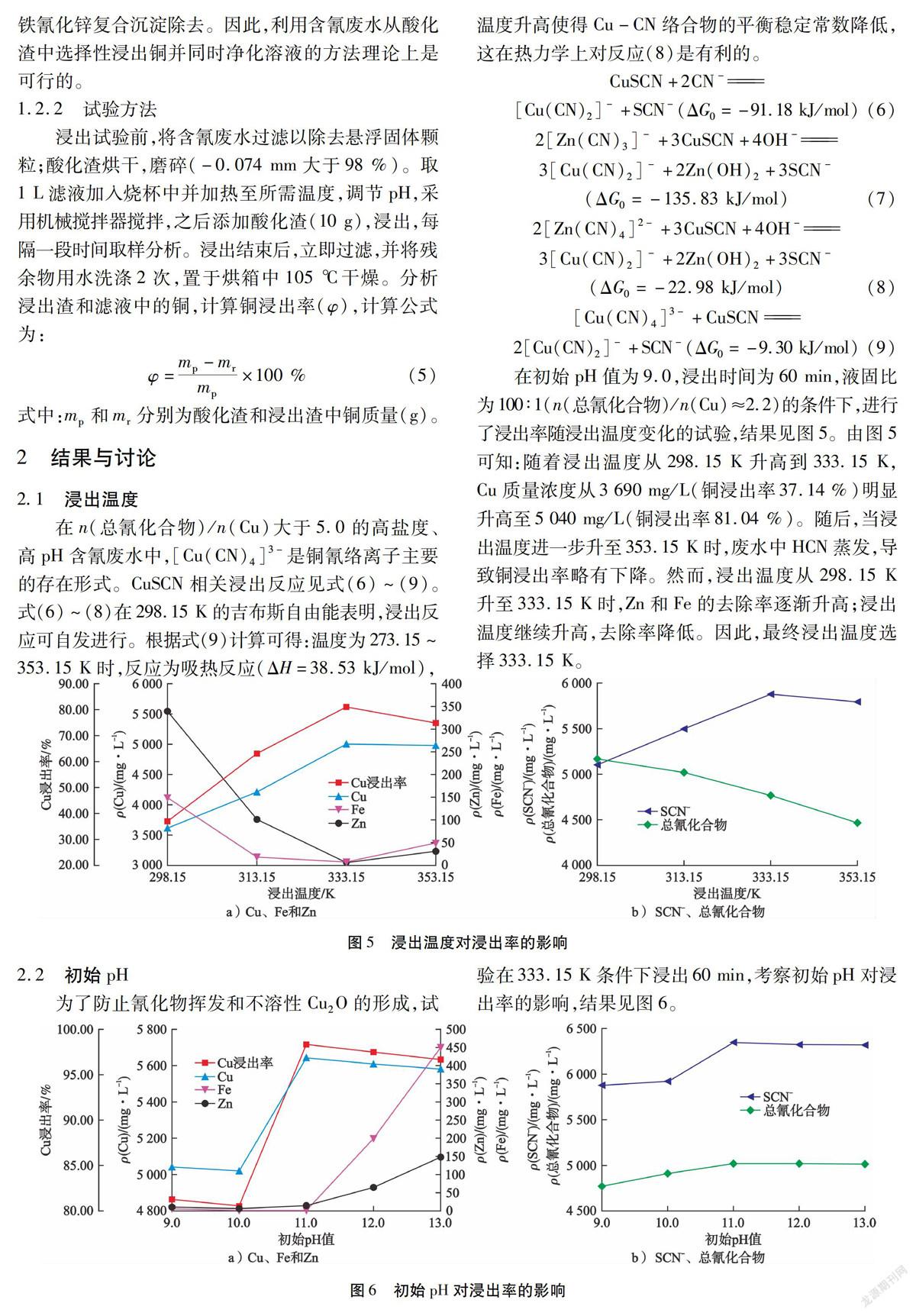
在n(总氰化合物)/n(Cu)大于5.0的高盐度、高pH含氰废水中,[Cu(CN)4]3-是铜氰络离子主要的存在形式。CuSCN相关浸出反应见式(6)~(9)。式(6)~(8)在298.15 K的吉布斯自由能表明,浸出反应可自发进行。根据式(9)计算可得:温度为273.15~353.15 K时,反应为吸热反应(ΔH=38.53 kJ/mol),温度升高使得Cu-CN络合物的平衡稳定常数降低,这在热力学上对反应(8)是有利的。
在初始pH值为9.0,浸出时间为60 min,液固比为100∶1(n(总氰化合物)/n(Cu)≈2.2)的条件下,进行了浸出率随浸出温度变化的试验,结果见图5。由图5可知:随着浸出温度从298.15 K升高到333.15 K,Cu质量浓度从3 690 mg/L(铜浸出率37.14 %)明显升高至5 040 mg/L(铜浸出率81.04 %)。随后,当浸出温度进一步升至353.15 K时,废水中HCN蒸发,导致铜浸出率略有下降。然而,浸出温度从298.15 K升至333.15 K时,Zn和Fe的去除率逐渐升高;浸出温度继续升高,去除率降低。因此,最终浸出温度选择333.15 K。
2.2 初始pH
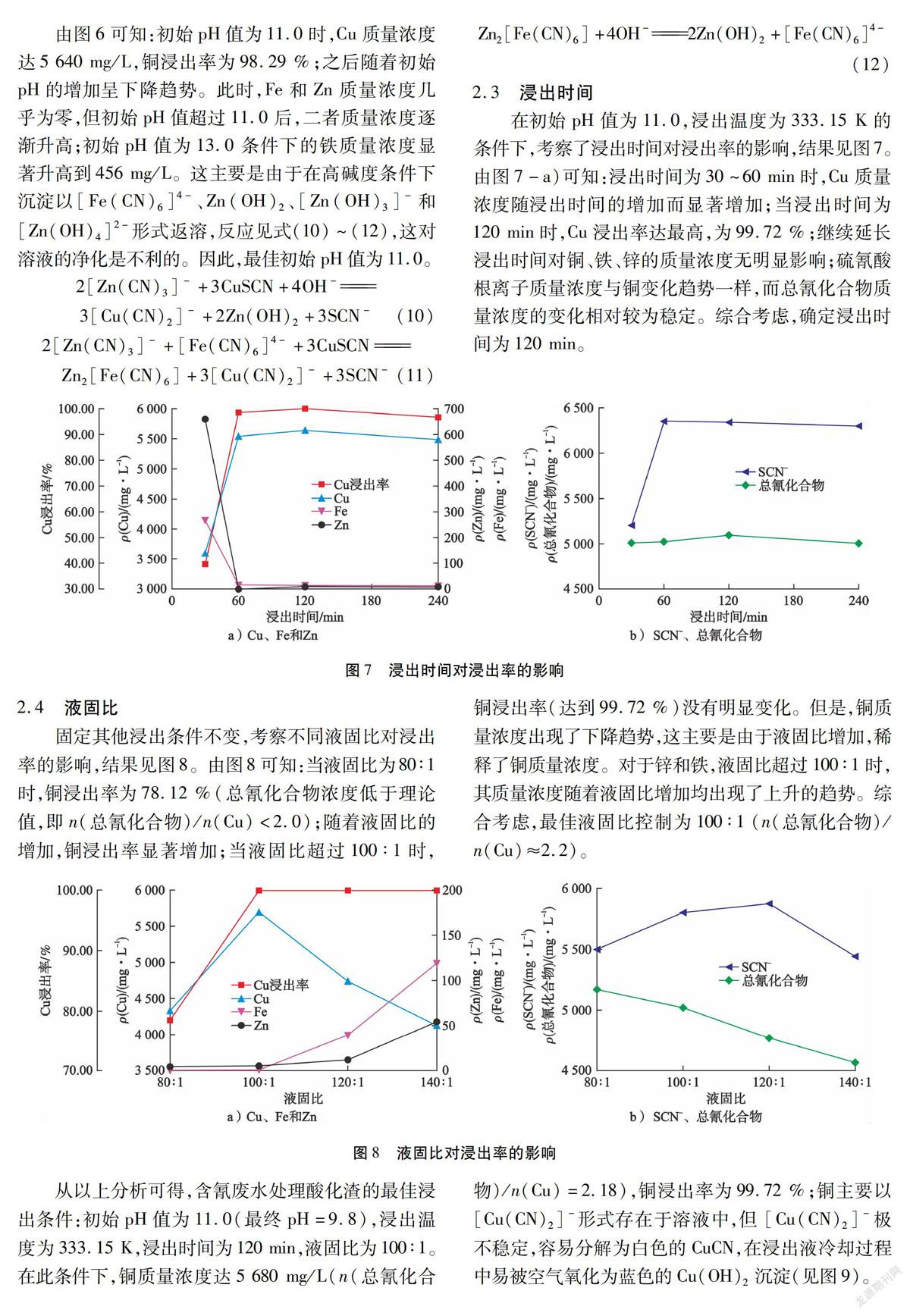
為了防止氰化物挥发和不溶性Cu2O的形成,试验在333.15 K条件下浸出60 min,考察初始pH对浸出率的影响,结果见图6。
由图6可知:初始pH值为11.0时,Cu质量浓度达5 640 mg/L,铜浸出率为98.29 %;之后随着初始pH的增加呈下降趋势。此时,Fe和Zn质量浓度几乎为零,但初始pH值超过11.0后,二者质量浓度逐渐升高;初始pH值为13.0条件下的铁质量浓度显著升高到456 mg/L。这主要是由于在高碱度条件下沉淀以[Fe(CN)6]4-、Zn(OH)2、[Zn(OH)3]-和 [Zn(OH)4]2-形式返溶,反应见式(10)~(12),这对溶液的净化是不利的。因此,最佳初始pH值为11.0。
2.3 浸出時间
在初始pH值为11.0,浸出温度为333.15 K的条件下,考察了浸出时间对浸出率的影响,结果见图7。由图7-a)可知:浸出时间为30~60 min时,Cu质量浓度随浸出时间的增加而显著增加;当浸出时间为120 min时,Cu浸出率达最高,为99.72 %;继续延长浸出时间对铜、铁、锌的质量浓度无明显影响;硫氰酸根离子质量浓度与铜变化趋势一样,而总氰化合物质量浓度的变化相对较为稳定。综合考虑,确定浸出时间为120 min。
2.4 液固比
固定其他浸出条件不变,考察不同液固比对浸出率的影响,结果见图8。由图8可知:当液固比为80∶1时,铜浸出率为78.12 %(总氰化合物浓度低于理论值,即n(总氰化合物)/n(Cu)<2.0);随着液固比的增加,铜浸出率显著增加;当液固比超过100∶1时,铜浸出率(达到99.72 %)没有明显变化。但是,铜质量浓度出现了下降趋势,这主要是由于液固比增加,稀释了铜质量浓度。对于锌和铁,液固比超过100∶1时,其质量浓度随着液固比增加均出现了上升的趋势。综合考虑,最佳液固比控制为100∶1(n(总氰化合物)/n(Cu)≈2.2)。
从以上分析可得,含氰废水处理酸化渣的最佳浸出条件:初始pH值为11.0(最终pH=9.8),浸出温度为333.15 K,浸出时间为120 min,液固比为100∶1。在此条件下,铜质量浓度达5 680 mg/L(n(总氰化合物)/n(Cu)=2.18),铜浸出率为99.72 %;铜主要以[Cu(CN)2]-形式存在于溶液中,但 [Cu(CN)2]-极不稳定,容易分解为白色的CuCN,在浸出液冷却过程中易被空气氧化为蓝色的Cu(OH)2沉淀(见图9)。
2.5 浸出渣XRD和SEM分析
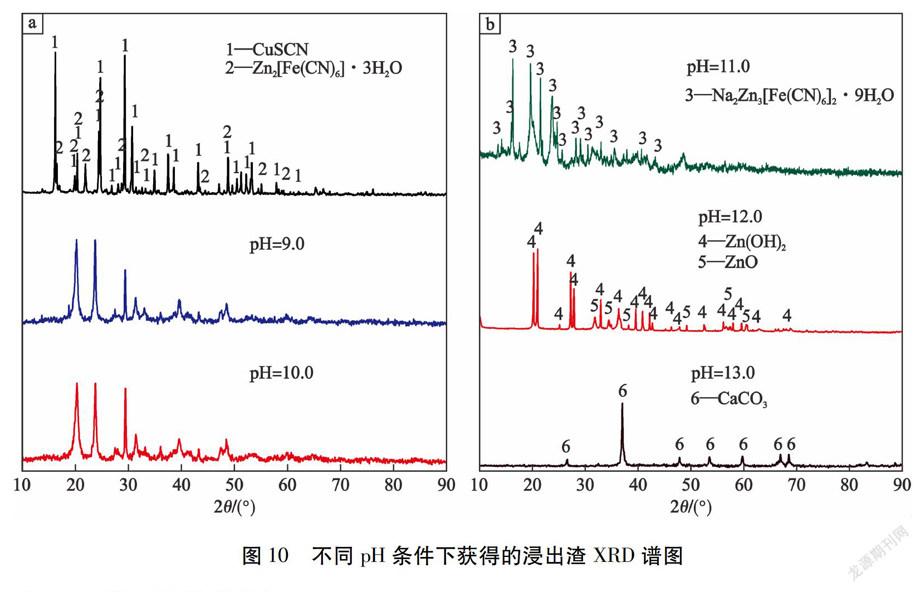
不同pH条件下浸出渣XRD谱图见图10。由图10可知:与酸化渣相比,pH值为11.0条件下获得的浸出渣(见表3)中,主要为Na2Zn3[Fe(CN)6]2·9H2O(JCPDS#00-036-0539),并没有检测到CuSCN或Zn2[Fe(CN)6]的衍射峰。当pH值升高到12.0时,Na2Zn3[Fe(CN)6]2·9H2O转化为Zn(OH)2 (JCPDS#01-089-0138)和ZnO(JCPDS#01-079-2205);主要原因是Zn-CN络合物解离后得到的Zn2+首先与溶液中的[Fe(CN)6]4-和Na+结合形成Na2Zn3[Fe(CN)6]2·9H2O沉淀,然后随pH升高逐渐溶解
于溶液中形成Zn(OH)2沉淀,最终Zn(OH)2与OH-络合,生成可溶氢氧化络合物。浸出前后样品形态和微观结构见图11。酸化渣中的颗粒由长方体微粒组成(见图11-a));而在pH值11.0条件下得到的浸出渣中分布着片状颗粒团聚形成的花簇状结构(见图11-b)),表明浸出前后物相结构发生了明显转变。
3 结 论
根据热力学计算和浸出试验,实现了含铜氰化废水和酸化渣的综合利用。
1)在游离氰化物存在下,CuSCN易被络合溶解;当n(总氰化合物)/n(Cu)=1.71时,其完全转化为Cu-CN络合物;随着溶液中铜离子增加至n(Cu)/n(Zn)=5.0,氰化络合物中的锌离子被释放,与溶液中的铁氰络离子和氢氧根离子形成铁氰复合沉淀或氢氧化锌沉淀。
2)在浸出温度为333.15 K,初始pH值为11.0,浸出时间为120 min,液固比为100∶1的条件下,铜浸出率达到99.72 %;同时与含氰废水相比,浸出液得到了净化,主要是由于Zn-CN络合物中的Zn2+和废水中的[Fe(CN)6]4-以Na2Zn3[Fe(CN)6]2·9H2O沉淀形式被去除。
[参考文献]
[1] HABASHI F.A short history of hydrometallurgy[J].Hydrometallurgy,2005,79(1/2):15-22.
[2] WALTON R.Chapter 31-Zinc cementation[M]∥ADAMS M D.Gold ore processing (Second Edition):project development and operations.Amsterdam:Elsevier,2016:553-560.
[3] ZHANG X M,SENANAYAKE G.A review of ammoniacal thiosulfate leaching of gold:an update useful for further research in non-cyanide gold lixiviants[J].Mineral Processing and Extractive Metallurgy Review,2016,37(6):385-411.
[4] BREUER P L,DAI X,JEFFREY M I.Leaching of gold and copper minerals in cyanide deficient copper solutions[J].Hydrometallurgy,2005,78(3/4):156-165.
[5] DAI X W,SIMONS A,BREUER P.A review of copper cyanide recovery technologies for the cyanidation of copper containing gold ores[J].Minerals Engineering,2012,25(1):1-13.
[6] MEDINA D,ANDERSON C.A review of the recovery of gold and silver from copper ores and concentrates[C]∥SME.Proceedings of SEM annual meeting 2019.Englewood:SME,2019.
[7] GHASEMI S,MOHAMMADNEJAD S,KHALESI M R.A DFT study on the speciation of aqueous gold and copper cyanide complexes[J].Computational and Theoretical Chemistry,2018,1 124:23-31.
[8] REES K L,VAN DEVENTER J S J.The role of metal-cyanide species in leaching gold from a copper concentrate[J].Minerals Engineering,1999,12(8):877-892.
[9] 李超,童明全,潘蓉,等.含氰废水处理方法综述[J].山西化工,2017,37(6):149-151,158.
[10] 孙彦文,林明国,孙留根,等.含氰废水综合处理技术试验研究[J].矿冶,2016,25(5):67-71,76.
[11] BRAR A S,SANDHU H S,SANDHU S S.Mssbauer studies of thermal decomposition of metal(Ⅱ)hexacyanoferrates(Ⅱ)[J].Journal of Thermal Analysis,1983,26(1):7-15.
[12] MIKHAIL S A,TURCOTTE A M,MCNAMARA V M.A thermoana-lytical study of the decomposition of a cyanide precipitate in inert and reducing atmospheres[J].Thermochimica Acta,1991,178:213-221.
[13] KYLE J H,HEFTER G.A critical review of the thermodynamics of hydrogen cyanide and copper(Ⅰ)-cyanide complexes in aqueous solution[J].Hydrometallurgy,2015,154:78-87.
[14] LU J M,DREISINGER D B,COOPER W C.Thermodynamics of the aqueous copper-cyanide system[J].Hydrometallurgy,2002,66(1/2/3):23-36.
[15] GNEN N,KABASAKAL O S,ZDIL G.Recovery of cyanide in gold leach waste solution by volatilization and absorption[J].Journal of Hazardous Materials,2004,113(1/2/3):231-236.
[16] SCERESINI B,BREUER P.Chapter 43 - Gold-Copper ores[M]∥ADAMS M D.Gold ore processing(Second Edition):project deve-lopment and operations.Amsterdam:Elsevier,2016:771-801.
[17] FLEMING C A.Cyanide recovery[J].Developments in Mineral Processing,2005,15:703-727.
Selective leaching of copper from acidified residue by cyanide-containing wastewater
Zhang Jianyuan1,Li Mingxin2,Wang Hongkai1,Sun Hongzhi1,Gu Weipeng1
(1.Liaoning Xindu Gold Co.,Ltd.; 2.School of Metallurgy,Northeastern University)
Abstract:The copper recovery from acidified residue in gold smelters is studied,and the use of cyanide-containing wastewater for the copper recovery from acidified residue is proposed.The leaching conditions(leaching temperature,inital pH and leaching time)are controlled to suppress zinc and iron leaching and meet the goal of solution purification,which is convenient for subsequent copper enrichment and recovery.The study combined thermodynamic calculations and leaching experiments,and looked into the reaction pathways of copper leaching from acidified residue and zinc and iron purification.Thermodynamic calculations indicated that under alkaline conditions,when n(total cyanide)/n(Cu)is 1.71,cuprous thiocyanate was completely transformed into Cu-CN species in the presence of free cyanide ion;when n(total cyanide)/n(Zn)is 5.0,all cyanide complexes with zinc was stripped by copper,forming Cu-CN complex.When the leaching temperature is 333.15 K,initial pH is 11.0,leaching time is 120 min and liquid-solid ratio is 100∶1,the leaching rate of copper can be up to 99.72 %,and the mass concentration of zinc and iron,both of which precipitate in the form of Na2Zn3[Fe(CN)6]2 into the leaching residue,is nearly zero in the leaching solution.
Keywords:cyanide-containing wastewater;acidified residue;copper;alkaline leaching;purification
收稿日期:2021-03-05; 修回日期:2021-04-11
作者簡介:张建元(1968—),男,陕西横山人,高级工程师,从事黄金冶炼管理工作;辽宁省朝阳市双塔区中山大街北段九号,辽宁新都黄金有限责任公司,122000;E-mail:xdhjshz@163.com
通信作者,E-mail:whk681207@163.com,13842186516
