A型塞内卡病毒研究进展
2021-09-10廖迎新范锦戴张梦茹刘晨晨章洋溢孙显月陈金顶赵明秋
廖迎新,范锦戴,张梦茹,刘晨晨,章洋溢,孙显月,陈金顶,赵明秋*
(1.华南农业大学 兽医学院,广东 广州 510642;2.广东茂名农林科技职业学院,广东 茂名 525000)
A型塞内卡病毒(Senecavirus A,SVA),也称为塞内加谷病毒(Seneca valley virus,SVV),是单股、正链RNA 病毒,属于小RNA 病毒科塞内卡病毒属成员。该病毒感染可引发母猪水泡性相关疾病,并可导致新生仔猪急性死亡,影响养猪业的发展。SVV-001是SVA的原形毒株,该毒株分离于2002年,当时被认为是PER.C6细胞中的污染物[1]。SVV-001对人体无毒,且具有溶瘤特性,因此该病毒被用于尝试治疗人的神经内分泌肿瘤[2]。SVV-001虽然能感染猪,但不能使猪致病[3]。2007年美国某屠宰场报道加拿大猪群出现水泡性疾病症状,经检测发现与SVA感染有关[4]。近年来,美国、加拿大、哥伦比亚、巴西、泰国和越南等国家均报道猪群感染SVA疫情[5-10]。2015年3月,广东省某猪场发生国内首例SVA感染疫情[11]。随后,SVA疫情在我国其他省份陆续出现[12]。SVA感染严重影响母猪的生产效率及新生仔猪存活率,是养猪业的潜在威胁。为了给SVA防控提供有效信息,现对SVA病原学、流行情况、致病性、致病机理研究、疫苗研发、诊断及防控等方面进行综述。
1 SVA病原学简介
SVA是单股、正链RNA病毒,无囊膜,病毒粒子呈典型的二十面体对称结构,直径25~30 nm[1]。其基因组全长约7.3 kb,由5′-UTR、3′-UTR和1个大的ORF组成(图1)。5′-UTR含有内部核糖体进入位点(IRES),40S核糖体亚基可与5′-UTR结合从而启动多聚蛋白前体翻译,3′-UTR含有poly(A)。ORF编码由P1、P2和P3组成的大蛋白前体。该蛋白前体可被病毒和细胞蛋白酶切割、加工并产生4种结构蛋白(VP1、VP2、VP3和VP4)和8种非结构蛋白(Lpro、2A、2B、2C、3A、3B、3C和3D)[1,13]。
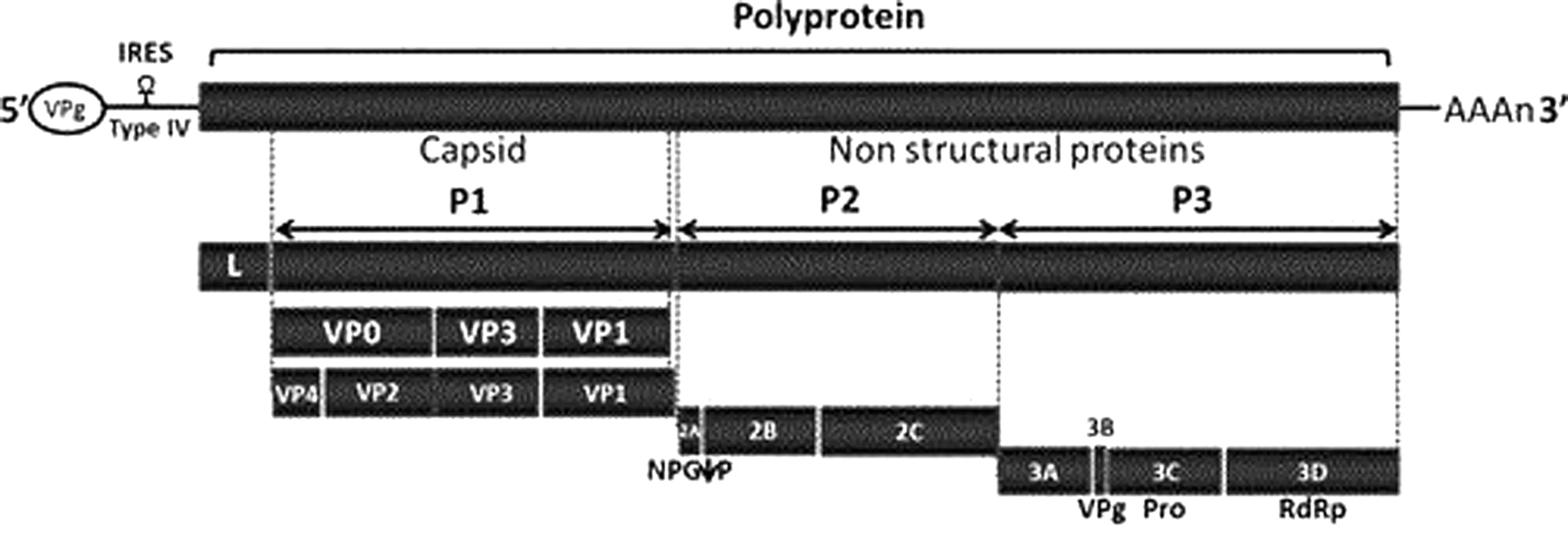
图1 SVA基因组结构[13]
2 SVA国内流行情况
2015年3月,广东省某猪场的断奶母猪出现鼻镜水泡、跛行等疑似水泡疾病症状,经检测发现口蹄疫病毒、猪水泡病病毒和水泡性口炎病毒等水泡相关病原均为阴性,而SVA为阳性,同时成功分离到SVA毒株CH-01-2015[11]。自2016年后,我国华南、华中、西南和东北等地区均发生SVA疫情[12]。根据基因组遗传进化分析,国内SVA毒株至少可分为5种类型[14],意味着SVA毒株的复杂多样。也有报道称国内SVA分离毒株可分为USA-like和Canada-like毒株;而2017年以来,国内流行毒株主要是USA-like毒株[15]。我国是养猪大国,养殖密度较大,区域间生猪调运频繁,为SVA的存在和传播创造了有利条件。SVA是RNA病毒,该病毒在猪群中的持续存在和传播加快了SVA基因组的变异和重组,给SVA的防控增添更大的难度[16-18]。
3 SVA致病性
研究发现,SVA感染母猪或育肥猪后,猪只体温轻微升高,感染后3~5 d嘴唇、鼻子、舌头和冠状带等部位形成水泡病变,病猪可出现嗜睡、厌食和跛行等临床症状。SVA感染后出现短期的病毒血症,1~10 d在血清中能检测到病毒RNA。感染后21 d,仍然可从口鼻分泌物和粪便中分离出感染性病毒。感染后28 d,在口鼻分泌物和粪便中仍然可检测到病毒RNA(图2)[19-21]。JOSHI等[20]发现,育肥猪在感染后3~7 d,扁桃体、脾脏和淋巴结可观察到淋巴样增生。研究发现,不同毒株的致病性存在明显差异,其毒力从低致病性到高致病性不等[15,22]。

图2 SVA感染动力学[21]
CHEN等[22]评估国内2株SVA毒株(GD-S5/2018和GD04/2017)致病性,发现这2株SVA毒株均可感染猪,但毒力差异较大,GD-S5/2018感染导致猪只典型的水泡相关症状,而GD04/2017感染的猪只除了精神状态差外,未出现任何典型临床症状。除了导致母猪和育肥猪水泡性症状外,仔猪急性死亡也是SVA感染的主要特征。新生仔猪死亡率高达30%~70%,有时伴有昏睡、腹泻或神经症状[6]。
4 SVA致病机理
病毒感染实际上是病毒与宿主之间相互博弈的过程。病毒入侵宿主后,机体会启动一系列免疫应答,试图达到清除病毒的目的。而病毒为了生存,则会采取一系列策略抵抗宿主免疫反应,以实现免疫逃逸和自身复制。天然免疫反应作为机体免疫应答的重要组成部分,在病毒与宿主的互作中发挥着重要作用。其中,Ⅰ型干扰素信号通路作为天然免疫的关键组成部分,与SVA感染免疫密切相关。LI等[23]发现SVA感染可激活Ⅰ型干扰素信号通路,而RIG-Ⅰ功能缺失则抑制SVA感染过程中IFN-β和干扰素刺激因子MxA、ISG15和GBP1等的表达,进而促进SVA在PK-15细胞复制,表明RIG-Ⅰ对SVA感染过程Ⅰ型干扰素信号通路的激活是必需的。WEN等[24]发现SVA感染可以诱导RIG-Ⅰ降解,进一步发现SVA 2C和3C蛋白通过Caspase信号途径降解RIG-Ⅰ,从而抑制Ⅰ型干扰素产生;而RIG-Ⅰ过表达则显著抑制SVA复制。QIAN等[25]研究发现SVA通过3C靶向切割接头蛋白MAVS、TRIF和TANK,从而抑制宿主Ⅰ型干扰素产生。此外,3C还可切割宿主poly(A)结合蛋白(PABPC1),下调宿主蛋白合成效率,从而促进SVA复制[26]。XUE等[27]发现SVA感染降低PK-15细胞IRF3和IRF7蛋白表达,进一步研究发现SVA 3C与IRF3和IRF7互作,并降低IRF3和IRF7蛋白表达水平和磷酸化水平,且IRF3和IRF7的降解抑制IFN-β、 IFN-α1、IFN-α4和ISG54转录,表明SVA 3C通过降解 IRF3和IRF7抑制IRF3和IRF7介导的先天免疫应答。同时,XUE等[28]还发现,SVA复制过程与泛素-蛋白酶体系统密切相关,3C还具有去泛素化功能,可抑制RIG-Ⅰ、TBK1和TRAF3泛素化,进而抑制IFN-β和ISG54表达,从而负向调控Ⅰ型干扰素信号通路。闫鸣昊等[29-30]发现敲除TPL2(MAP3K8/COT)基因促进SVA复制,进一步发现TPL2基因调控SVA复制的过程可能与IFN-α、IFN-β、IFN-γ、ISG15、ISG54和ISG56表达抑制有关,表明TPL2在SVA感染过程中发挥抗病毒作用。WANG等[31]通过转录组学分析也发现Ⅰ型干扰素在机体抵抗SVA感染的免疫应答中发挥关键作用。唐晓钰等[32]利用高通量测序分析了SVA感染的lncRNA差异表达谱,发现lncRNA靶基因主要富集于p53信号通路、RIG-Ⅰ样受体信号通路、MAPK信号通路和IgA生成的肠道免疫网络通路等。ZHU等[33]利用组学方法分析SVA感染细胞中lncRNA和mRNA差异表达谱,发现受调控的基因主要涉及宿主免疫和炎症反应相关信号通路,进一步发现lnc-MSTRG.18940.1沉默抑制SVA复制和TNF-α、IL-1、IL-6和IL-8等炎性因子的产生。
已有研究表明,细胞凋亡和自噬等生物过程与SVA感染密切相关。FERNANDES等[34]研究发现SVA感染可诱导宿主细胞凋亡,同时发现3C蛋白水解活性对SVA诱导凋亡过程是必需的。王咏等[35-36]研究发现,SVA结构蛋白VP1可与宿主促凋亡蛋白BAD在线粒体上发生互作,促进凋亡蛋白Bax和Caspase 3的表达及活化,从而激活线粒体凋亡通路,导致细胞凋亡发生。LIU等[37]也证明SVA 2C和3C可通过线粒体介导的内源性途径诱导细胞凋亡。此外,HOU等[38]研究发现,SVA可通过PERK和ATF6 UPR途径诱导细胞自噬,进而促进病毒复制。上述研究结果表明,细胞凋亡和细胞自噬在SVA感染免疫中发挥着重要作用。
此外,在SVA的传播机制方面,XU等[39]发现外泌体介导SVA在细胞间的传播,且SVA特异中和抗体不能阻断外泌体介导的SVA细胞间传播,揭示外泌体在SVA在传播中的重要性。
5 SVA的诊断方法
SVA是国内猪群中新流行的病原,其感染引起的临床症状与口蹄疫、猪传染性水泡病、水泡性口炎和猪水泡性皮疹等水泡性相关疾病相似,在临床上很难对这些疾病进行区别诊断,需借助实验室诊断技术对其进行确诊。目前已有多篇文章报道SVA的分子诊断方法,如RT-ddPCR检测方法[40]、基于探针的荧光定量RT-PCR检测方法[41-43]、SYBR Green荧光定量RT-PCR检测方法[44]、RT-RPA快速检测方法[45]和RT-LAMP检测方法[46-47]等。其中,RT-RPA和RT-LAMP属于等温扩增技术,不需要复杂的精密仪器,对于设施配置较为简单的实验室而言,等温扩增检测技术可作为首选。另外,SVA的多种血清学诊断方法也已被建立,如间接ELISA[48-49]、竞争ELISA[50-51]、间接免疫荧光技术[52]和病毒中和试验[50,53]等。诸多核酸检测方法和血清学检测方法的建立,为SVA感染的诊断、疾病监控和流行病学调查等提供了强有力的工具。
6 SVA疫苗的研究进展
目前,市场上尚无针对SVA的商业化疫苗,关于SVA疫苗研发的报道仍然不多。CHEN等[54]利用反向遗传操作技术制备SVA标记毒株,初步研究该毒株的生物学特性,为SVA 疫苗的研发提供了有力的工具。YANG等[55]利用SVA CH-FJ-2017毒株制备SVA候选灭活疫苗,并评估该候选灭活疫苗的免疫效果,发现免疫猪只产生较高水平的中和抗体,同时可抵抗SVA同源毒株攻击,表明该候选灭活疫苗具有潜在的应用前景。SHARMA等[56]利用反向遗传操作技术制备SVA的弱毒株(rSVAm SacⅡ),通过动物试验证实该毒株已被致弱,且免疫该弱毒株的猪只可抵抗不同SVA毒株攻击,表明该弱毒株是有潜力的候选疫苗毒株。
核酸疫苗和亚单位疫苗因其制备简单,安全性高,可有效诱导机体产生免疫应答,也是疫苗研发中常用的策略。魏婷等[57]将SVA衣壳前体蛋白P12A基因和3C蛋白酶基因进行融合,获得融合基因P12A-3C并制备真核表达质粒pCD-P12A-3C,进一步研究发现免疫该质粒的小鼠可产生较高水平抗体,初步证明该候选核酸疫苗的免疫效力。莫亚霞等[58]利用大肠杆菌表达系统表达SVA衣壳蛋白VP0、VP1和VP3,发现这三者均能与猪的SVA阳性血清发生特异反应,且可组装成五聚体,具有开发为SVA病毒样颗粒疫苗的潜在价值。
国内SVA毒株的基因组变异和重组现象频繁出现,流行毒株复杂多样,给疫苗研发增加不少压力。如何研发出可抵抗不同类型毒株攻击的SVA疫苗是疫苗研发的重点。新型表位疫苗由于其安全、有效和研发周期短等优点,逐渐受到科研工作者的青睐。FAN等[59]制备了针对SVA衣壳蛋白VP1和VP2的单克隆抗体,并利用这些抗体鉴定了VP1和VP2的多个线性B细胞表位,这些表位的鉴定将有利于揭示病毒致病机制,同时也有利于疫苗研发和检测方法的建立。除了通过试验筛选,还可考虑利用基因组序列分析与预测等途径,获取SVA毒株保守的抗原表位,利用基因工程技术,制备新型的SVA表位疫苗。
7 SVA的防控
目前市场上尚无针对SVA的疫苗和抗病毒药物,SVA的防控仍然存在一定的困难。根据兽医科研工作者的建议[12,60],结合养猪生产实际,需采取综合措施对SVA感染进行防控。对规模化猪场而言,良好的生物安全体系可将大部分病原微生物拦截在大门之外,同时也是SVA防控的关键。建立生物安全体系的配套设施、猪场引种或使用相关生物制品时进行严格检疫、实施严格的消毒防疫制度、猪群执行全进全出、建立科学饲养管理和树立严格的防疫意识等,都是生物安全体系建设的重要组成部分。针对发病猪只的治疗,尚无特效药物,需将发病猪只进行隔离饲养,然后采取对症治疗。此外,科研工作者可考虑加快SVA 疫苗研发工作。目前猪群中接种的疫苗数量较多,再增加SVA的疫苗接种是否会加剧对猪群的应激作用,从而造成不必要的负面影响,仍未可知。若SVA疫苗上市,建议对SVA经常流行的区域进行免疫接种,而不是盲目接种,以免增加猪群应激。
8 小结
SVA感染可引起母猪或育肥猪出现水泡性临床症状,并可引起新生仔猪急性死亡,是养猪业的一大隐患。该病自2015年传入我国后,已在我国多个省份暴发,需引起养猪从业人员的高度重视。SVA快速诊断方法的建立及SVA疫苗研发,将有利于SVA防控。SVA感染免疫机理的研究,将为SVA的防控提供理论指导和技术支撑。此外,传染病的防控还需从加强生物安全体系建设的角度出发,将病原拦截在大门外。若是能从大区域、地区的角度去建设生物安全体系,而不仅仅是单个养殖场自身的生物安全体系建设,那么,传染性疾病的防控将上升一个台阶。
