克雷伯氏菌产β-半乳糖苷酶的异源表达及低聚半乳糖合成工艺优化
2021-09-09李宗显许丽亚朱运平1郦金龙2李秀婷
李宗显,许丽亚,朱运平1,*,郦金龙2,,李秀婷
(1 北京工商大学 北京市食品添加剂工程技术研究中心 北京 100048 2 北京工商大学 食品质量与安全北京实验室 北京 100048 3 北京工商大学食品与健康学院 北京 100048)
低聚半乳糖(GOS)是一种功能性低聚糖,具有提高肠道对钙等矿物质的吸收,改善脂质代谢,防止便秘等益生功能[1-3]。因低聚半乳糖在天然的食物中含量较低,益生效果不明显,故往往需要额外补充。酶法合成低聚半乳糖因反应条件温和,产物特异性好而备受关注,其中β-半乳糖苷酶为酶法合成过程中的关键酶[4-6]。
β-半乳糖苷酶,简称乳糖酶,兼具水解及转糖苷活性,于自然界中广泛存在[7-10],其在乳糖降解、GOS 酶法合成及生物传感器等领域发挥重要的作用。目前β-半乳糖苷酶来源主要有克鲁维酵母菌、乳酸菌、环状芽孢杆菌及米曲霉等[10-13]。依据氨基酸序列相似性,β-半乳糖苷酶分别属于糖苷水解酶家族GH-1、GH-2、GH-35、GH-42、GH-59 和GH-147。一般来说GH-35 来源最丰富;GH-2 以嗜冷,嗜温菌株为主,水解和转糖苷作用均较好;GH-42 存在于嗜热微生物中,对半乳糖相关多糖的利用效果良好[11,14]。
虽然研究者对β-半乳糖苷酶开展了大量研究,但是仍存在着表达力差,转糖苷活力较低,不易获取等问题[15-16]。本研究团队前期筛选获得一株产β-半乳糖苷酶的克雷伯氏菌,该酶具有较好的转糖苷活性。本文首次对克雷伯氏菌来源的β-半乳糖苷酶基因进行重组表达,成功得到具有优良转糖苷活性的β-半乳糖苷酶,并探究其酶法转化乳糖合成GOS 的工艺条件,为丰富β-半乳糖苷酶资源及低聚半乳糖制备提供理论依据。
1 材料与方法
1.1 材料与试剂
β-半乳糖苷酶基因(lacZ)由课题组前期从多地土样中筛选出的克雷伯氏菌B5582Y 中分离得到。
限制性内切酶 NcoI,XhoI,美国BioLabs 公司;质粒pET28a(+),T4DNA 连接酶,La Tap 扩增酶,2×GC Buffer I,日本TAKARA 公司;异丙基硫代半乳糖苷 (Isopropyl β-D-thiogalactoside,IPTG),5-溴-4-氯-3-吲哚-β-D-半乳糖苷 (5-Bromo-4-chloro-3-indolyl β-D-galactoside,Xgal),氨苄,卡那霉素,北京Biotopped 公司;细菌DNA 提取试剂盒 (100),胶回收试剂盒(200),美国OMEGA 公司;琼脂糖,西班牙Biowest 公司;BL21 (DE3)感受态细胞,北京TIANGEN 公司;PCR 扩增引物,由北京奥科鼎盛合成;色谱乙腈,美国Fisher Scientific;其它化学试剂都是分析纯级,试验中所用的水均为Milli-Q 超纯水。
1.2 设备与仪器
水平摇床,江苏其林贝尔仪器制造有限公司;电热鼓风干燥箱、压力蒸汽灭菌器,上海博迅实业有限公司;生物安全柜,青岛海尔特种电器有限公司;高速离心机,英国BECKMAN COULTER;超声波细胞破碎仪,南京南京先欧仪器制造有限公司;PCR 仪,德国Biometra 公司;凝胶成像仪,上海Tanon 公司;Multitemp III 恒温循环水浴器、琼脂糖凝胶电泳仪,美国GE 公司;Agilent 1260 高效液相色谱-示差折光检测器,美国Agilent 公司。
1.3 试验方法
1.3.1 大肠杆菌重组表达系统的构建 设计引物gal F2(CATGCCATGGAGCTCACTCATTAGGCACCCCAGGC)和gal R2(CCGCTCGAGTTACGCGAAATACGGGCAGACATGG)对lacZ 基因进行PCR扩增,引入酶切位点NcoI 和XhoI。PCR 反应体系:2×GC buffer I 25 μL,dNTP (2.5 mmol/L)8 μL,gal F2 (20 μmol/L)1 μL,gal R2 (20 μmol/L)1 μL,DNA 模板1 μL,LA-Taq 0.5 μL,用ddH2O 补至50 μL。PCR 扩增条件:94 ℃变性5 min;94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸150 s,30 个循环;72 ℃延伸10 min。
用NcoI 和XhoI 同时对表达载体pET28a 和带有酶切位点β-半乳糖苷酶基因lacZ 进行双酶切,在37 ℃反应3 h。用T4DNA 连接酶将lacZ和线性化的pET28a 以一定比例混匀,在16 ℃下连接过夜,完成重组质粒pET28a-lacZ 的构建。将上述构建的重组质粒pET28a-lacZ 转入BL21(DE3)细胞中,通过卡那霉素LB 抗性平板上筛选转化子,利用菌落PCR 进行验证,PCR 反应体系和条件参考前述。
1.3.2 重组蛋白的表达及纯化 将大肠杆菌重组菌株以1%的接种量转接至100 mL 含卡那霉素的LB 培养基中,在37 ℃下培养3~4 h (OD600nm=0.6~1.0),以0.5 mmol/L 的IPTG 诱导产酶,于20 ℃下,200 r/min 培养20 h。发酵液在4 ℃下以5 000 r/min 的转速冷冻离心10 min,将菌体沉淀用pH 6.7 的PBS (钠盐)洗涤,重复2 次后,加入等体积pH 6.7 的PBS 缓冲液,冰水浴超声处理(超声1.5 s,间歇2 s)10 min,然后4 ℃、5 000 r/min 下冷冻离心10 min,上清液即为粗酶液。
1.3.3 β-半乳糖苷酶水解酶活力测定 参考陈真真等[2]的测定方法,利用HPLC 外标法测定。取500 μL 0.5 mol/L 乳糖溶液 (0.1 mol/L、pH 6.7 的PBS 缓冲液配制),在50 ℃下保温10 min 后加入1 000 μL 酶液,振荡混匀继续反应4 h,沸水浴5 min 灭酶,并用0.22 μm 微孔过滤器过滤,用HPLC-示差检测器检验乳糖水解活性与低聚半乳糖的生成情况。
色谱测定条件:Agilent 1260 高效液相色谱-示差折光检测器;柱温30 ℃;色谱柱:氨基高效液相色谱柱 (Inertsil HPLC Column NH2)(4.6 mm×250 mm,5 μm);流动相:V乙腈:V水=7∶3;流速1.0 mL/min。
1.3.4 低聚半乳糖的测定 取适量酶解液沸水浴5 min 灭酶,适当稀释经0.22 μm 微孔过滤器过滤。将适当浓度的样品依次上样于硅胶层析板上,将硅胶板置于在层析缸中经过二次展开并显色后,在105 ℃烘箱中烘烤至显色。展开剂配制:V正丁醇∶V乙醇∶V高纯水=5∶3∶2,显色剂:V甲醇∶V浓硫酸=20∶1。
1.3.5 酶法合成低聚半乳糖工艺优化 以优化β-半乳糖苷酶合成低聚半乳糖(GOS)工艺为目标,分别考察不同温度,反应时间,pH 值,底物添加量,加酶量对乳糖转化率和低聚半乳糖合成的影响。
根据单因素实验确定影响合成低聚半乳糖的主要因素,利用Design-Expert 软件进行Box-Behnken 三因素三水平试验设计和数据分析。
2 结果与分析
2.1 lacZ 基因的重组表达
带有NcoI 和XhoI 酶切位点的β-半乳糖酶基因与pET28a 连接,构成重组质粒pET28a-lacZ。将重组质粒pET28a-lacZ 通过热击导入大肠杆菌BL21(DE3)后,在37 ℃下进行培养,对长出的克隆子进行验证,结果如图1。其中M 为1 kb Marker,泳道1~10 为菌落PCR 产物。

图1 菌落PCR 电泳图Fig.1 PCR products of colony PCR
对产生的转化子进行水解酶活力测定,其中转化子pET28a-18 和pET28a-24 的水解酶活力分别为(99.067±0.12)U/mL 和(100.247±0.08)U/mL,较重组表达前的水解酶活力提高了近10 倍,因此B5582Y 产乳糖酶基因的克隆表达成功,与王元火等[17]将环状芽孢杆菌β-半乳糖苷酶在大肠杆菌中的表达效率相比,高出了5 倍。同时因上清液中没有酶活,可知重组蛋白以包涵体的形式存在于表达宿主大肠杆菌BL21(DE3)中。
2.2 不同工艺条件对合成GOS 的影响
不同工艺条件对合成GOS 的影响见图2。由图2可知,随着温度,pH 值的增大,GOS 产量呈先增大后减小的趋势,最适温度和pH 值分别为45℃、7.0~7.5。伴随反应时间的推进,GOS 产量也逐渐增加,在10 h 趋势开始平稳;在16 h 时,因底物添加量降低,导致转糖苷作用减弱,GOS 被水解,最终GOS 产量下降,故反应时间定为10 h。初始底物添加量从0 升到90%时,GOS 产量不断增加;当超过100%时,因反应体系的传质效果变差,致使GOS 产量降低,故初始底物添加量定为90%较为适宜。加酶量的增加能提高GOS 产量,然而加酶量超过120 U/mL 时,转糖苷生成的GOS 便无法长期存在,使得GOS 产量下降,故加酶量定为120 U/mL 较为合适。

图2 不同工艺条件对合成GOS 的影响Fig.2 Effect of different process conditions on the synthesis of GOS
酶法合成GOS 的工艺中,β-半乳糖苷酶的来源不同,其合成GOS 的工艺条件也存在着差异。米曲霉(A.oryzae)来源的酶最适pH 值为4.5~6.0,温度在40~60 ℃之间[18];环状芽胞杆菌(B.circulans)来源的最适pH 值为6.0~6.5,温度在55~60 ℃之间[19-21];克鲁氏乳酸酵母(K.Lactis)来源的最适pH 值为6.5~7.0,温度在35~40 ℃之间[22-24]。相比而言,本文研究的β-半乳糖苷酶与克鲁氏乳酸酵母来源β-半乳糖苷酶合成GOS 条件更相近,而克鲁氏乳酸酵母的GOS 产率在35%左右,略低于本研究中的β-半乳糖苷酶。
2.3 响应面优化确定最佳因素水平
由单因素实验结果,选择关键控制因素:A(温度),B (加酶量),C (底物添加量),运用Box-Behnken 进行三因素三水平的试验设计,试验结果见表1。试验结果经Design-Expert 软件分析,低聚半乳糖(GOS)占总糖含量的百分比为响应值Y,得回归方程:

表1 Box-Behnken 试验设计及试验结果Table 1 Experimental design of Box-Behnken and corresponding results
Y=46.4+2.63A-2.00B+2.88C+4.25AB-0.5AC+2.75BC-6.7A2-5.95B2-8.2C2。
对回归方程进行方差分析,结果见表2,模型的P>F 值为0.0047 小于0.01,表明模型极显著。在一次项中因素A(温度)和C(底物添加量)对GOS 产量的影响高于因素B(加酶量)。因此,推测因素A(温度)和C(底物添加量)对该结果影响较大。
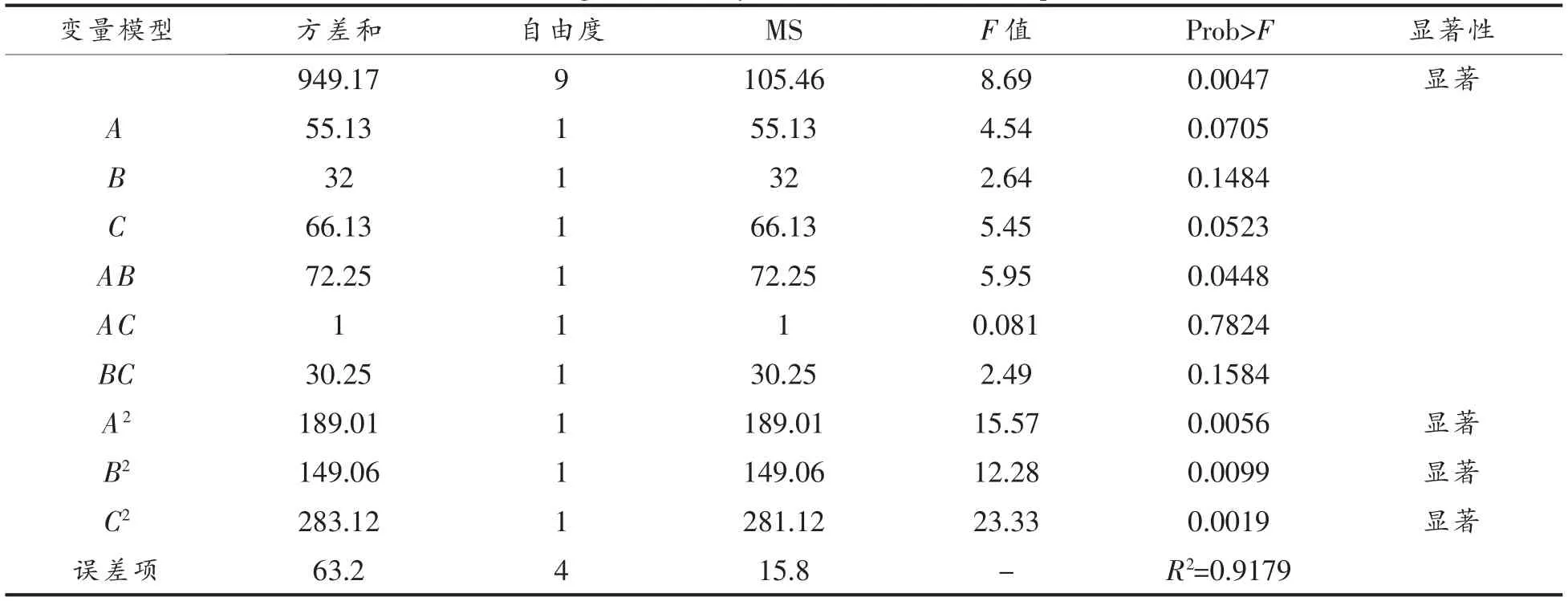
表2 Box-Behnken 试验回归分析Table 2 Regression analysis of Box-Behnken experiment
图3为响应面分析图,由图可知各因素交互作用对响应值影响的大小。等高线反映了各变量间交互作用的情况,当等高线越接近椭圆时,说明两个因素间的交互作用越显著,故从图中也可知A、B、C 3 个因素间的交互作用显著。

图3 酶解温度、加酶量和初始乳糖添加量对GOS 产量的影响Fig.3 The response surface curve of the combined effect of temperature、initial lactose concentration and enzyme concentration on yield of GOS
2.4 验证试验
根据Design-Expert 软件分析,得到当A=44℃,B=130 U/mL,C=95%时,模拟回归方程取最大值为46.9%,即加酶量130 U/mL,温度为44 ℃,底物添加量为95%。考虑到90%时乳糖已经处于饱和状态,故选取90%的乳糖作为最终底物添加量。在以上试验条件下进行3 次重复试验,结果分别为41%,45%,46%,平均值44%,实际测验值与预测值接近,说明可以准确地反映各变量因子对低聚半乳糖合成情况的影响。由于低聚半乳糖的生产与初始底物量、加酶量均有很大关系,因此在生产低聚半乳糖时应注意乳糖的及时补充,以保证可以有较多的低聚半乳糖的产生。
Nguyen 等[25]报道保加利亚乳杆菌(Lactobacillus bulgaricus)产β-半乳糖苷酶合成GOS 得率为50%;Frenzel 等[26]发现环状芽孢杆菌来源的β-半乳糖苷酶合成GOS 得率为41%;Vera 等[27]研究的米曲霉来源的β-半乳糖苷酶合成GOS 得率不足30%;而Katrolia 等[28]报道的铜绿拟青霉(Paecilomyces aerugineus)来源的β-半乳糖糖苷酶在毕赤酵母中表达的重组酶合成GOS 的产率仅19.7%。相比而言,本研究中密歇根克雷伯菌(Klebsiella michiganens)来源的β-半乳糖苷酶经重组后依然具有较好的转糖苷活性。在最优条件下酶法转化乳糖产物通过TLC 薄层层析分析,结果如图4所示。由图可知,该重组酶在水解乳糖生成葡萄糖和半乳糖时,还生成了不同丰度的低聚糖。研究表明,常见的GOS 主要由β(1-4)糖苷键连接而成,而GH2 家族的β-半乳糖苷酶主要合成β(1-3)和β(1-6)糖苷键[11],本研究所用的β-半乳糖苷酶即为GH2 家族酶,据此可推测该重组酶作用生成的产物中有较大比例的β(1-3)和β(1-6)糖苷键连接而成GOS,有别于一般的GOS 中的低聚糖组分,具有较好的研究价值。
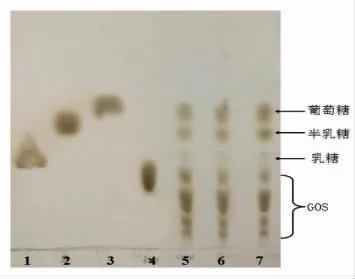
图4 以乳糖为底物时水解产物的薄层层析图Fig.4 TLC of hydrolysate with lactose as substrate
3 结论
团队前期研究发现的克雷伯氏菌B5582Y,所产的β-半乳糖苷酶具有较好的转糖苷活性,丰富了β-半乳糖苷酶的天然来源。本研究中,经重组表达后的β-半乳糖苷酶酶活力比野生菌株提高约10 倍,且转糖苷活性保持在较高水平。酶法转化乳糖过程中,最优条件下可使GOS 得率达到44%,与已报道的β-半乳糖苷酶相比具有良好的转糖苷作用。该研究结果表明克雷伯氏菌B5582Y来源的β-半乳糖苷酶及其重组酶在低聚半乳糖合成中具有较大的应用潜力。
