基于血浆循环游离DNA与甲状腺结节超声特征构建甲状腺癌诊断模型及其验证
2021-09-09余幼林沈雄山胡超华余军林卢婷杨峰张文杰张小莉刘汉忠陶溢潮
余幼林,沈雄山,胡超华,余军林,卢婷,杨峰,张文杰,张小莉,刘汉忠,陶溢潮
(武汉科技大学附属孝感医院1.甲状腺乳腺外科2.肿瘤科3.病理科4.超声科,湖北孝感432000; 5.锦州医科大学,辽宁锦州121000)
甲状腺癌是最常见的内分泌恶性肿瘤,近年来发病率呈不断上升趋势[1-2]。临床上,甲状腺超声检查联合细针穿刺抽吸活检(ultrasound-fine needle aspiration biopsy,US-FNAB)被认为是甲状腺结节良恶性鉴别主要手段[3-5]。但仍然存在自身局限性。甲状腺良恶性结节在超声声象表现上存在交叉、重叠现象,超声操作者诊断带有自身主观性。FNAB 操作有创,并非所有结节能实现有效取材,特别是位置特殊,较小结节。在获取组织细胞诊断仍存在30%不能明确[6]。单一检测手段其临床价值有限。因此,探索建立新的无创检测方法对提高诊断甲状腺癌准确率具有重要意义。
外周血循环游离的DNA(cfDNA)来源于细胞坏死或凋亡后释放的DNA 片段或增殖细胞(如肿瘤细胞)主动分泌DNA 片段。包含了循环肿瘤DNA(ctDNA)[7-10]。cfDNA 在甲状腺癌中的研究处于初级阶段。有研究[13]显示:cfDNA 在甲状腺癌诊疗中可作为的潜在生物标志物[11]。检测cfDNA 片段的完整性可用于甲状腺癌的诊断[12]。cfDNA 定量联合BRAF V600E 突变检测可用于甲状腺癌早期诊断。因此,在本研究通过检测甲状腺结节患者cfDNA 浓度,联合甲状腺结节超声特征性改变建立评分系统分析在甲状腺癌诊断中临床价值。
1 资料与方法
1.1 一般资料
选择2018年6月—2020年10月在武汉科技大学附属孝感医院(孝感市中心医院)住院治疗240 例甲状腺结节患者为研究对象,按照1∶1 随机分为建模组120 例,验证组120 例。本研究的纳入标准:⑴患者年龄20~70 岁;⑵有完整甲状腺+颈部淋巴结超声检查资料;⑶单灶性和多灶性甲状腺结节,无论良恶性结节均可;⑷甲状腺手术后,明确组织学病理诊断。切除组织前未行碘131 治疗,未经任何放化疗或者内分泌治疗。排除标准:⑴一般临床数据资料不完整;⑵甲状腺超声检查图像结果不完整;⑶患有其他肿瘤疾病者;⑷甲状腺良性结节合并恶性结节。所有患者均进行手术明确病理诊断,其中甲状腺癌132 例,良性甲状腺结节108 例(腺瘤29 例,结节性甲状腺肿,包括结节性甲状腺肿囊性变共79 例)。本研究经医院伦理委员会批准(伦理审批号sw2017002),且研究对象均知情同意签署知情同意书。
1.2 检测方法
1.2.1 超声检查术前所有的患者进行甲状腺超声检查,检查内容:甲状腺结节性质(囊性,非囊性)、纵横比、包膜完整性、回声,有无钙化。超声检查设备采用深圳迈瑞生物医疗电子股份有限公司,机器型号RESONA7,探头L11-3U。甲状腺良恶性结节超声检查图像见图1。
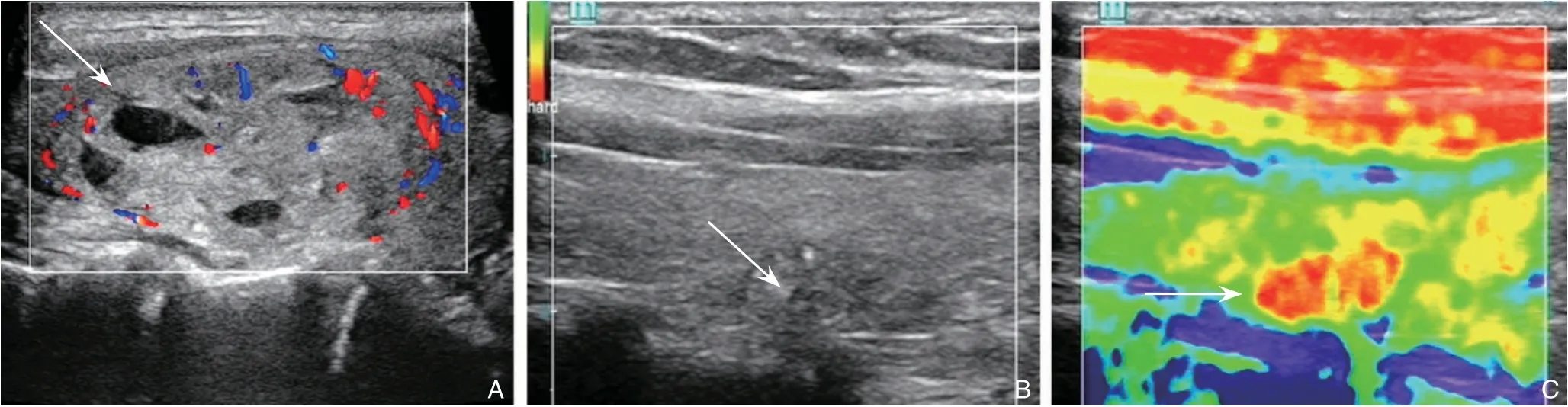
图1 甲状腺结节超声图像A:甲状腺良性结节(箭头所示);B-C:甲状腺恶性性结节(箭头所示)Figure 1 Ultrasound images of the thyroid nodulesA:A benign thyroid nodule(shown by the arrow);B-C:A malignant thyroid nodule(shown by the arrow)
1.2.2 cfDNA 检测⑴样本采集:术前240 例患者抽取静脉血5 mL 置于EDTA 抗凝管中,在室温下,3 000r/min,离心15 min,取上清置于冻存管放入-80 ℃备用。⑵血浆DNA 的提取及纯化:采用血浆游离DNA 提取试剂盒(天根,DP339)提取血浆游离的DNA 并进行纯化,按照试剂盒操作说明进行。⑶血浆DNA 的定量:通过荧光定量PCR 反应试剂盒(天根)进行DNA 染色,后进行荧光定量PCR,以基因β-actin 作为参照基因,上游引物5'-TAT CCA GGC TGT GCT ATC CC-3',下游引物5'-CCA TCT CTT GCT CGA AGT CC-3'。设置反应条件:95 ℃预变性30 s,随后,95 ℃变性5 s,60 ℃退火、延伸30 s,共设置40 个循环,同时设置实验组和对照组,每组设置2 个复孔,由已知浓度的人HepG2 细胞提取的DNA 倍比稀释进行扩增得到Ct(cycle threshold)值并绘制标准曲线,依据标准曲线计算血浆DNA 的含量。
1.3 统计学处理
采用SPSS 22.0 进行统计分析,计量资料采用均数±标准差(±s)表示,两组计量资料的比较采用t检验,两组计数资料的比较采用χ2检验。多因素分析采用Logistic 回归,标准化回归系数(β)为0.5513×回归系数×标准差。根据标准化回归系数对单一指标进行评分,构建10 分制评分系统,并计算每个人的总得分。cfDNA 及评分的最佳截断值通过ROC 曲线分析实现。通过Graphpad Prim 进行绘图。
2 结果
2.1 甲状腺良恶性结节患者的血浆cfDNA 的浓度差异
240 例甲状腺良、恶性结节组进行比较,结果表明,甲状腺癌组的cfDNA 浓度明显高于良性结节组,两组之间差异有统计学意义(P<0.001)。其中良性结节组的cfDNA 浓度的范围为20.16~78.42 ng/mL,平均(54.35±11.76)ng/mL;甲状腺癌组的cfDNA浓度的范围为45.62~84.33 ng/mL,平均(62.16±7.82)ng/mL(图2)。进一步ROC 曲线分析结果表明,良恶性结节组的cfDNA 浓度的最佳截断值为56.84 ng/mL(AUC=0.707)(图3)。
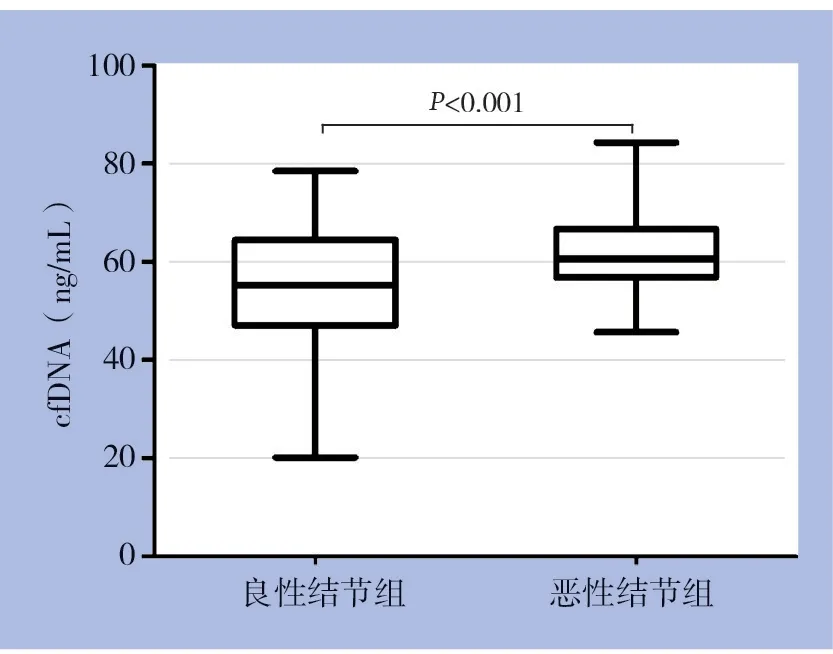
图2 甲状腺良恶性结节患者的cfDNA浓度比较Figure 2 Comparison of the cfDNA concentrations between patients with benign and malignant thyroid nodules
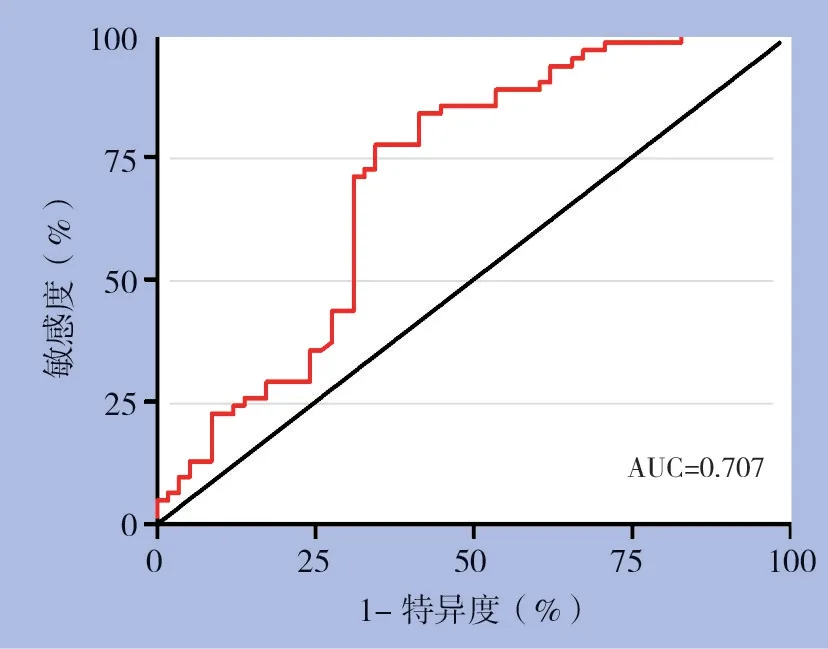
图3 cfDNA诊断甲状腺癌的ROC曲线Figure 3 The ROC curve of cfDNA in diagnosis of thyroid cancer
2.2 基线特征比较
建模组和验证组患者的基线特征比较结果显示,建模组120 例患者中男31 例,女89 例;中位年龄45(28~68)岁。验证组120例患者中男33例,女87 例;中位年龄46(25~67)岁。cfDNA 浓度及超声影像(纵横比,内部回声,包膜,钙化,囊性病变)在两组之间差异无统计学意义(均P>0.05)(表1)。
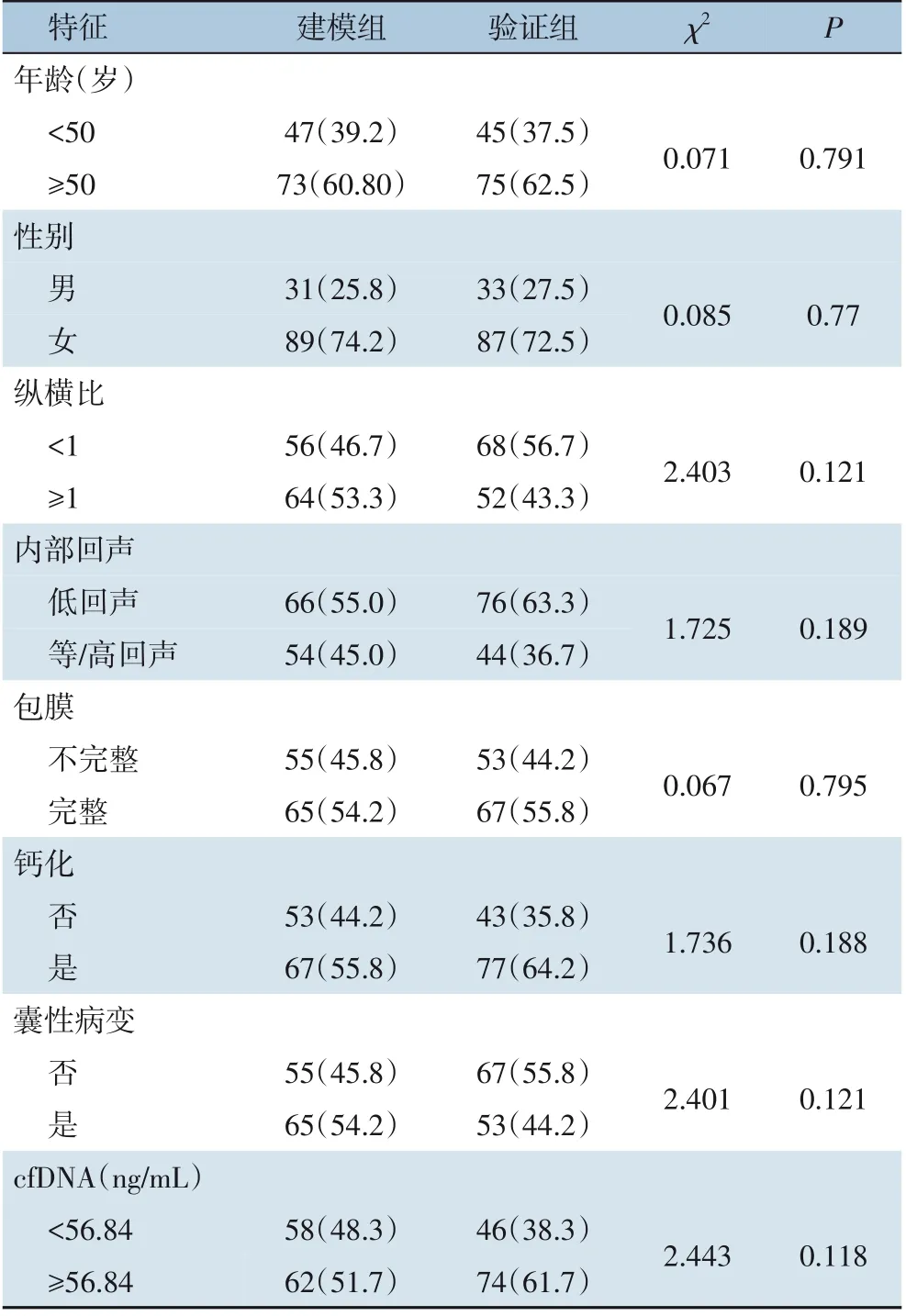
表1 建模组和验证组患者的基线特征比较[n=120,n(%)]Table 1 Comparison of the baseline characteristics between modeling group and validation group[n=120,n(%)]
2.3 建模组中影响甲状腺癌诊断的单因素分析
建模组中良性和与恶性结节两组比较结果显示,两组间cfDNA 浓度及超声影像(纵横比,内部回声,包膜,钙化,囊性病变)的差异均有统计学意义(均P<0.001)(表2)。
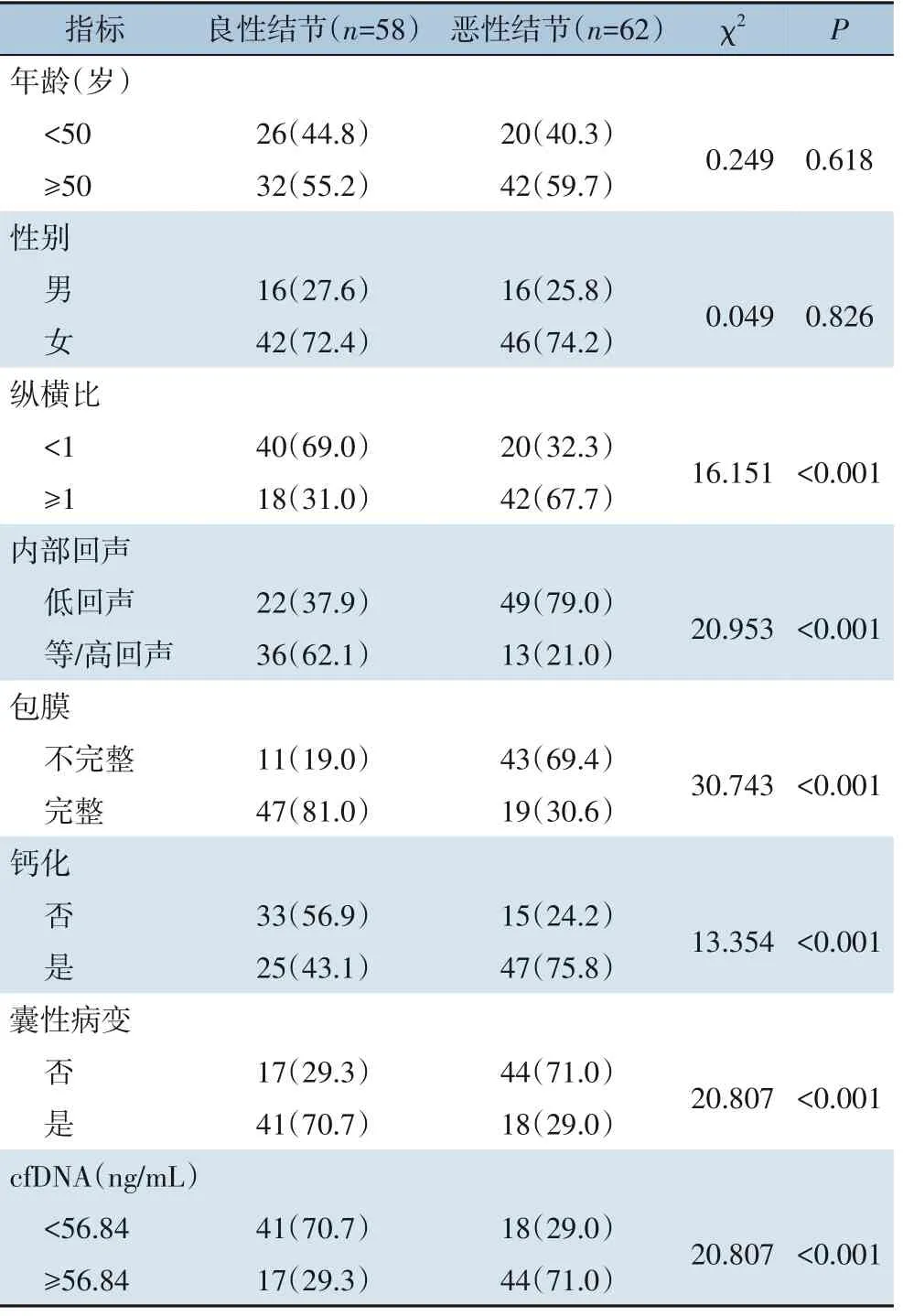
表2 单因素分析建模组中甲状腺癌诊断的影响因素[n=120,n(%)]Table 2 Univariateanalysisoffactorsforaffectingthediagnosisofthyroidcancerinmodelinggroup[=120,n(%)]
2.4 建模组中影响甲状腺癌诊断的多因素分析及评分标准
多因素分析结果表明,cfDNA≥56.84 ng/mL,超声显示:纵横比≥1,不完全包膜,低回声,钙化,和非囊性病变是诊断甲状腺癌的独立危险因素(均P<0.05)。根据Logistic 回归的标准系数评分标准(10 分制),cfDNA≥56.84 ng/mL 为1.2 分,超声指标:纵横比≥1(2.2分),不完全包膜(2.1分),低回声(1.8 分),钙化(1.3 分),非囊性病变(1.5 分)(表3)。
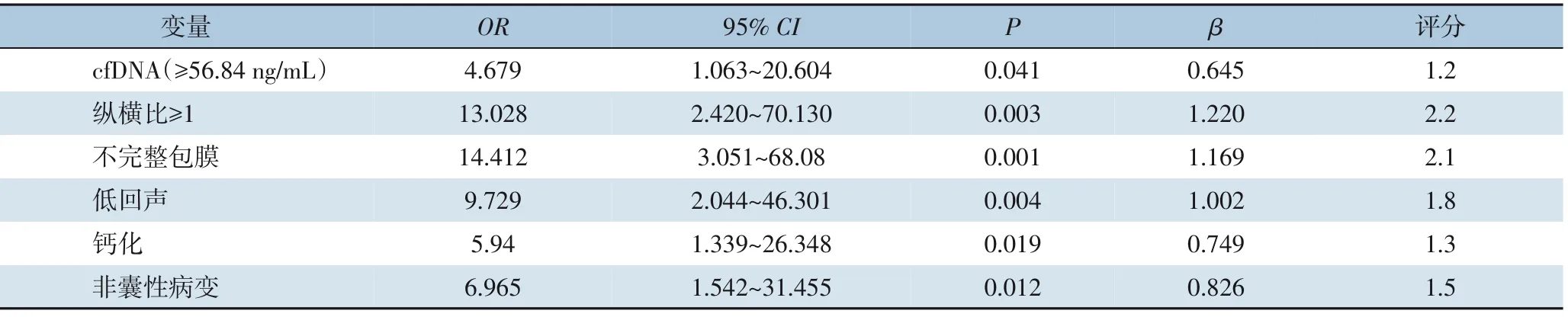
表3 多因素分析建模组中甲状腺癌诊断的影响因素及评分标准Table 3 Multivariate analysis of the factors affecting the diagnosis of thyroid cancer in modeling group and their scoring standards
2.5 单一指标及评分系统在甲状腺癌诊断中的预测价值
良性甲状腺结节组的综合评分为3.16±1.77,甲状腺癌组的综合评分为7.37±1.52。两组具有统计学差异(P<0.001)。进一步ROC 曲线分析结果表明(图4),该评分系统在建模组中诊断甲状腺癌的效能较高(AUC=0.958,95%CI=0.926~0.989),高于单一指标(纵横比、内部回声、包膜、囊性病变、钙化、cfDNA 的AUC 值分别为0.457、0.706、0.752、0.708、0.680、0.715)。评分系统诊断模型最佳截断值5.5。以最佳截断值为参考点,其相对应的敏感度,特异度,阳性预测值,阴性预测值分别为85.5%,89.7%,89.8%,85.2%,均高于单一指标(表4)。在验证组中,该模型诊断甲状腺癌的敏感度、特异度、阳性预测值、阴性预测值分别为83.8%、86.2%、86.7%、83.3%,AUC 为0.902(95%CI=0.848~0.957),高于单一指标(纵横比、内部回声、包膜、囊性病变、钙化、cfDNA 的AUC 值分别为0.498、0.712、0.731、0.701、0.668、0.709)(表4)。
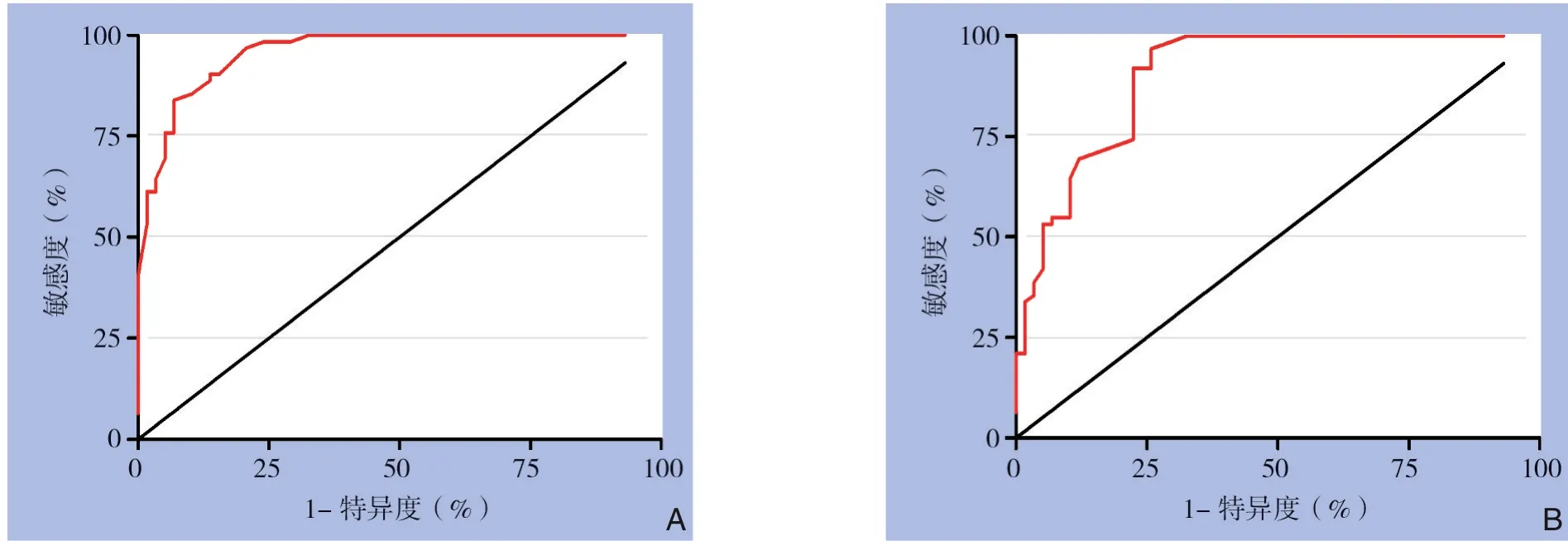
图4 评分系统的ROC曲线A:建模组;B:验证组Figure 4 The ROC curves of scoring systemA:Modeling group;B:Validation group
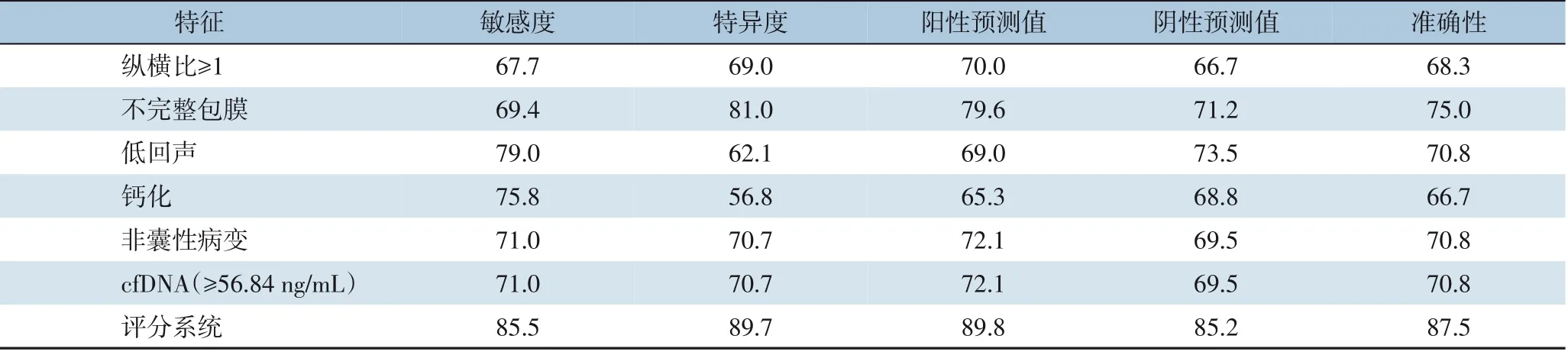
表4 建模组中单一指标及评分系统在甲状腺癌诊断中的诊断效能(%)Table 4 Predictiveefficacyof singlefactorand the scoresystem fordiagnosis of thyroidcancerinmodelinggroup(%)
3 讨论
据癌症统计数据显示:甲状腺癌目前是发病率增长最快的恶性肿瘤之一[1-2]。临床上,甲状腺超声检查联合US-FNAB 用于甲状腺良恶性结节鉴别诊断常用的方法。但仍然存在20%~25%细胞学诊断不能明确[14]。即使对部分结节重复FNAB,还是有大约9.9%~47.8% 无法诊断或意义不明确[15]。US-FNAB 联合分子诊断也是相对较低敏感度(48%~63%)[16-17]和相对较低特异度(48%~53%)[18]。最近研究显示:US-FNAB 对甲状腺癌诊断敏感度为57.89%[19]。单独超声检查结果与病理诊断的符合率在60%和90%之间波动,诊断差异性较大[14]。
在肿瘤患者中,cfDNA 被增殖肿瘤细胞释放,通常携带有原发性肿瘤或转移灶相同生物学特性的基因组信息。其浓度的改变及其基因特性变化可间接反映肿瘤的生物学行为[20-23]。亦有研究证实:cfDNA 可用于肿瘤诊断,治疗及预后监测[24-25]。在转移性黑色素瘤患者中,cfDNA 浓度在治疗前后的变化可作为肿瘤负荷和预后的生物标志物[26]。在转移性结直肠癌患者中,化疗前cfDNA 低水平患者比高水平者具有更长的生存期,治疗后cfDNA 水平低于中位数的患者总体生存有改善,并且治疗反应良好[27]。在胃癌患者中,血浆cfDNA 含量与肿瘤大小正相关。cfDNA 基因改变与组织活检结果高度一致。cfDNA 还可预测远处转移,在转移性胃癌患者中,cfDNA 浓度中位数比无转移者高约60 倍[28]。在非小细胞肺癌(NSCLC)中,cfDNA 浓度较高患者的中位无进展生存期(PFS)和总体生存期(OS)时间较短。cfDNA 可以作为NSCLC 患者预后预测生物标志物[29]。在小细胞肺癌中,cfDNA 同样可用于化疗疗效评估及肿瘤复发监测[30]。乳腺癌患者cfDNA 高水平与患者不良的PFS 和OS 相关[31]。在本项研究中发现:甲状腺恶性结节患者cfDNA 浓度高于甲状腺良性结节者,cfDNA 可作为甲状腺癌诊断分子标志物。
考虑到上述甲状腺超声检查联合细针穿刺抽吸活(US-FNAB)自身特点的局限性。并分析了cfDNA 在肿瘤诊疗中临床应用价值。本研究基于甲状腺癌超声声学特征性改变联合cfDNA 构建的评分系统诊断模型。在本研究中,ROC 曲线结果表明:当cfDNA 浓度≥56.84 ng/mL 对甲状腺结节良恶性具有较好的鉴别价值。甲状腺癌超声声学表现为纵横比≥1 低回声,钙化,包膜不完整及非囊性病变,与既往的研究相一致[32-34]。值得关注的是,在本研究中,cfDNA 的浓度联合甲状腺癌5 个超声声学特征构建基于评分系统的无创诊断模型用于甲状腺结节良恶性鉴别。该模型cfDNA 评分权值为1.2,均低于另外的超声学特征,可能存在的原因:⑴选取样本量相对较小。⑵选取临床病例大部分甲状腺癌肿瘤负荷较小,释放到外周血中cfDNA 含量有限。⑶cfDNA 浓度变化与肿瘤临床分期具有明显相关性。通常,肿瘤TNM 分期越晚,cfDNA 水平越高[35]。本研究中选取大部分早期甲状腺癌临床病例。ROC 曲线分析结果提示该评分系统诊断模型具有较高的诊断效能(AUC=0.958,95%CI=0.926~0.989),且模型最佳截断值为5.5 分。建模组和验证组结果均显示:当评分≥5.5 分诊断甲状腺癌具有良好的敏感度和特异度,阳性预测值,阴性预测值,高于传统的单一指标检测的预测价值。 该模型对比FNAB+BRAF+超声诊断方法具有无创,可实现甲状腺结节动态监测。对于存在区域淋巴结转移或远处转移,也具有一定预测价值。BRAF 基因在中国甲状腺乳头状甲状腺癌中突变率为71.2%[36]。其他病理类型甲状腺癌伴有BRAF 基因突变相对较低。对于直径<1 cm 或位置较深,富血供的甲状腺结节,FNAB 穿刺更易出现取材结果不满意[37-38],导致诊断甲状腺癌假阴性率较高,该模型可有效弥补上述方法缺陷。同时,本研究也存在一些局限性:⑴本研究总体样本量较少,需要多中心更大样本量的检验诊断效能;⑵本研究尚未进一步分析该模型在不同临床分期甲状腺癌中诊断价值以及在不同甲状腺癌病理分型中的诊断效能,后续将开展相关研究。
总之,本研究基于cfDNA 的浓度和甲状腺癌超声特征性声学改变建立评分系统诊断模型用于甲状腺良恶性结节鉴别,为甲状腺癌的无创诊断提供了新思路。更值得关注的是这个诊断模型也可用于甲状腺良性结节动态无创监测,在甲状腺结节的诊断和动态监测中具有重要的临床价值。
