侵犯第一肝门肝内胆管癌手术的临床价值
2021-09-09郭俊武戴炳华朱恒美隋承军谢峰耿利杨甲梅
郭俊武,戴炳华,朱恒美,隋承军,谢峰,耿利,杨甲梅
(中国人民解放军海军军医大学附属东方肝胆外科医院1.特需治疗一科2.胆道三科,上海200433)
肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)是起源于二级以上胆管上皮的恶性肿瘤,占原发性肝脏恶性肿瘤的10%~20%,是仅次于肝细胞癌的第二大原发性肝癌[1]。近年来,ICC 发病率在世界范围内呈持续上升趋势。因其恶性程度高,根治术后5年生存率仅为20%~36%[2],但根治切除仍是目前ICC 最有效的治疗方法[3]。由于其易发生淋巴结转移、脉管侵犯、肝内及肝外转移,切除率仅为15%~30%,远低于其他肝胆恶性肿瘤[4-5]。侵犯第一肝门肝内胆管癌(hilar type intrahepatic cholangiocarcinoma,HICC)作为ICC 的一种类型又称为中央型ICC,有别于肿瘤位于肝周的外周性肝内胆管癌(peripheral intrahepatic cholangiocarcinoma,PICC)[6-7]。 因HICC 与与肝门部胆管癌(hilar cholangiocarcinoma,HCCA)有相近的临床表现,手术方式及分子病理学特征,有研究将HICC 及HCCA 统称为围肝门胆管恶性肿瘤[8]。但在临床上HICC 表现出与HCCA 及PICC 明显不同的生物学特征。前者属于恶性程度更高的肿瘤类型,表现为更易发生血管侵犯、淋巴结转移及神经浸润[9-10]。目前为止,有关HICC 手术预后的文献并不多,部分文献仅将根治性切除后的HICC 与HCCA 及PICC预后相互比较。但遗憾的是多数HICC 并不能获得根治性切除。目前少有文献将HICC 根据手术方式及影响HICC 手术预后的危险因素分层分析。本文回顾性分析98 例行手术治疗的HICC 患者的临床及病理资料,以探讨HICC 手术治疗的临床价值。
1 资料与方法
1.1 一般资料
回顾性分析2010年11月—2016年6月在海军军医大学东方肝胆外科医院诊断为HICC 行手术治疗的98 例患者的临床及病理资料,其中男56 例(57.1%),女42 例(42.9%)。平均年龄(58.83±9.28)岁。合并乙肝17 例,无肝硬化病例。纳入标准:⑴术前影像学考虑为HICC;⑵术前肝功能Child-Pugh 分级为A 级;⑶术后病理为肝内胆管癌。排除标准:⑴术前检查怀疑有远处转移;⑵术前曾有相关抗肿瘤治疗;⑶围手术期死亡病例。收集资料包括年龄、性别、手术方式、有无淋巴结转移、有无肝门血管侵犯、有无神经侵犯、肿瘤分化程度、肿瘤直径、肿瘤个数等。
1.2 定义及分组
将肿瘤位于门静脉矢状部右侧(U 点)和门静脉右后支左侧(P 点)两点之间胆管癌定义HCCA,肿瘤超出上述范围同时合并第一肝门侵犯的ICC 为HICC,无肝门侵犯证据的ICC 为PICC[9,11]。根据是否行根治性手术,将R0切除的患者定义为根治手术组,R1及R2切除为姑息手术组。其中R2切除包括减瘤手术、胆肠吻合或T 管引流、剖腹探查活检等。将根治手术组中,根据有无肝门血管侵犯(HVI)分为非HVI 组与HVI 组。
1.3 随访
全组患者术后每3 个月复查肝肾功能,肿瘤标记物,肝脏超声及肝脏MRI。本研究最后随访时间为2019年12月31日。随访时间2~108 个月。患者术后总生存时间(overall survival,OS)按自手术日至患者死亡或最后1 次随访时间计算。
1.4 统计学处理
计量资料采用独立样本t检验或Mann-WhitneyU检验分析。分类资料用χ2检验进行统计分析。采用Kaplan-Meier 生存分析法分析术后生存情况并绘制生存曲线,采用Log-rank 法校验生存率。采用Cox 风险比例模型确定与预后相关的危险因素。P<0.05 为差异有统计学意义。所有分析应用IBM-SPSS 26.0 统计学软件完成。
2 结果
2.1 临床病理结果
本研究纳入病例均侵犯肝门部胆管,合并肝门部血管受侵49 例(50.0%)。肿瘤平均直径(4.57±1.92)cm。肿瘤单发75 例(76.5%)、多发23 例(23.5%)。根治手术67 例(68.4%)、姑息手术31 例(31.6%),包括R1切除3 例,R2切除28 例。根治手术组中行左半肝切除40 例(59.7%),右半肝切除24 例(35.8%),中肝叶切除3 例(4.5%),其中合并尾状叶切除51 例(76.1%),行胆肠吻合58 例(86.6%),T 管引流5 例(7.5%),淋巴结清扫59 例(88.1%)(表1)。根治手术组中合并血管侵犯32 例(47.8%),术中常规切除受侵的门静脉及肝动脉的左或右支,侵犯肝固有动脉的行肝固有动脉切除。姑息手术组中,经探查发现广泛的腹膜种植(6 例),肝内广泛转移(2 例),广泛区域内淋巴结转移(8 例),区域外淋巴结转移(2 例),肿瘤包绕门静脉及肝动脉无法分离(4 例),门静脉主干受侵(5 例)。全组中术前合并阻塞性黄疸72 例,其中36 例行术前减黄。术后出现手术并发症14 例(14.3%),其中胆肠吻合口瘘8 例,肝脓肿1 例,术后肝创面渗血再手术1 例,消化道出血2 例,腹腔感染1 例,不完全性肠梗阻1 例。围手术期无死亡。全组患者有39(39.8%)例行术后辅助治疗,治疗方式包括术后放疗、化疗及TACE 等。
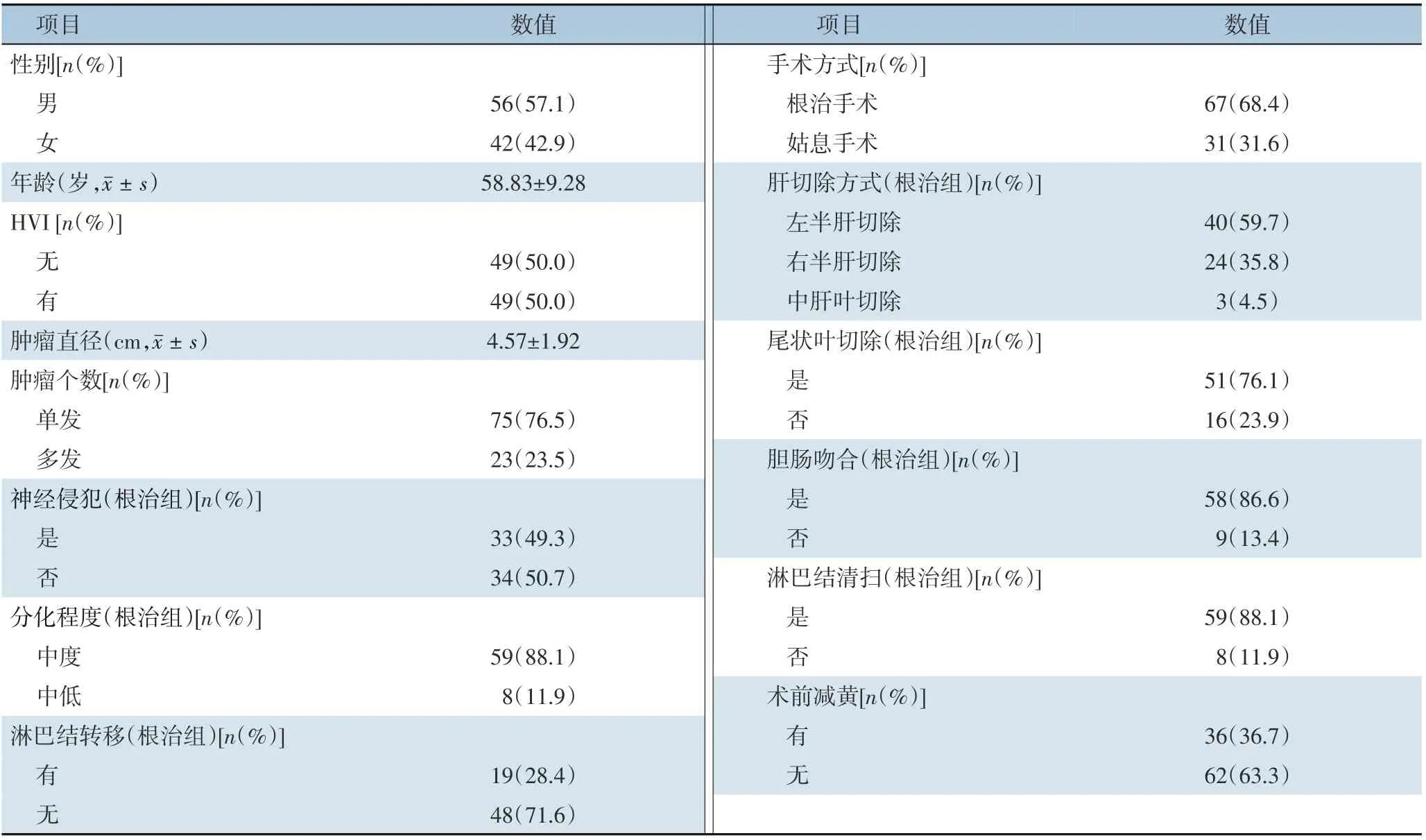
表1 HICC患者的一般资料Table 1 General data of the HICC patients
2.2 HICC患者生存分析及各组生存率比较
全组患者中位生存时间12.0 个月,1、3、5年OS 为46.5%、11.7%、5.8%。根治手术组中位生存时间14.0 个月,1、3、5年OS 为62.7%、16.4%、8.2%,姑息手术组中位生存时间7.0月,1、3、5年OS为30.4%、0、0,两组差异有统计学意义(P=0.004)(图1A)。在根治手术组中,非HVI 组中位生存时间21.0 个月,1、3、5年OS 为68.6%、25.7%、16.1%,HVI 组中位生存时间9.0 个月,1、3、5年OS 为46.9%、6.3%、0,两组差异有统计学意义(P=0.002)。非HVI 组预后优于姑息手术组(P<0.001);HVI 组与姑息手术组预后比较差异无统计学意义(P=0.192)(图1B)。
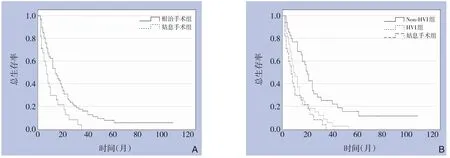
图1 HICC患者生存曲线A:根治手术组与姑息手术组生存曲线比较;B:非HVI组与HVI组、姑息手术组生存曲线对比Figure 1 Survival curves of the HICC patientsA:Comparison of survival curves between radical surgery group and palliative surgery group;B:Comparison of survival curves among non-HVI group,HVI group and palliative surgery group
2.3 根治性手术预后的危险因素分析
Cox 单因素分析显示,肿瘤直径(HR=1.17,95%CI=1.04~1.32,P=0.012)、HVI(HR=2.12,95%CI=1.27~3.54,P=0.004)及CA19-9 高水平(HR=1.88,95%CI=1.06~3.33,P=0.031)是影响HICC预后的危险因素。多因素分析显示,HVI(HR=2.02,95%CI=1.19~3.44,P=0.009)及CA19-9 高水平(HR=1.89,95%CI=1.05~3.43,P=0.035)是影响HICC 预后的独立危险因素。肿瘤个数、神经侵犯、淋巴结转移及有无术后治疗等对HICC 预后的影响无统计学意义(均P>0.05)(表2)。
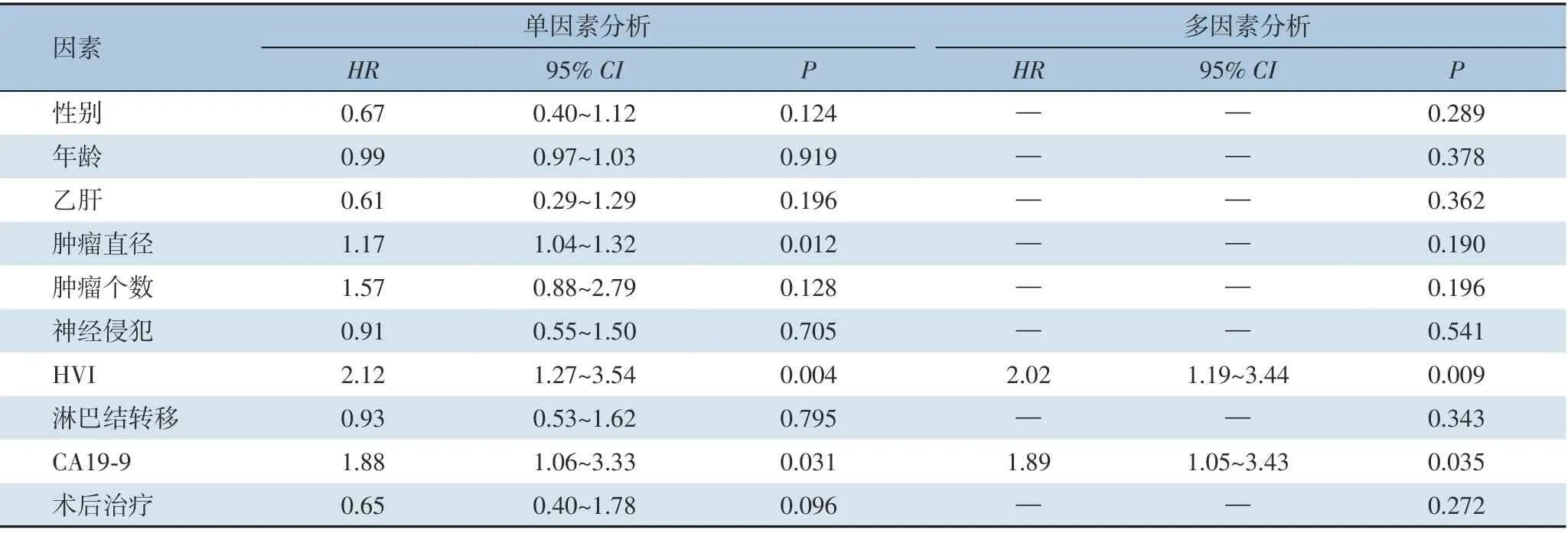
表2 影响根治手术患者预后的危险因素分析Table 2 Analysis of risk factors for prognosis of patients after radical surgery
2.4 根治手术组间临床病理结果比较
非HVI 组与HVI 组相比,前者平均年龄及肿瘤直径均小于后者(均P<0.05),两组之间患者性别、有无乙肝、肿瘤个数、淋巴结转移、神经侵犯及CA19-9 值等差异无统计学意义(均P>0.05)(表3)。

表3 非HVI组和HVI组间临床病理特征对比Table 3 Comparison of the clinicopathologic characteristics between non-HVI group and HVI group
3 讨论
HICC 是ICC 的一种特殊类型,又与HCCA 及侵犯肝门的胆囊癌同属围肝门胆道肿瘤,具有与ICC和围肝门胆管癌相似的临床及病理特征:⑴具有嗜神经侵犯的特点,肿瘤可在肝门区狭小的空间内沿着肝门板神经结缔组织侵犯临近的肝动脉和门静脉;⑵易发生肝内播散、肝外转移、淋巴结转移及腹膜种植;⑶梗阻性黄疸及反复的胆道感染引起的肝功能损害是HICC 常见的病理生理学改变,加上原有的基础疾病如肝内胆管结石、肝硬化等使其具有错综复杂的病理生理学改变[12-13]。上述因素是HICC 手术难度大,R0切除率低的原因。本研究报道的根治性切除率达68.4%是因为仅纳入肝功能Child-Pugh 分级A 级及术前评估可根治手术的患者,有更多的病例因肝功能不能耐受或术前发现有肝内播散、远处转移等因素而失去手术的机会。在术前评估可手术的病例中,仍有31.6%病例无法根治手术,多因淋巴结广泛转移、局部或门静脉主干受侵严重仅行胆肠吻合或开腹探查,有8.2%(8/98)因术中发现广泛的腹膜种植及肝内播散而无法进行手术处理。因此术前应采取精准的可切除性评估并常规行PET-CT/MRI 以明确有无肝内病灶播散及肝外隐匿性转移而减少不必要的开腹探查[14-15]。
为了达到R0切除,需采取半肝或更大范围的肝切除,并结合肝门部胆管和(或)血管切除、胆肠吻合及区域淋巴结清扫等[14]。但目前为止并没有标准的手术方式。如是否常规行淋巴结清扫,在ICC 的手术治疗中仍存在明显争议。有文献认为淋巴结清扫可降低局部复发率,改善预后,以及有利于指导术后分期[16-18]。也有文献[19-20]报道术中预防性淋巴结清扫不但不能改善预后,还会延长手术时间增加手术并发症。本文根治性手术组中行淋巴结清扫后并未获得有益的结果。对于合并有血管侵犯的HICC 是否行扩大切除文献报道的较少。Bartsch 等[21]将合并血管侵犯行扩大切除与无血管侵犯对比,前者即使行根治性手术预后仍较差,但优于剖腹探查者。本研究合并血管侵犯的根治手术组病例中,如侵犯肝固有动脉或其左右支均行切除,门静脉左或右支受侵均切除左或右支。合并门静脉左右支分叉处受侵者切除后能端端吻合均予切除。但门脉主干受侵严重切除后无法吻合的则行姑息性手术。本研究中合并血管侵犯的HICC 即使行根治性切除仍无生存获益,与姑息手术的预后相比无显著差异。至于HICC 是否常规行尾状叶切除尚无统一的标准。肝门胆管癌有较高的尾状叶侵犯率,因此建议常规行尾状叶切除[22-23]。而文献报道中的HICC 并没有常规实行尾状叶切除,Lu 等[24]报道手术切除的114 例HICC 尾状叶切除率为78.1%。与本研究尾状叶切除率为76.1%相近。HICC 是否行尾状叶切除与肝内肿瘤侵犯肝门的程度决定的,无明显尾状叶侵犯者可不将尾状叶切除作为手术的常规。
根治性手术切除虽然是ICC 最佳的治疗手段,但长期预后仍较差[25]。HICC 是比PICC 及HCCA 恶性程度更高的肿瘤类型。一项多中心回顾性研究[24]总结了101 例HICC,其中位生存之间为26.0 个月,明显低于HCCA 的49.0 个月与PICC 的54.0 个月。另一项回顾性研究[9]纳入146 例HICC 与179 例HCCA对比,前者中位生存时间21.6 个月,差于后者的30.6个月。Snao等[10]也报道了HCCA(mOS:33.7个月)预后显著优于HICC(mOS:22.7 个月)。Aishima等[26]研究也得出相同及结论。HICC 预后更差的原因是与HICC 及HCCA 相比更易发生淋巴结转移、神经浸润、血管侵犯等有关。本研究总结的无血管侵犯的HICC 中位生存时间为21.0 个月,与文献报道的相近。但目前报道的文献中较少以有无血管侵犯将HICC 的预后行分层分析,本研究表明合并血管侵犯的HICC 的预后较差,其预后并不优于姑息性手术。
文献[9,19,24,27-29]报道HICC 肝门部血管侵犯率高达40%~58%,高于PICC 及其他围肝门胆管肿瘤。本研究总结的病例HVI 率高达50%,根治手术组中肝门血管侵犯率达47.8%。因此合并HVI 是HICC 不能忽视的问题。多数研究均表明HVI 是影响HICC预后不良的危险因素[9-10,24,26],与本研究的结果一致。更高的血管侵犯率是HICC 预后较差的原因之一。术前明确有无HVI 是决定是否手术的首要条件。值得注意的是年龄>60 岁及肿瘤直径≥5 cm 的患者有更高的血管侵犯率,因此建议疑有血管侵犯者行三维重建可提供更多的血管侵犯的信息[30]。
本研究存在一定的局限性,首先本研究属于单中心回顾性研究,其次受限于样本量原因,本研究并没有将术后辅助治疗行深入的分层分析,可能造成结果存在一定的偏倚。但本研究将有无根治切除及有无HVI 分层分析其预后结果,目前在文献中少有报道。接下来的临床研究中,仍需要大样本前瞻性或随机对照研究验证其结果的可靠性。
总之,HICC 手术难度大,易发生HVI,预后差。无HVI 的HICC 行根治性切除后可使患者获益,但伴有血管侵犯即使行根治切除预后仍较差。随着分子发病机制研究的深入,药物治疗包括化疗、免疫及靶向治疗必将在HICC 治疗方面发挥重要的作用。以手术为主的综合治疗是今后的发展方向。
