肝细胞癌中miR-574-5p的表达与作用及其与预后的关系
2021-09-09李乾郭清皓
李乾,郭清皓
(华中科技大学同济医学院附属武汉中心医院急诊创伤外科,湖北武汉430000)
肝细胞癌(hepatocellular carcinoma,HCC)是全球第六大恶性肿瘤,是癌症相关死亡的第二大原因,每年在全球范围内造成近70 万例患者死亡。HCC 发病有明显的地域分布特点,以东南亚居多[1]。虽然得益于手术及靶向疗法的发展,但是高复发率及转移率仍是影响HCC 术后预后不佳的主要原因。据报道[2]肝癌切除术后复发率在前2年约为50%,在5年内增加至75%。深入阐述HCC 发生和发展的分子机制,对筛选新型分子诊断标志物、治疗靶点及提升诊治水平至关重要[3-4]。miRNA 是一类短链非编码RNA,长度为18~22 个核苷酸,在转录后水平与靶基因mRNA 的3'-非翻译区碱基配对,是一种调节基因表达的关键分子[5-6]。miRNA参与各种细胞生物学过程,如细胞增殖、分化、凋亡和代谢[7-8]。miRNA 的异常表达可通过调节特定基因在肿瘤发展中发挥关键作用[9]。miR-574-5p是最新鉴定的miRNA 分子,其在结直肠癌[10]中表达上调并通过Wnt/β-catenin 信号通路参与肿瘤进展。miR-574-5p 在甲状腺癌中上调表达,并与预后密切相关[11]。尽管如此,miR-574-5p 在HCC 中的表达及与预后的关系尚不清楚。本研究旨在评估miR-574-5p 在HCC 中的表达与预后的关系及可能的机制。
1 材料与方法
1.1 临床标本
收集2014年1月—2018年1月接受肝癌切除术的130 例HCC 患者的癌及癌旁组织标本。纳入标准:⑴所有患者均接受肝癌切除术且经病理确诊为HCC[12];⑵根据国际抗癌联盟第6 版肿瘤淋巴结转移(TNM)分类确定肿瘤TNM 分期;⑶患者按NCCN 指南标准进行治疗;⑷除肝癌外,患者不存在其他部位肿瘤。排除标准:临床及随访资料不全者。所有患者的组织标本在手术切除后立即保存于-80 ℃冰箱直至统一检测,HCC 组织选择为癌组织,癌旁组织选择为距离肝癌边缘3 cm 的非癌肝组织。本研究经过医院伦理委员会批准同意实施。
1.2 实验细胞
正常肝细胞系L-02、HCC 细胞系HepG2 和MHCC-97H 购自中国科学院细胞培养物保藏中心(中国上海),所有细胞系均在37 ℃、5%CO2的DMEM 培养基中培养。
1.3 研究方法
1.3.1 随访资料随访内容包括肝癌切除术后每3 个月检测血清甲胎蛋白(AFP)水平、腹部超声检查和胸部X 线检查。当怀疑肿瘤复发时,进行计算机断层扫描或/和磁共振成像扫描以确认诊断。总生存期定义为手术日期与患者死亡日期或最后1 次随访日期间的时间间隔。无瘤生存期定义为从手术日期到肿瘤复发日期的时间,如果没有证据表明肿瘤复发,则在最后1 次随访或死亡时进行检查。随访时间截止至2020年1月,共5 例患者失访,在生存曲线上表示为截断值。
1.3.2 miR-574-5p 表达与临床病理因素及预后的关系采 用 X-tile3.6.1(Yale University School of Medicine,USA)软件,并基于Kaplan-Meier 法及Log-rank 检验确立最佳截断值3.25,将130 例患者癌组织分成miR-574-5p 高表达组(n=66)和miR-574-5p 低表达组(n=64),分析miR-574-5p 高低表达组与临床病理因素及预后的关系。
1.3.3 qRT-PCR 测定使用Total RNA mini 试剂盒(Qiagen,美国)从HCC 组织和细胞系中提取总RNA。用Nanodrop 分光光度法测定总RNA 浓度和纯度。使用高容量cDNA 逆转录试剂盒(美国Applied Biosystems 公司)将RNA 反转录为cDNA。根据制造商的说明,使用定量RT-PCR 检测试剂盒(美国GeneCopoeia)进行定量PCR。U6 用作miR-574-5p 检测的内参。PCR 引物序列如下:miR-574-5p 序列:正链:5'-TGC GGC AAC ACC AGT CGA TGG-3',反链:5'-CCA GTG CAG GGT CCG AGG T-3'。U6 序列:正链:5'-GCT TCG GCA GCA CAT ATA AAA AAA T-3',反链:5'-CGC TTC ACG AAT TTG CGT GTC AT-3'。所有实验均重复3 次。
1.3.4 双荧光素酶报告基因检测将野生型FOG2 3'-UTR 和突变型FOG2 3'-UTR 插入PmirGLO 质粒中。将pmirGLO-FOG2-wt/pmirGLO-FOG2-mut 和miR-574-5p 模拟物/siRNA 阴性对照共转染到HepG2 细胞系中。转染后24 h,应用双荧光素酶报告基因检测系统(Promega,美国)检测荧光素酶活性。所有实验均重复3 次。
1.3.5 FOG2 蛋白表达及与miR-574-5p 的相关性通过Western blot 测定HCC 癌及癌旁组织中FOG2 蛋白表达水平。从上述癌组织中提取总蛋白并定量,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离蛋白质,并转移到PVDF 膜上。与FOG2 一抗(1∶300,美国Santa 公司)在4 ℃孵育过夜后,用辣根过氧化物酶偶联的驴抗山羊二抗(1∶500,美国Santa 公司)与PVDF 膜在37 ℃下孵育2 h。GAPDH 作内参,最后,使用凝胶成像系统定量分析蛋白质相对表达量。分析130 例癌组织中FOG2 蛋白表达与miR-574-5p 的相关性。
1.4 统计学处理
所有统计分析均使用SPSS 19.0 统计软件包(SPSS,Chicago,IL)进行,符合正态分布的计量资料采用均数±标准差(±s)表示,两组间均数比较采用t检验,χ2检验用于研究miR-574-5p 的表达与临床病理因素的关系,Kaplan-Meier 法绘制生存曲线,Log-rank 检验进行比较。Cox 比例风险回归模型用于单因素和多因素分析,Pearson 相关用于分析miR-574-5p 与FOG2 表达的相关性。P<0.05 为差异有统计学意义。
2 结果
2.1 miR-574-5p在HCC癌组织及细胞系中的表达
qRT-PCR 检测结果显示,miR-574-5p 在癌组织中的表达水平高于癌旁组织[(3.89±1.80)vs.(1.13±0.62),P<0.05](图1A)。 HCC 细胞系HepG2 及MHCC-97H 中miR-574-5p 表达量高于正常肝细胞系L-02[HepG2vs.L-02:(4.04±0.47)vs.(1.06±0.31),P<0.05;MHCC-97Hvs.L-02:(4.33±0.44)vs.(1.06±0.31),P<0.05](图1B)。
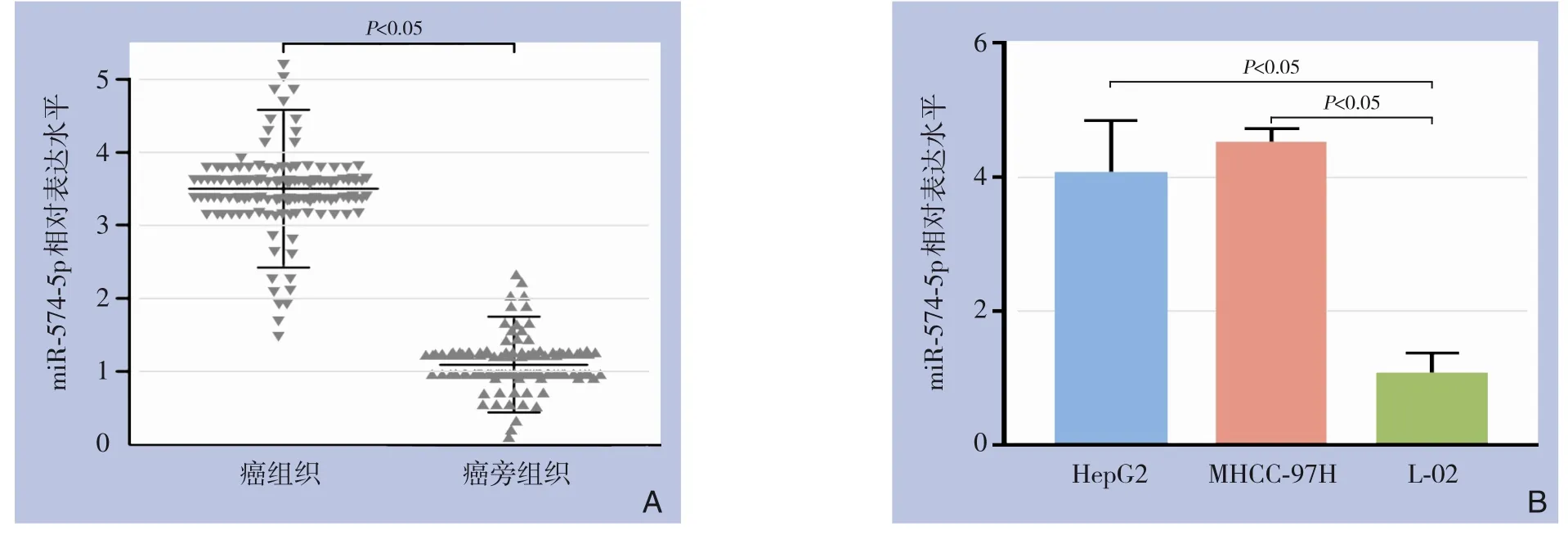
图1 组织及细胞系中miR-574-5p 表达水平的比较A:miR-574-5p在HCC癌及癌旁组织中的表达比较;B:miR-574-5p在HCC细胞系及正常肝细胞系中的表达比较Figure 1 Comparison of the expression level of miR-574-5p in HCC tissues and cell linesA:Comparison of the expression of miR-574-5p in HCC and adjacent tissues;B:The expression of miR-574-5p in HCC cell lines and normal liver cell line
2.2 miR-574-5p表达水平与患者临床病理因数的关系
X-tile 软件确立miR-574-5p 表达量的最佳截断值3.25,据此将130 例患者癌组织分成miR-574-5p高表达组(66 例)和miR-574-5p 低表达组(64 例)。分析结果显示,miR-574-5p 表达与年龄、性别、AFP 浓度、肿瘤数目无明显关系(均P>0.05),miR-574-5p 表达与TNM 分期(P=0.002)和分化程度(P=0.000)有关(表1)。
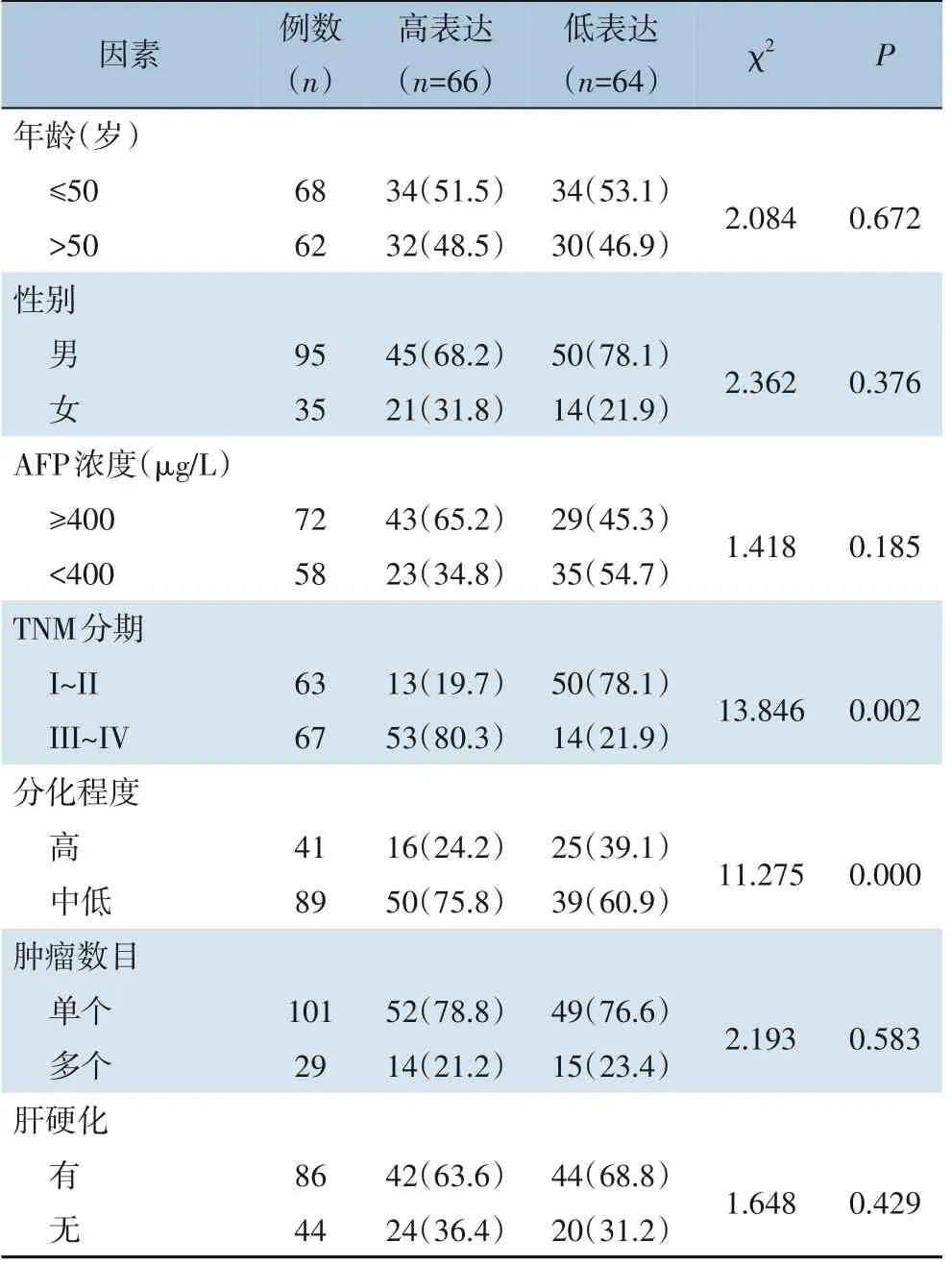
表1 miR-574-5p的表达和临床病理因数的关系[n(%)]Table 1 The relationship between the expression of miR-574-5p and clinicopathologic parameters[n(%)]
2.3 miR-574-5p 表达水平与HCC 患者总生存率及无瘤生存率的关系
Kaplan-Meier 生存曲线表明,miR-574-5p 高表达组1年总生存率为64.1%,3年总生存率为45.9%,5年总生存率为21.8%,miR-574-5p 低表达组1年总生存率为100%,3年总生存率为80.2%,5年总生存率为60.7%,miR-574-5p 高表达组总生存率低于miR-574-5p 低表达组(χ2=11.85,P<0.01);miR-574-5p 高表达组1年无瘤生存率为60.2%,3年无瘤生存率为41.5%,5年无瘤生存率为12.7%,miR-574-5p 低表达组1年无瘤生存率为90.3%,3年无瘤生存率为75.4%,5年无瘤生存率为56.1%,miR-574-5p 高表达组无瘤生存率低于miR-574-5p 低表达组(χ2=10.36,P<0.01)(图2A-B)。
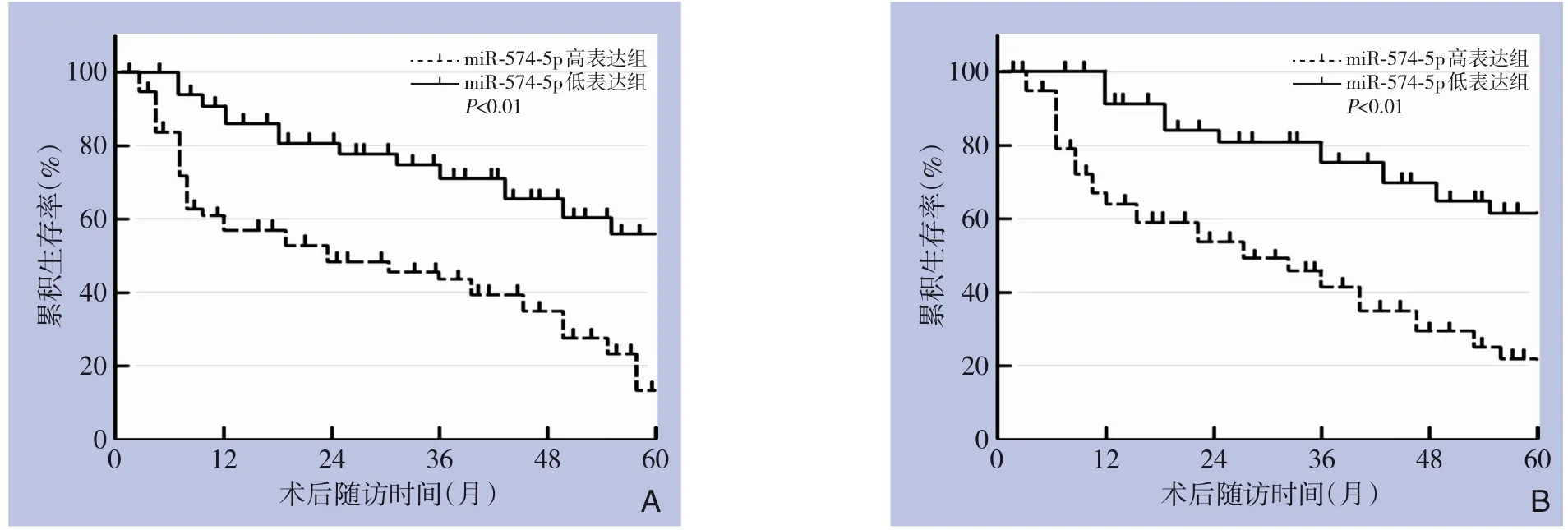
图2 miR-574-5p的表达与HCC患者预后的关系A:总生存曲线;B:无瘤生存曲线Figure 2 The relationship between the expression of miR-574-5p and the prognosis of HCC patientsA:Overall survival curve;B:Tumor-free survival curve
2.4 HCC预后的影响因素分析
Cox 回归单因素分析显示,III~IV 期、中低分化及miR-574-5p 高表达为影响HCC 总生存率的因素(均P<0.05),III~IV 期及miR-574-5p 高表达为影响无瘤生存率的因素(均P<0.05)(表2)。Cox 回归多因素分析显示,miR-574-5p 高表达、III~IV 期及中低分化程是影响HCC 患者总生存率的独立危险因素(均P<0.05),III~IV 期及miR-574-5p 高表达是影响HCC 患者无瘤生存率的独立危险因素(均P<0.05)(表3)。
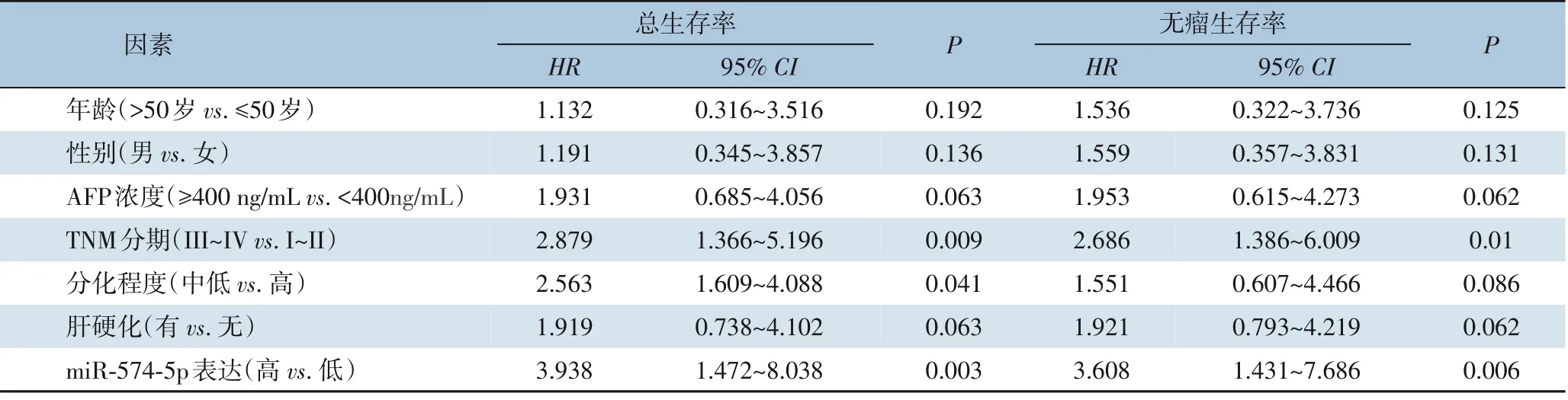
表2 影响HCC预后的单因素分析Table 2 Univariate analysis of factors for the prognosis of HCC
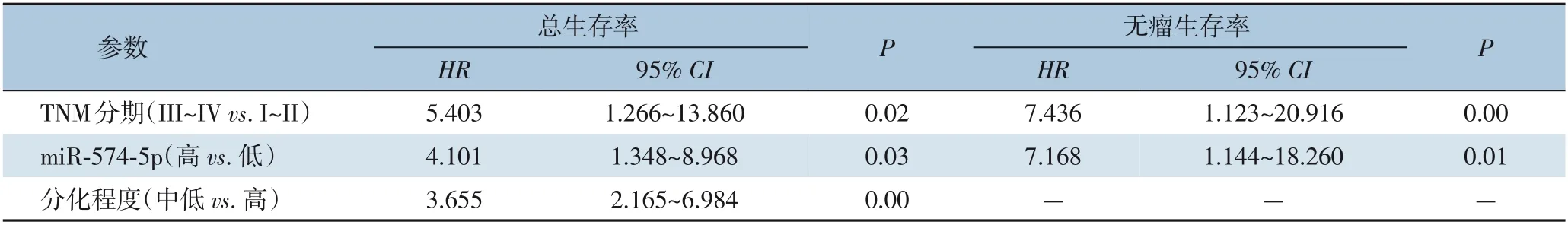
表3 影响HCC预后的多因素分析Table 3 Multivariate analysis of factors for the prognosis of HCC
2.5 miR-574-5p靶基因分析
TargetScan 软件发现FOG2 存在和miR-574-5p 直接结合靶点(图3A)。双萤光素酶报告基因实验表明,与FOG2-WT-3'-UTR 野生型质粒和miR-574-5p模拟物共转染的萤光素酶活性明显降低(P<0.05)。但FOG2-MUT-3'-UTR 和miR-574-5p 模拟物共转染后,荧光素酶活性没有变化无统计学意义(P>0.05)(图3B)。上述结果表明FOG2 是miR-574-5p的直接靶基因。
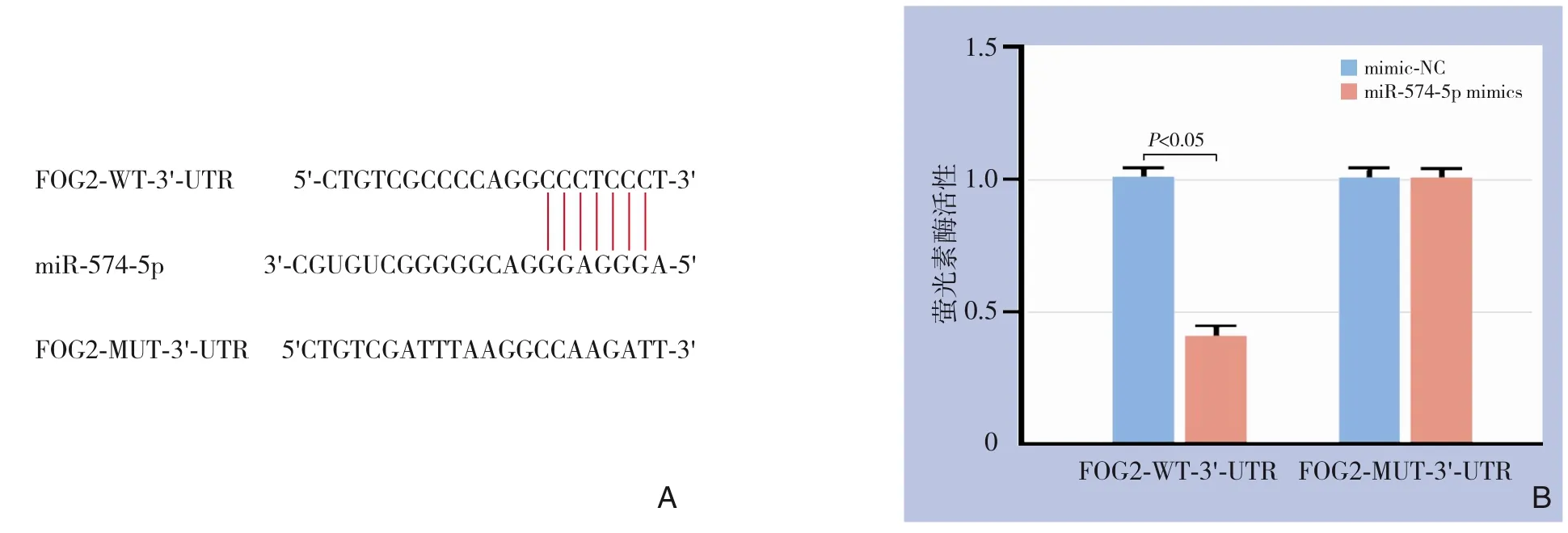
图3 miR-574-5p的靶基因分析A:FOG2与miR-574-5p存在结合靶点;B:双萤光素酶实验验证FOG2是miR-574-5p的靶标Figure 3 Analysis of the target genes of miR-574-5pA:Binding site between FOG2 and miR-574-5p; B:Dual luciferase assay verifying that FOG2 is the target of miR-574-5p
2.6 FOG2 在HCC 中的表达及其与miR-574-5p 的关系
Western blot 结果显示,FOG2 在癌中的表达量低于癌旁组织(图4A);Pearson 相关分析示,HCC癌组织中miR-574-5p 与FOG2 蛋白表达呈明显负相关(r=-0.499,P<0.05)(图4B)。
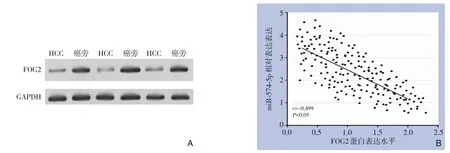
图4 FOG2的表达及其与miR-574-5p表达的关系A:Western blot检测FOG2在HCC及癌旁组织中的表达;B:FOG2表达与miR-574-5p的相关性分析Figure 4 FOG2 expression and its relation with miR-574-5p expressionA:Western blot experiment shows the expression of FOG2 in cancer and adjacent tissues;B:Correlation analysis of FOG2 expression and miR-574-5p
3 讨论
HCC 是常见的恶性肿瘤之一,HCC 发生的主要危险因素是HBV 慢性持续感染,HCC 在亚太地区,尤其是中国,发病率较高[13-14]。2018年11月国家癌症中心发布最新数据表明,我国癌谱构成中,虽然肝癌病死率趋势略有下降,但其发病率仍高居恶性肿瘤的第4 位,肿瘤相关死亡位居第2 位[14-16]。肝癌的主要治疗方法为手术切除、放化疗及分子靶向治疗。近年来,尽管放化疗、栓塞治疗和免疫治疗取得了长足进步,但鉴于转移和复发,HCC 患者预后仍较差[17-19]。阐述HCC 发生和发展的分子机制对于深入探寻HCC 的发生机制和开发新的治疗靶点具有重要的意义。
miRNA 是短链(18~22 个核苷酸)非蛋白质编码RNA 分子,可通过结合靶基因mRNA 来调控基因表达,依据靶基因的功能,参与细胞生物学功能,调节细胞周期、凋亡、增殖、侵袭及转移等过程,发挥癌基因或抑癌基因的功能而参与肿瘤的发生或进展[20-21]。miR-574-5p 最先在非小细胞肺癌中被鉴定,研究[22]发现miR-574-5p 在非小细胞肺癌患者血浆中表达水平增加,可作为非小细胞肺癌诊断标志物。后续文献报道在乳腺癌[23]中其可通过miR-574-5p-ZEB1 轴调控乳腺癌的发生和进展。在甲状腺癌中发现miR-574-5p 高表达可通过Wnt/β-catenin 信号途径而调节癌细胞的细胞周期和凋亡[24]。本研究首先检测130 例HCC 癌组织和癌旁组织中miR-574-5p 表达水平,结果显示HCC 癌组织中miR-574-5p 表达水平显著高于癌旁组织。同时与正常肝细胞系(L-02)相比,肝癌细胞系(HepG2 和MHCC-97H)中miR-574-5p 表达水平显著增加,上述研究结果显示在HCC 癌组织和细胞系中,miR-574-5p 表达水平上调。
本研究将HCC 患者分为miR-574-5p 高、低表达两组,发现miR-574-5p 高表达组患者存在较高的TNM 分期(III~IV)和中低分化程度,表明miR-574-5p 高表达与HCC 患者恶性程度密切相关,提示miR-574-5p 高表达可能促进HCC 的恶性进展。文献[25]报道在结直肠癌中,长链非编码RNA MFI2-AS1 可调节miR-574-5p/MYCBP 轴而促进结直肠癌细胞增殖、迁移和侵袭,其中miR-574-5p 呈高表达且与结直肠癌TNM 分期密切相关,这与本研究结果类似。本研究通过比较miR-574-5p 高低表达两组患者随访期间无瘤生存率和总生存率,显示miR-574-5p 低表达组患者的无瘤生存率和总生存率均优于miR-574-5p 高表达组患者,Cox 比例风险模型发现miR-574-5p 高表达是预测肝癌患者无瘤生存率和总生存率的独立危险因素,上述研究结果显示miR-574-5p 高表达是HCC 患者预后的分子标志物。
FOG2 是转录因子GATA 家族的共调节因子,其在人体组织中的脑、心脏、肝脏、肺、睾丸和骨骼肌等各种组织中广泛表达,FOG2 生理功能多样化。研究显示其在冠状血管发育、心脏形态、胰岛素信号通路调节和脂质代谢中发挥不同的调节作用[26-27]。最近研究[28]表明,FOG2 可能是PI3K/Akt 信号通路的新型抑制剂。文献[29]研究显示在人肝星状细胞中,miR-200c 通过靶向FOG2/PI3K 信号通路加速促进肝星状细胞诱导的肝纤维化。文献[30]报道在HCC 细胞系中,沉默FOG2 表达可促进HCC 细胞增殖和侵袭。本研究进一步研究miR-574-5p 潜在的作用机制,双荧光素报告基因实验显示FOG2 是miR-574-5p 的直接靶基因。同时在HCC 癌组织中FOG2 表达水平与miR-574-5p 表达水平呈负相关,上述研究结果进一步证实了miR-574-5p 和FOG2 存在重要的调节关系,miR-574-5p 高表达的HCC 患者预后差的机制可能与下调FOG2 表达,而促进肝癌细胞增殖和侵袭有关。
由于本研究仅探讨了miR-574-5p 在HCC 癌组织中的表达及与预后的关系,miR-574-5p 与FOG2的靶向相关关系,尚存在一定的不足。首先,miR-574-5p 在HCC 细胞系中的功能如何,对细胞增殖、凋亡、侵袭及转移的影响尚不得而知;其次,miR-574-5p 在裸鼠动物模型中的功能也值得进一步探讨,也是本研究后期的研究方向。
综上,HCC 组织和细胞系中miR-574-5p 表达水平上调,miR-574-5p 是HCC 不良预后的分子标志物,miR-574-5p 可通过靶向FOG2 而参与HCC 的发生和进展,是HCC 潜在治疗和预后的靶向标志物。
