Aurora-B诱导着丝粒蛋白U磷酸化促进胆管癌细胞增殖的作用研究
2021-09-09段小辉申瑶黄靖波刘亚晖毛先海
段小辉,申瑶,黄靖波,刘亚晖,毛先海
(1.湖南省人民医院/湖南师范大学附属第一医院肝胆外科/肝胆肿瘤研究室,湖南长沙410005;2.湖南省胆道疾病防治临床医学研究中心,湖南长沙410005)
胆管癌的发病率约占消化系统的3%,是肝胆癌中第二常见的恶性肿瘤[1-2]。目前,手术切除是胆管癌的主要治疗策略[3]。然而,胆管癌的术后复发率很高,5年生存率不到5%。因此,探索胆管癌发生发展的分子机制,为胆管癌的治疗提供药物靶点对于胆管癌的防治研究有重要的临床意义。Aurora 激酶是一类高度保守的丝氨酸/苏氨酸激酶,由Aurora-A、Aurora-B 和Aurora-C 3 个亚型组成。Aurora 激酶参与细胞中心体的成熟和分离、纺锤体的组装和稳定性、染色体浓度和中板聚集等[4-5]。在哺乳动物中,Aurora-B 与INCENP、survivin 和borealin 等其他3 种染色体乘客蛋白形成四聚体,在有丝分裂着丝粒和微管的正确定位中起重要作用[6]。大量研究[7-10]表明,Aurora 激酶的突变增加了基因组的不稳定性,其过度表达和异常活性可导致纺锤体缺陷和染色体分离异常,导致细胞的非整倍体,从而导致细胞的恶性转化。在过去的几十年中,研究表明Aurora-B 与肿瘤的发生发展和转移有关,并且已经成为一个重要的抗肿瘤靶点。尽管Aurora-B 在胆管癌中的异常表达已被证实[11],但Aurora-B 对胆管癌的调控作用至今未见报道。
着丝粒蛋白U(CENPU)是着丝粒相关网络重要组成部分,研究证实CENPU 在有丝分裂的染色体分离过程中发挥了重要的作用,CENPU 已被鉴定为Aurora-B 诱导的磷酸化作用的底物之一[12]。本课题组在前期胆管癌中筛选出CENPU 的基础上,通过临床病理标本检测首次发现CENPU 在胆管癌中表达水平明显高于其相应的癌旁组织,采用siRNA 技术将胆管癌QBC939 细胞CENPU 敲减,初步结果显示胆管癌细胞增殖受到抑制,提示CENPU 可能为胆管癌发生发展的相关基因[13]。因此,结合胆管癌中Aurora-B 异常表达以及其可诱导CENPU 磷酸化,推测Aurora-B 可能通过CENPU 的磷酸化来调控胆管癌的发生。
1 材料与方法
1.1 免疫组化染色
用免疫组化法检测Aurora-B 激酶、CENPU 蛋白以及磷酸化CENPU(p-CENPU)蛋白的表达。收集10 例胆管癌患者的肿瘤组织和配对的正常癌旁组织,所有参与的胆管癌患者均提供书面知情同意书。所有标本在65 ℃的烤箱中烘烤30 min,然后将载玻片在二甲苯中脱蜡30 min,并在100% 至75%乙醇中再水合。将玻片样本架放入含1×乙二胺四乙酸的修复缸中100 ℃煮沸30 min,室温冷却,然后用3%H2O2封闭5 min,再用5%血清封闭15 min。Aurora-B(1∶100,Affinity,Cat#AF5361),CENPU(1∶50,Affinity,Cat#DF2320),p-CENPU(1∶50,Abcam,Cat#ab117078)抗体孵育4 ℃过夜,然后加入相应的二抗染色。玻片在黑暗中用DAB 染色5 min,苏木精复染,使用中性树胶进行封片。玻片在显微镜下观察并拍摄图像。IHC 评分采用阳性细胞评分和染色强度评分总和。阳性细胞评分分为4 级:1 级(1%~24%),2 级(25%~49%),3 级(50%~74%),4 级(75%~100%)。染色强度从0 分(无信号色)到3 分(浅黄色、棕色和深棕色)。
1.2 细胞培养
胆管癌细胞系QBC939 细胞购买于ATCC,并培养于含10%FBS(GIBCO,Cat#10091-148)和青霉素链霉素(100×)(GIBCO,Cat#15140122)的DMEM(GIBCO,Cat#1868985)培养液中,置于含5%CO2和湿度为70%~80% 的培养箱中(三洋,Cat#MCO-175),培养温度为37 ℃。培养基每3 天更换1 次。
1.3 慢病毒载体构建及细胞转染
Aurora-B 的shRNA 靶序列由上海懿贝瑞生物科技有限公司设计,用限制性内切酶Age I 和EcoR I(Cat#R3552L 和R3101L,NEB)线性化LV-013 载体,并与设计序列连接。将连接产物转化到大肠杆菌受体细胞中,用PCR 方法筛选阳性克隆。用EndoFree midi 质 粒 试 剂 盒(Cat #DP118-2,TIANGEN)提取高纯度质粒。构建CENPU 磷酸化位点(苏氨酸78)失活突变慢病毒载体。将突变和非突变CENPU 克隆到表达载体LV-013 中(LV-013 载体元件包含:pCDH-CMV-MCS-3FLAG-EF1-copGFP-T2A-Puro),根据PCR 测序结果构建重组表达载体LV-013-CENPU。在6 孔板中培养QBC939 细胞,直到细胞融合达到80%,使用Lipofectamine 2000(Thermo Fisher Scientific)将质粒转染到细胞中。培养72 h 后,在倒置荧光显微镜下观察GFP绿色荧光表达情况,并计算转染效率,转染效率=绿色荧光蛋白(GFP)阳性细胞数/总细胞数×100%。
1.4 qRT-PCR
收集细胞并以2 000r/min 离心5 min,去除上清液,向细胞沉淀中添加1 mL TRIzol(Sigma),并根据TRIzol 的说明提取总RNA。将RNA 沉淀溶解在无RNase 酶的水中,并使用Nanodrop100 分光光度计(Thermo,America)分析和测定提取RNA 的浓度和质量。根据hiscript QRT-super-mix(Vazyme)的说明书将RNA 逆转录合成cDNA。按照SYBR-Green-mastermixs 试剂盒的要求制备qRT-PCR 反应体系,绘制熔融曲线。以GAPDH 为内参照,计算基因表达量,2-ΔΔCt代表各靶基因的相对表达。每个实验至少重复3 次。PCR 反应条件为:95 ℃预变性1 min,94 ℃变性10 s,60 ℃退火30 s,55 ℃解离1 min。Aurora-B 引物的上游序列:5'-TGG CTC GGG AGA AGA AA-3',下游序列: 5'-CGC AGG ATG TTG GGA TG-3'。
1.5 Western blot
细胞中加入细胞裂解液,置于4 ℃冰上至细胞完全溶解。细胞裂解样品在12 000r/min 下离心10 min。提取总蛋白加入1×SDS 上样缓冲液。蛋白质(20 μg/lane)经10%SDS-PAGE 分离后转移到PVDF 膜上。用封闭液含5%脱脂牛奶的1×TBST 溶液,置于室温摇床。然后去除液体,添加抗体,包括CENPU(1∶1 000,Affinity,Cat.#DF2320)、p-CENPU(1∶1 000,Abcam,Cat.#ab117078)以及GAPDH(1∶3 000,Bioworld,Cat.#AP0063),在4℃冰箱孵育过夜。用1×TBST 清洗3 次,用Goat Anti-Rabbit 二抗(1∶3 000,Beyotime,Cat.#A0208)4 ℃孵育4 h。最后洗膜3 次,用Immobilon Western Chemiluminescent HRP Substrote 试剂盒显色,得到蛋白条带,拍摄照片。
1.6 CCK8实验
CCK8 法检测QBC939 细胞增殖活性。在96 孔板上接种细胞,每孔2 000 个,孵育72 h。每孔加入10 μL 1×10 比例Kit-8 溶液,再孵育4 h。在0、6、12、24、48 h 候用酶标仪测定450 nm 波长处的吸光度值,计算细胞存活率。
1.7 统计学处理
细胞实验数据取自至少3 次独立的重复实验,数据以平均数±标准差(±s)表示。用SPSS 20.0和GraphPad-Prism 软件7.0 进行统计分析。t检验比较差异,P<0.05 为差异有统计学意义。。
2 结果
2.1 Aurora-B和CENPU在胆管癌中的表达
为了初步探讨Aurora-B 和CENPU 在胆管癌中的作用,首先采用免疫组化方法检测了它们在胆管癌及癌旁组织中的表达。结果显示,Aurora-B 和CENPU 在胆管癌组织中均有表达,阳性率分别为22.61%和12.34%,而在癌旁组织中几乎没有表达(图1)。从TCGA 数据库[14]收集的数据也表明了胆管癌中Aurora-B 和CENPU 的上调(图2A-B)。此外,相关性分析显示,在胆管癌中,Aurora-B 和CENPU 的表达水平呈正相关(r=0.7322,P<0.05)(图2C)。进一步的免疫组化分析表明,与癌旁组织比较,胆管癌肿瘤组织中p-CENPU 表达上调,提示Aurora-B 与CENPU 磷酸化之间存在潜在的联系。
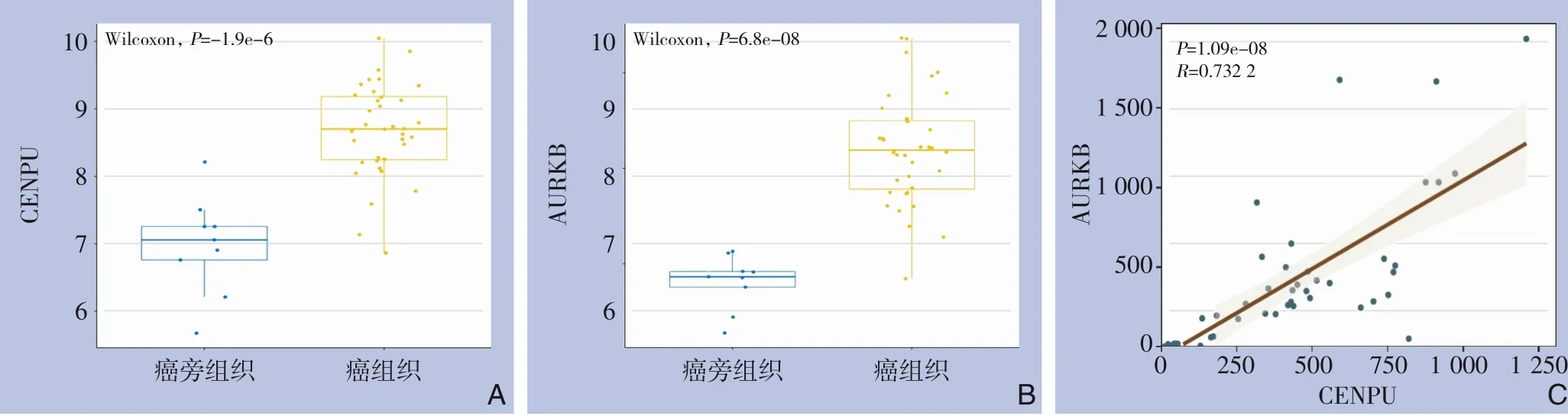
图2 TCGA数据库中分析A-B:Aurora-B(AURKB)与CENPU在胆管癌组织中的表达高于癌旁正常组织;C:胆管癌组织中CENPU与Aurora-B的表达呈正相关Figure 2 TCGA database analysisA-B:Higher expressions of Aurora-B(AURKB)and CENPU in cholangiocarcinoma tissue than normal adjacent tissue;C:A positive correlation between CENPU and Aurora-B expressions in cholangiocarcinoma
2.2 Aurora-B敲减对胆管癌细胞增殖和CENPU磷酸化的影响
为了验证Aurora-B 在胆管癌中的作用及其机制,采用转染表达靶向Aurora-B 的shRNA 的慢病毒载体构建了Aurora-B 基因敲减的胆管癌QBC939 细胞模型。首先采用qPCR 评估了3 个靶向Aurora-B的shRNA 对Aurora-B 的敲减效率,其结果显示shAurora-B-2 的效果最佳。因此,后续实验全部采用shAurora-B-2(简写为shAurora-B 组)进行细胞构建(图3A)。细胞增殖实验的结果显示,敲减Aurora-B 的表达可明显抑制QBC939 细胞的增殖率(图3B)。 此外,Western blot 的结果显示,shAurora-B 组中CENPU 的磷酸化水平明显低于转染阴性shRNA 序列对照组(图3C)。这些结果证明Aurora-B 不仅对胆管癌的细胞增殖具有调控作用,同时这一作用可能与诱导胆管癌中CENPU 的磷酸化有关。
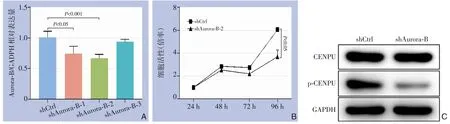
图3 QBC939 细胞Aurora-B 敲减实验A:qRT-PCR 检测3 个shRNA 的敲除效率;B:CCK8 法检测Aurora-B 基因敲减对QBC939细胞增殖的影响;C:Western blot法检测Aurora-B基因敲减对QBC939细胞CENPU和p-CENPU表达的影响Figure 3 Experiment of Aurora-B knockdown in QBC939 cellsA:The knockdown efficiencies of 3 shRNAs evaluated by qRT-PCR;B:Influence of Aurora-B knockdown on proliferation of QBC939 cells detected by CCK8 assay;C:Influence of Au-rora-B knockdown on expressions of CENPU and p-CENPU of QBC939 cells determined by Western blot analysis
2.3 CENPU 磷酸化位点变异对胆管癌细胞增殖和CENPU磷酸化的影响
为了揭示Aurora-B 诱导的CENPU 磷酸化在胆管癌细胞增殖中的调控作用,进一步构建了CENPU 磷酸化位点(Thr78)突变体,并用相应的慢病毒载体转染QBC939 细胞,同时以CENPU 野生型QBC939 细胞作为阴性对照。通过观察慢病毒载体上GFP 绿色荧光蛋白的表达情况,计算并确认对照组(空载慢病毒)、CENPU-WT(野生型)和CENPU-MUT(磷酸化位点突变体)在QBC939 细胞中的转染效率(图4A)。结果显示,CENPU 的磷酸化缺陷减弱了Aurora-B 诱导的CENPU 磷酸化,其具有与Aurora-B 抑制剂相似的作用,但Aurora-B 抑制剂能明显抑制Aurora-B 的表达,CENPU 磷酸化位点突变对Aurora-B 的表达无影响(图4B)。CCK8 的结果显示,转染CENPU-WT 的细胞显示出增强的增殖活性,这一作用能够被CENPU 磷酸化缺陷所抑制(P<0.05)(图4C)。以上结果均表明CENPU 磷酸化在胆管癌增殖中起关键作用。
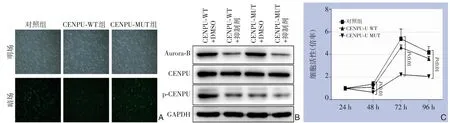
图4 QBC939 细胞CENPU 磷酸化位点突变与Aurora-B 抑制剂作用实验A:荧光成像技术检测对照组、CENPU-WT 组和CENPU-MUT 组慢病毒转染效率(×200);B:DMSO 或Aurora-B 抑制剂处理后,在有或无CENPU 磷酸化位点突变的QBC939 细胞中Aurora-B、CENPU 和p-CENPU 的表达;C:CCK8 检测有或无CENPU 磷酸化位点突变的QBC939 细胞的增殖Figure 4 Experiments of phosphorylation site mutation of CENPU and Aurora-B inhibitor treatment in QBC939 cells A:Fluorescence imaging assessment of the lentivirus transfection efficiencies in control,CENPU-WT and CENPU-MUT groups(×200); B:The expressions of Aurora-B,CENPU and p-CENPU in QBC939 cells with or without phosphorylation site mutation of CENPU treated with DMSO or Aurora-B inhibitor; C:CCK8 assay for proliferation abilities of QBC939 cells with or without phosphorylation site mutation of CENPU
3 讨论
Aurora-B 是Aurora 激酶家族的3 个成员之一。其位于细胞核中央,属于功能性激酶,参与有丝分裂的调控。近年来,Aurora 激酶家族在肿瘤发生发展中的作用越来越受到人们的关注。许多研究发现,Aurora-B 在多种的人类癌症中都有表达升高的现象,这显示出其与恶性肿瘤的发生发展的潜在相关性。例如,Shen 等[11]研究了有丝分裂调节蛋白(包括Aurora 激酶、survivin 和p53)在胆管癌中的表达和生物学功能。他们的研究成果显示37.8%的肝内胆管癌患者的癌细胞内存在着Aurora-B 的过度表达,同时Aurora-B 的表达与肿瘤分级之间存在着统计学正相关的关系。 Al-Khafaji 等[15]认为Aurora-B 的活性是非小细胞肺癌细胞对紫杉醇的敏感性的一个重要表征指标和调节剂。Ding 等的研究[16]揭示了CREPT/RPRD1B 和Aurora-B 之间的相互作用,其结果说明Aurora-B 能够促进胃癌细胞的G2/M 周期转换,进而促进胃癌的进展。Nie 等[7]还发现Aurora-B 在胃癌中具有类似于癌基因的功能,其能够通过激活细胞周期相关蛋白cyclin D1 的表达发挥肿瘤启动子的作用。另一方面,越来越多的研究表明,Aurora-B 诱导的磷酸化在人类癌症的发展和进展中起着关键作用。一项最新研究表明,Aurora-B 可以通过直接诱导MYC 的磷酸化稳定其表达,从而与myc 形成一个调节回路,促进T 细胞白血病的发生[17]。Xu 等[18]认为Aurora-B 诱导的Ser27位点的H1.4 磷酸化在胃癌的发生发展中起到了重要的作用,而这一功能可被Ras-ERK1/2 信号通路抑制。尽管已经有前期的研究显示了Aurora-B 在胆管癌中的异常表达[13,19],但其在胆管癌发生发展中的具体作用仍不清楚。
2006年,Mellone 等[20-21]首次发现了CENPU,其又被称为KL1P1、PBIP1 或CENPU/50。其后的研究显示,CENPU 对正常细胞来说不是必需的,但在纺锤体损伤恢复的情况下,对于黏附和防止姐妹染色单体分离是必需的[22-24]。此外,近年来研究人员还发现了CENPU 在多种人类癌症中的重要作用,包括卵巢癌[25]、非小细胞肺癌[26-27]、膀胱癌[28]、三阴性乳腺癌[29]、肺腺癌[22]和肝细胞癌[30]。
在本研究中发现,与癌旁组织相比,Aurora-B和CENPU 在胆管癌组织中的表达水平均有上调的趋势。敲低胆管癌细胞中Aurora-B 的表达水平可显著抑制胆管癌细胞CENPU 的磷酸化。研究显示CENPU 与Aurora-B 激酶均可影响着丝粒与微管的连接,其中CENP-U 通过与Hec1 交互作用调控染色体着丝粒与微管的连接[12],而Aurora-B 激酶负责修正着丝粒与微管的错误结合[31];CENPU 与Aurora-B 激酶的过表达均能使染色体滞后于分裂中期,导致染色体分离错误,引起基因的不稳定性以及非整倍体细胞数目的增加,直至发生癌变[32]。最近Hua等[12]通过体外激酶实验证实CENP-U 上存在有丝分裂调节蛋白Aurora-B 激酶的磷酸化位点Ser349和Ser350。本研究结果证实胆管癌细胞中Aurora-B 激酶可以调控CENPU 磷酸化,初步的机制研究表明Aurora-B 对胆管癌细胞增殖水平的调控作用可能是通过其对CENPU 的磷酸化作用来实现的,当CENPU 的磷酸化位点发生突变时这一调控作用也受到了抑制。
综上所述,本研究证实了Aurora-B 对胆管癌细胞增殖水平的促进作用,并且显示这一作用可能是通过对CENPU 的磷酸化修饰来进行的。因此,本项研究针对Aurora-B 调控胆管癌进展的作用进行了功能层面的验证以及机制层面的研究,为胆管癌的分子机制研究以及靶向药物研究提供了理论依据以及潜在的分子靶点。
