白介素1β对大鼠软骨细胞炎症因子和ECM降解蛋白的影响
2021-09-09高利贾丽娜马天文王新宇吕良钰于跃赵明超刘琳陈鸿
高利,贾丽娜,马天文,王新宇,吕良钰,于跃,赵明超,刘琳,陈鸿
(东北农业大学动物医学学院,黑龙江省动物疾病发生机制与比较医学重点实验室,哈尔滨 150030)
骨关节炎(Osteoarthritis,OA)是一种普遍发生于动物关节的慢性炎症性疾病,病理表现为关节软骨进行性退化,软骨细胞外基质(Extracellular matrix,ECM)合成和降解平衡被打破,软骨下硬化,骨赘形成等一系列变化。临床症状主要表现为关节疼痛,肌肉萎缩,跛行以及功能障碍等,该病发生机制尚不清楚。疾病早期,传统影像学检查变化不明显,此时关节软骨ECM已发生降解,代谢产物出现变化,例如硫酸软骨素846(Chondroitin sulfate 846,CS846)和软骨寡聚基质蛋白(Cartilage oligomertic matrix protein,COMP)等。因此,寻找一种准确、便捷的手段确诊早期OA至关重要。
研究表明,促炎细胞因子白介素1β(IL-1β)在OA发病机制中尤为重要,常用于体外试验中模拟其病理环境[1-3]。基质金属蛋白酶-血小板反应蛋白基序(Recombinant a disintegrin and metalloprotein⁃ase with thrombospondin,ADAMTS)为调节关节软骨细胞ECM的主要蛋白水解酶,ADAMTS-4分泌增多显示出对蛋白多糖合成具有显著破坏作用。COX-2为合成前列腺素关键酶,在OA软骨中环氧合酶(Cyclooxygenase-2,COX-2)显著表达,在关节破坏中起重要作用[4],通过促进前列腺素E2(Prostaglandin E2,PGE2)合成参与炎症反应,COX-2表达不仅影响正常细胞功能,还促进炎性细胞因子诱导蛋白多糖代谢失衡和OA发生[5]。成熟软骨中只有一种细胞类型即软骨细胞,在正常生理条件下可分泌以Ⅱ型胶原、蛋白多糖为主要成分的ECM,使整体关节具有稳定、固化和抗压等功能。蛋白多糖覆盖在Ⅱ型胶原表面,保护Ⅱ型胶原结构完整和稳定。研究表明,ECM发生降解时,蛋白多糖降解早于Ⅱ型胶原[6-7]。CS为蛋白多糖主要成分之一,CS846可作为ECM中蛋白多糖降解的生物标志物。COMP为凝血栓蛋白家族中一种以分泌型五聚体形式存在的非胶原糖蛋白,发挥结合II型胶原纤维和稳定纤维网络或促进纤维原形成作用。
近期研究发现,由分子介导的基质降解反应主要涉及的酶MMPs和ADAMTSs在OA患者软骨细胞中表达上调[8-9]。且Luo等研究发现在大鼠软骨细胞中,10 ng·mL-1IL-1β刺激可显著提高PGE2、COX-2、ADAMTS-5和MMP-13在mRNA及蛋白水平表达[10]。此外,在大鼠体内经碘乙酸钠注射关节腔建立的OA模型中,IL-1β可提高血清中软骨降解产物Ⅰ型胶原交联羧基末端肽(Cross-linked Carboxy-terminal telopeptide of type 1 collagen,CTX-I)、II型胶原交联羧基末端肽(Cross linked C-telopeptide of type 2 collagen,CTXII)和COMP水平,或通过前交叉韧带切除术(Ante⁃rior cruciate ligament transection,ACLT)方法建立大鼠OA模型10周后,与对照组比较,血清中COMP和CS846水平显著增加[11-12]。Frisbie等研究发现与单纯运动关节相比,OA关节滑液CS846和PGE2浓度显著升高[13]。
上述研究中,大多采用单一时间和浓度刺激软骨细胞,未能说明刺激时间或浓度不同对炎症因子和软骨降解蛋白的影响。本试验采用10 ng·mL-1IL-1β体外培养大鼠软骨细胞,分析IL-1β刺激0、12、24和48 h后对炎症因子COX-2和PGE2、软骨降解酶ADAMTS-4以及ECM降解蛋白CS846和COMP浓度变化,为深入研究OA发病机制提供基础,也为评估OA病情并制定合理有效治疗方案提供理论依据。
1 材料与方法
1.1 软骨细胞分离与培养
于哈尔滨医科大学动物试验中心(哈尔滨,中国)购买14~21日龄Sprague-Dawley大鼠脱颈处死后,于75%酒精烧杯中,浸泡时间20 min充分消毒。无菌室生物安全柜内获取大鼠软骨组织,加入0.25%胰蛋白酶消化,时间30 min,弃去胰蛋白酶,PBS冲洗3次后剪碎软骨,加入0.2%Ⅱ型胶原酶摇床振荡4 h,加入与0.2%Ⅱ型胶原酶等量的DMEM/F12(含10%FBS和1%青+链霉素)培养液,终止消化。离心7 min后去除上清,获取软骨细胞,将其加入到DMEM/F12培养液(含10%FBS和1%青+链霉素)后转移至细胞培养箱(设定条件:37℃,5%CO2)加湿培养。本试验所用试验动物和试验设计均符合东北农业大学动物试验伦理审查相关规定。
1.2 试验分组
取培养后第2代软骨细胞开展后续试验。为使试验细胞处于同一周期时相,用含0.05%FBS的DMEM/F12培养液饥饿处理并过夜,将其分为对照组和模型组。对照组(10 ng·mL-1IL-1β处理0 h)饥饿处理后直接提取总蛋白和细胞上清液,模型组则分别用10 ng·mL-1IL-1β进行刺激,刺激12、24和48 h后提取总蛋白和细胞上清液,Western Blot方法检测12、24和48 h时软骨细胞ADAMTS-4和COX-2蛋 白 表 达变 化,ELISA方法检测PGE2和细胞上清液中CS846和COMP水平变化。
1.3 软骨细胞鉴定
1.3.1 甲苯胺蓝染色检测蛋白多糖
将原代、1代和2代软骨细胞数目稀释为2×104·mL-1后接种于六孔板中,放入CO2培养箱中继续培养,待细胞铺满每孔面积70%~80%时使用。先将培养液弃去后加入PBS充分冲洗3次,用4%多聚甲醛固定30 min。固定后自来水冲洗15 min。冲洗结束后加入甲苯胺蓝工作液在室温下染色45 min,再次置于蒸馏水中冲洗,中性树脂封片,倒置显微镜观察。
1.3.2 免疫荧光检测Ⅱ型胶原
将2代软骨细胞数目稀释为2×104·mL-1后接种于六孔板中,待细胞铺满每孔面积70%~80%时使用,将培养液弃去后加入PBS充分冲洗3次,加入4%多聚甲醛固定30 min后弃去,PBS充分冲洗3次,使用0.5%Triton X-100通透20 min。加入3% BSA封闭30 min。再加入200µLⅡ型胶原一抗,置于4℃过夜。过夜后加入PBS充分冲洗3次。加入200µL荧光二抗,30 min,37℃避光。然后加入DAPI染剂染细胞核,避光10 min。PBS冲洗3次,加入抗荧光淬灭封片液,在荧光显微镜下观察。
1.4 软骨细胞蛋白提取和浓度测定
各组软骨细胞取出弃去培养液后,加入PBS充分清洗3次,细胞刮刀将贴壁细胞刮下,转入离心管中,在400 RCF离心5 min,弃上清液。加入RI⁃PA与PMSF混合液(99∶1),充分混匀后4℃裂解30 min。12 000 RCF离心5 min,离心后保存上清液。取适量蛋白样本,加入200µL BCA工作液,37℃静置30 min。用多功能酶标仪测定562 nm处OD值,根据标准曲线计算样本浓度。
1.5 IL-1β刺激软骨细胞后ADAMTS-4和COX-2蛋白表达
严格按照SDS-PAGE凝胶配制试剂盒说明书,配置分离胶和浓缩胶。每个孔加10µL蛋白样品进行电泳。浓缩胶80 V,分离胶120 V,电泳50 min。将凝胶、NC膜和滤纸按顺序放置在转膜夹上转膜,转膜结束后将膜取出,转移到含有5%脱脂奶粉中封闭,结束后用TBST溶液漂洗。漂洗后取出膜分别加入GAPDH、ADAMTS-4和COX-2一抗孵育,4℃过夜。使用TBST漂洗3次。漂洗结束后加入至二抗孵育,室温60 min,再次使用TBST进行漂洗3次。最后在膜上滴加ECL显色液后曝光,即可显示目的条带。
1.6 IL-1β刺 激 软 骨 细 胞 后PGE2、COMP和CS846表达
收集10 ng·mL-1IL-1β刺激的软骨细胞0、12、24和48 h后细胞上清液。具体操作步骤严格按照ELISA试剂盒,试剂盒均购自厦门慧嘉生物科技有限公司。每组样本检测设置3个重复孔,OD值取平均值。用ELISA calc根据浓度和OD值算出标准曲线的回归方程,拟合模型选用四参数Logis⁃tic曲线,根据标准曲线计算各组PGE2、CS846和COMP浓度。
1.7 统计学分析
GraphPad Prism 8软件用于统计分析。各组值表示为平均数±标准差(Mean±SD)。组间比较采用单因素方差分析(ANOVA)。P<0.05认为具有统计学意义。
2 结果与分析
2.1 软骨细胞鉴定
2.1.1 甲苯胺蓝染色检测蛋白多糖
在软骨细胞中,甲苯胺蓝可特异性与软骨ECM中具有阳离子的蛋白多糖结合呈蓝色或深蓝色。如图1所示。大鼠原代软骨细胞(见图1A)、1代软骨细胞(见图1B)和2代软骨细胞(见图1C)均被甲苯胺蓝所染色。

图1 大鼠软骨细胞甲苯胺蓝染色图像(×100)Fig.1 Toluidine blue staining image of rat chondrocytes(×100)
2.1.2 免疫荧光检测Ⅱ型胶原
如图2所示,大鼠第2代软骨细胞免疫荧光检测Ⅱ型胶原图像。DAPI将细胞核染成蓝色(见图2A),Ⅱ型胶原被染成绿色(见图2B),图2C表明软骨细胞中Ⅱ型胶原表达较多,也证明大鼠软骨细胞分离和培养成功。
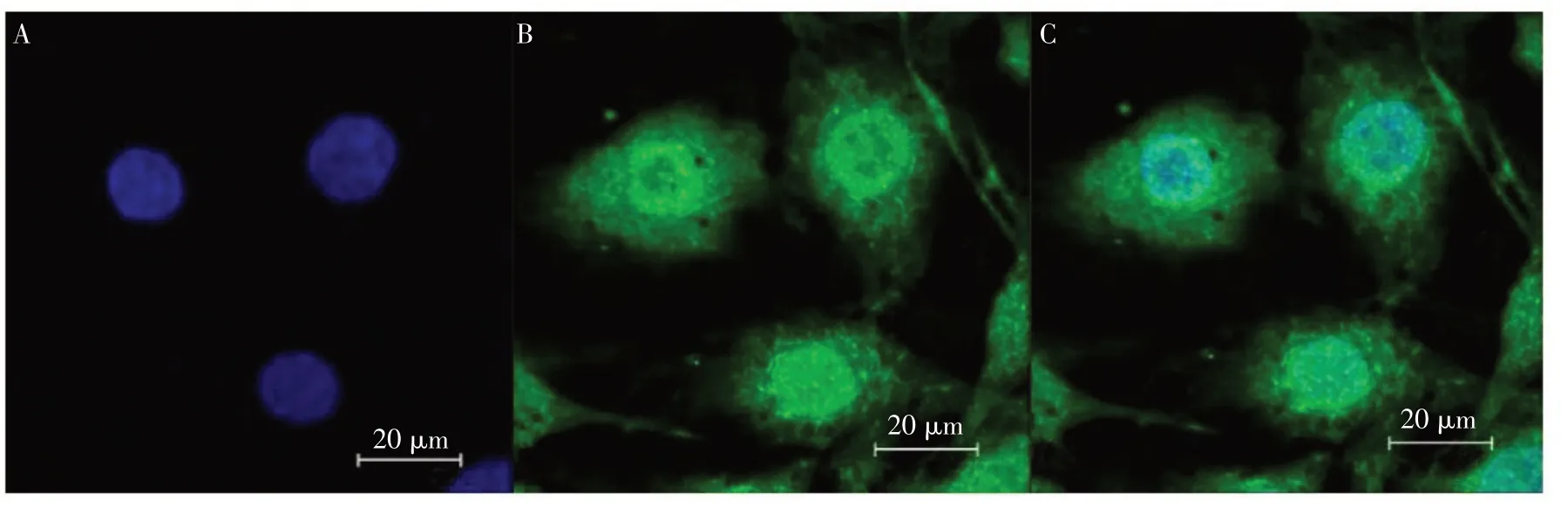
图2 大鼠软骨细胞免疫荧光检测Ⅱ型胶原图像(×200)Fig.2 Immunofluorescence detection of typeⅡcollagen in rat chondrocytes(×200)
2.2 IL-1β刺激软骨细胞不同时间对ADAMTS-4和COX-2表达影响
Western Blot方法检测经IL-1β处理0、12、24和48 h后软骨细胞中ADAMTS-4和COX-2表达。如图3所示,与对照组(0 h)比较,IL-1β刺激大鼠软骨细胞12、24和48 h后ADAMTS-4和COX-2蛋白表达均显著升高(P<0.05)。其中,IL-1β刺激软骨细胞24 h后ADAMTS-4表达显著升高(P<0.05),而ADAMTS-4在12和48 h均极显著升高(P<0.01)。COX-2在IL-1β刺激软骨细胞12 h显著增加(P<0.05),24和48 h均呈极显著升高(P<0.01),浓度以时间依赖性方式增加。
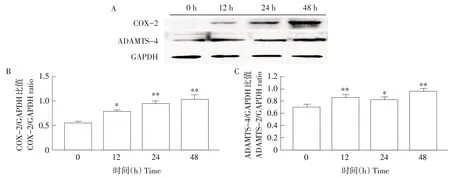
图3 Western blot检测软骨细胞内ADAMTS-4和COX-2Fig.3 Western blot detection of ADAMTS-4 and COX-2 in chondrocytes
2.3 IL-1β刺激大鼠软骨细胞不同时间对PGE2、CS846和COMP表达影响
与对照组(0 h)比较,IL-1β刺激大鼠软骨细胞12、24和48 h后PGE2表达随时间呈极显著增加(P<0.01,见图4A)。与对照组(0 h)比较,IL-1β刺激大鼠软骨细胞12、24和48 h后,细胞上清中CS846和COMP浓度显著增加(P<0.05,见图4B、C),PGE2、CS846和COMP浓度以时间依赖方式增加。

图4 ELISA检测软骨细胞上清液中PGE2、CS846和COMP浓度Fig.4 Detection of GAG,CS846 and COMP in chondrocyte supernatant by ELISA
3 讨论
动物OA作为一种不可逆转的慢性疾病,在病理生理学上有两个主要特点,一是关节软骨损伤,二是软骨下骨硬化[14]。关节软骨是维持关节稳定性关键,正常生理条件下,软骨细胞可清除坏死退变ECM,不断分泌大量蛋白多糖和Ⅱ型胶原从而发挥维持ECM合成和降解平衡的功能,当发生OA时,关节功能遭受严重破坏,软骨细胞代偿性活性增加后,因持续遭受炎症刺激,释放胶原酶和聚蛋白多糖酶,进一步破坏基质,ECM由胶原蛋白构成的支架断裂,蛋白多糖流失,继发骨质增生。
研究表明IL-1β用于体外刺激软骨细胞,可用于模拟软骨炎症环境,但大部分研究仅仅使用IL-1β单一浓度和时间。梁小弟等在正常人膝关节软骨细胞(NHAC-kn)研究中选用不同浓度IL-1β(1、5、10、15 ng·mL-1)处理24 h以模拟OA体外模型,结果发现10和15 ng·mL-1IL-1β处理软骨细胞后,细胞活性显著下降[15]。连俊江等在研究时采用10 ng·mL-1IL-1β刺激SW982细胞24 h后建立OA炎症模型[16]。李安琪等在试验研究中选用10 mg·L-1IL-1β诱导原代软骨细胞,培养3 d模拟OA软骨细胞炎症内坏境[17]。吕欣荣等在试验中采用10 ng·mL-1的IL-1β诱导软骨细胞24 h,制备软骨细胞损伤模型[18]。基于此,本研究以10 ng·mL-1IL-1β刺激软骨细胞,观察诱导0、12、24和48 h后ECM降解相关蛋白以及软骨ECM降解蛋白表达情况。
研究表明炎症因子IL-1β可上调MMP-3和MMP-13等ECM降解酶表达[19-20],IL-1β可通过促进软骨降解酶表达从而对软骨基质造成严重损害,加重疾病进程。Sawaji等研究发现ADAMTS-5表达受到炎症因子影响,IL-1β可以促进软骨细胞中ADAMTS-5和MMPs mRNA及蛋白的表达,促进软骨损伤[21]。此外,在大鼠软骨细胞中IL-1β处理后可显著提高炎症细胞因子NO、PGE2、TNF-α、IL-6、COX-2 mRNA及蛋白表达水平,并提高软骨细胞基质降解酶MMP-13和ADAMTS-5 mRNA及蛋白表达水平,说明随着IL-1β刺激,COX-2表达持续上调,对OA炎性反应作用持续加重,导致软骨细胞功能障碍[22-24]。本研究发现IL-1β刺激大鼠软骨细胞48 h内可显著提高软骨细胞中AD⁃AMTS-4和COX-2表达,与上述结论一致。另外,石婷等采用胶原酶注射关节腔方法制成兔OA动物模型后,每隔两周检测兔血清中PGE2和COX-2时发现,造模组2、4、6、8、10和12周PGE2和COX-2水平均高于对照组,且COX-2含量整体呈上升趋势,说明血清中PGE2和COX-2含量可反应OA病情发展[25]。本研究中,经10 ng·mL-1IL-1β处理0、12、24和48 h软骨细胞中ADAMTS-4、PGE2和COX-2表达,发现ADAMTS-4、COX-2和PGE2表达显著增多,并且COX-2和PGE2表达增多呈时间依赖性,提示OA炎症随时间变化愈发加剧。
COMP为构成ECM的非胶原糖蛋白,从软骨中分离出来并在多种组织中表达,如肌腱、韧带、滑膜、肌成纤维细胞和活化血小板等[26],通过结合Ⅰ、Ⅱ和Ⅸ型胶原从而发挥稳定的ECM作用。研究表明在OA患者关节液和血清中,COMP含量增加且显著高于对照组[27]。陈志伟等通过陇中骨刺膏治疗OA患者后发现,2、4周两组血清COMP较治疗前显著降低,说明COMP可作为药物治疗OA判断指标,用于了解OA病情程度[28]。仍有研究显示,在常规X线未能检测到膝关节软骨损伤的OA早期,血清中COMP水平已经升高[29],表明体液中COMP水平变化发生于临床影像学诊断之前,在早期诊断方面具有一定参考价值。另一项研究发现在瑞典温血马患病关节的关节液中,COMP含量呈上升趋势[30]。说明OA与COMP含量具有相关性,并呈正比例关系。此外,在马OA腕关节滑膜中,CS846含量显著高于对照组,并且在血清中CS846水平显著升高[31],说明CS846可以预示OA的发生发展情况。本次试验研究中,相比对照组,10 ng·mL-1IL-1β刺激软骨细胞48 h内,ECM降解蛋白COMP和CS846表达显著增多,并呈时间依赖性。与上述研究结果相符,说明IL-1β加速软骨退变,ECM中蛋白多糖和胶原发生降解,并且胶原蛋白和蛋白多糖相互构建的网络遭到破坏,导致软骨损伤加剧。
综上所述,本文通过IL-1β刺激大鼠软骨细胞模拟OA体外炎症环境,结果显示10 ng·mL-1的IL-1β刺激0、12、24和48 h后炎症细胞因子COX-2和PGE2、ECM降解产物CS846和COMP浓度以时间依赖性升高,ADAMTS-4表达显著增加。
