棕榈酸对绵羊单核巨噬细胞炎性因子和氧化应激水平的影响
2021-09-09姚玉昌赵多维肖十雨卢畅亓美玉
姚玉昌,赵多维,肖十雨,卢畅,亓美玉
(1.黑龙江普通高等学校动物遗传育种与繁殖重点实验室,哈尔滨 150030;2.东北农业大学动物科学技术学院,哈尔滨 150030;3.黑龙江省农业科学院畜牧研究所,哈尔滨 150086)
脂肪酸(Fatty acid,FA)是由偶数个碳原子组成的直链脂肪族羧酸,可调节细胞内信使传递[1]、影响部分关键基因转录[2],对细胞代谢存在直接调控作用。脂肪酸按其碳链长度可分为短链(2-4 C)、中链(6-10 C)及长链(12-26 C)脂肪酸,按其饱和度又可分为饱和脂肪酸和不饱和脂肪酸。研究表明,高浓度长链饱和脂肪酸具有一定细胞毒性,可诱导炎性因子过量表达[3]、ROS产生、细胞自噬和凋亡通路的激活[4];而长链n-3多不饱和脂肪酸则具有一定程度缓解作用[5]。棕榈酸(Palmitic acid,PA)作为一种典型长链饱和脂肪酸,具有较强的脂毒性作用,可引起细胞内过度炎症反应[6]和氧化应激[7]。亚麻酸(Linoleic acid,LNA)作为一种n-3类多不饱和脂肪酸,可缓解过度炎症反应[8],改善细胞氧化应激状态[9]。
Toll样受体4(Toll-like receptor 4,TLR4)作为一种模式识别受体,可特异性识别革兰氏阴性菌细胞壁的脂多糖(LPS)成分,激活MyD88依赖和非依赖信号通路,在多种细胞中诱发炎症、氧化应激、自噬和凋亡等生物学反应[10-12]。TLR4基因除可被LPS激活外,其还可被长链饱和脂肪酸激活,进一步活化其下游信号通路[13],诱发细胞中过度炎症和氧化应激产生[14]。前期研究结果表明,在活体水平上高浓度PA可诱发绵羊单核巨噬细胞和脂肪组织中炎性因子表达上调,激活TLR4基因下游MyD88依赖信号通路,但TLR4基因确切介导作用仍不明确[15]。
因此,本研究分离培养绵羊单核巨噬细胞,揭示PA处理后细胞中炎性因子表达和氧化应激水平变化趋势,探讨TLR4基因在此过程中介导作用,分析LNA可能存在的缓解效应,为阐明长链饱和脂肪酸调控免疫细胞代谢相关机制提供帮助。
1 材料与方法
1.1 试验动物及样品收集
选择健康、体况良好18~21月龄德国肉用美利奴公羊6只,饲养于东北农业大学绵羊新品种培育基地,每日提供全价精饲料0.5 kg,自由采食羊草,自由饮水。颈静脉采集全血50 mL,置于含有肝素的抗凝管中,用于单核巨噬细胞分离。
1.2 脂肪酸:BSA络合物制备
将0.2 g PA加入至1 mL无水乙醇中溶解,作为储存液;利用预热枪头取10µL储存液加入至1 mL 10%无脂肪酸的BSA(A6003,Sigma)中,震荡30 min,42℃加热30 min,重复此过程至完全溶解。37℃水浴过夜络合后,0.22µm滤器过滤,-20℃保存待用。
将0.1 g LNA加入至2 mL无水乙醇中溶解,环境中充入氮气排氧,避免LNA被氧化,作为储存液;取40µL储存液加入至1 mL 10%无脂肪酸的BSA(A6003,Sigma)中,震荡30 min,42℃加热30 min,重复此过程至完全溶解。37℃水浴过夜络合后,0.22µm滤器过滤,-20℃保存待用。
1.3 单核巨噬细胞分离及培养
采集的抗凝血用HBSS按1∶1稀释,小心加至等体积淋巴细胞分离液(购自天津灏洋生物制品科技有限公司)液面上,2 500 r·min-1(×500 g)离心20 min,此时离心管中由上至下细胞分4层,收集第2层絮状乳白色淋巴细胞至离心管中,2 300 r·min-1(×500 g)离心7 min,弃上清。将所得沉淀细胞利用PBS吹打重悬2次,再用RPMI-1640培养基重悬后,以每个孔1×105个细胞密度接种于12孔板中,待单核巨噬细胞贴壁生长后,再用含0.2% FBS的低血清RPMI-1640培养基在37℃、5%CO2恒温培养箱培养。
根据文献报道[16-17]和课题组前期研究,本试验中给予1 mmol·L-1的PA和LNA处理细胞。设置对照组(含有等浓度BSA,相同体积的培养液)、LPS(100 ng·mL-1)处理组(L4391,Sigma)、PA(1 mmol·L-1)处 理 组(P5585,Sigma)、LNA(1 mmol·L-1)处理组(L1012,Sigma)、PA(1 mmol·L-1)+TAK242(3µmol·L-1)共处理组和PA(1 mmol·L-1)+LNA(1 mmol·L-1)共处理组。其中TAK-242提前预处理6 h,LNA预处理1 h。每组设置3个重复孔,于处理后4 h收集样品用于后续分析。
1.4 实时荧光定量PCR
收取单核巨噬细胞,按照RNA提取试剂盒(RE-03113,FORE GENE)说明书提取总RNA。取1µL RNA样品在1.5%琼脂糖凝胶上120 V电压电泳10 min,检测RNA完整度。利用超微量分光光度计(61010-1,DeNovix)检测RNA样品纯度和浓度,调整RNA浓度至同一水平。按照反转录试剂盒(RR037Q,TaKaRa)说明书,反转录后得到cDNA。利用ABI7300实时荧光定量PCR检测系统和FastStart Universal SYBR Green Master(S2024,Roche)试剂盒,检测TLR4、IFN-γ、TNF-α、IL-1β、IL-6、SOD、iNOS、CAT等基因表达水平,以β-actin为内参基因,采用相对定量法测定基因表达水平。所用的引物信息见表1,由南京金唯智生物技术公司合成。扩增体系为10µL反应混合体系,含有5µL SYBR Green Master,上、下游引物各0.4µL,3.2µL ddH2O和1µL cDNA模板;反应条件为:50℃2 min,95℃10 min;95℃15 s,退火1 min,40个循环;每孔设置3个重复。

表1 PCR引物序列Table 1 PCR primer sequence
1.5 Western blot
收集PA和LNA处理4 h后单核巨噬细胞,利用含有蛋白酶抑制剂(SCP0110,Roche)和PMSF(329-98-6,Roche)的RIPA缓冲液(P0013B,Bey⁃otime)裂解。随后,使用BCA蛋白质检测试剂盒(P0012S,Beyotime)对蛋白质进行定量。将等量蛋白质在12%SDS-PAGE上分离,并转移到PVDF膜(DVPP00010,Millipore)上,与抗TLR4(1∶1 000;AF7017,Affinity)的一抗孵育后,和辣根过氧化物酶偶联的二抗(1∶1 000;A0208,Beyotime)孵育,通过化学发光使膜可视化(Thermo Fisher Scientific),利用ImageJ软件分析蛋白质条带。
1.6 ROS染色
在各组处理结束前40 min时,于37℃条件下将10µmol·L-1DCFH-DA(E004,南京建成)加入至细胞培养液中,利用荧光显微镜(Olympus,X71)观察细胞内氧化DCF引起的荧光值,绿色荧光信号代表ROS水平。
1.7 氧化和抗氧化指标检测
于PA和LNA处理4 h后,刮取培养皿上单核巨噬细胞并离心收集沉淀,超声波破碎。利用总抗氧化能力(T-AOC)测定试剂盒(A015-1,南京建成)、超氧化物歧化酶(SOD)测定试剂盒(A001-3,南京建成)、过氧化氢酶(CAT)测定试剂盒(A007,南京建成)、一氧化氮合酶(NOS)测定试剂盒(A014-1,南京建成)检测细胞中氧化和抗氧化指标水平,具体操作步骤和判定标准参照说明书执行。
1.8 数据分析
利用SPSS 18.0软件对数据作单因素方差分析(ANOVA)分析和Duncan多重比较。“*”代表P<0.05,表示差异显著;“**”代表P<0.01,表示差异极显著。所有数据均为平均值±标准误(Mean±SEM)。
2 结果与分析
2.1 单核巨噬细胞中TLR4基因表达变化
利用实时荧光定量PCR和Western blot检测各处理组中TLR4基因表达水平,结果见图1。在1 mmol·L-1PA处理4 h后,TLR4基因表达水平上调,与LPS刺激后趋势相似,均显著高于对照组(P<0.05);利用TAK242抑制TLR4基因后,其表达水平显著下调(P<0.05),与对照组间差异不显著(P>0.05);PA与LNA共处理后,TLR4基因的表达水平也显著下调(P<0.05),与对照组间差异不显著(P>0.05);而LNA单独处理对TLR4基因表达水平无显著影响(P>0.05)。

图1 不同处理条件下绵羊单核巨噬细胞中TLR4基因表达水平Fig.1 Expression of TLR4 gene in sheep mononuclear macrophages under different treatment
2.2 单核巨噬细胞中炎性因子表达变化
利用实时荧光定量PCR检测各处理组中IFN-γ、TNF-α、IL-1β、IL-6等炎性因子表达水平,结果见图2。在1 mmol·L-1PA处理4 h后,IFN-γ、TNF-α、IL-1β和IL-6基因表达上调,其中IFN-γ和IL-1β基因表达水平显著高于对照组(P<0.05),TNF-α和IL-6基因表达水平极显著高于对照组(P<0.01),整体上各炎性因子表达变化与LPS刺激后趋势相似;利用TAK242抑制TLR4基因后,TNF-α和IL-6基因表达水平极显著下调(P<0.01),4种炎性因子表达水平与对照组间均差异不显著(P>0.05);PA与LNA共处理后,TNF-α和IL-6基因表达水平也极显著下调(P<0.01),4种炎性因子表达水平与对照组间均差异不显著(P>0.05);而LNA单独处理对以上4种炎性因子表达无显著影响(P>0.05)。
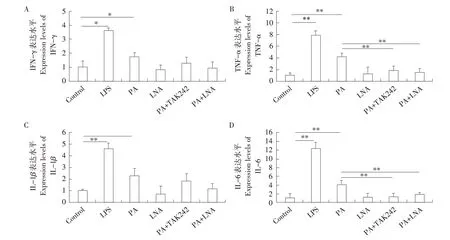
图2 不同处理条件下绵羊单核巨噬细胞中各炎性因子表达水平Fig.2 Expression levels of inflammatory factors in sheep mononuclear macrophages under different treatment
2.3 单核巨噬细胞中氧化应激相关指标的变化
利用实时荧光定量PCR检测各处理组中iNOS、SOD、CAT等氧化应激相关基因表达水平,结果见图3。在1 mmol·L-1PA处理4 h后,iNOS基因表达水平显著高于对照组(P<0.05),SOD和CAT基因表达水平显著低于对照组(P<0.05),整体上与LPS刺激后趋势相似;利用TAK242抑制TLR4基因后,iNOS基因表达水平显著下调(P<0.05),3个氧化应激相关基因表达水平与对照组间均差异不显著(P>0.05);PA与LNA共处理后,对3个氧化应激相关基因表达无显著影响(P>0.05);而LNA单独处理对以上3种氧化应激相关基因表达也无显著影响(P>0.05)。

图3 不同处理条件下绵羊单核巨噬细胞中氧化应激相关基因表达水平Fig.3 Expression levels of oxidative stress related genes in sheep mononuclear macrophages under different treatment
利用氧化应激试剂盒检测各处理组中iNOS、CAT、SOD、T-AOC等氧化和抗氧化指标变化结果见图4。在1 mmol·L-1PA处理4 h后,iNOS水平显著升高(P<0.05),SOD、CAT、T-AOC水平显著降低(P<0.05),整体上与LPS刺激后趋势相似;利用TAK242抑制TLR4基因后,iNOS水平显著下降(P<0.05),T-AOC水平显著升高(P<0.05),4个氧化应激相关指标水平与对照组间均差异不显著(P>0.05);PA与LNA共处理后,iNOS水平也显著下降(P<0.05),T-AOC水平显著升高(P<0.05),4种氧化和抗氧化指标水平与对照组间均差异不显著(P>0.05);而LNA单独处理对以上4种氧化和抗氧化指标水平无显著影响(P>0.05)。
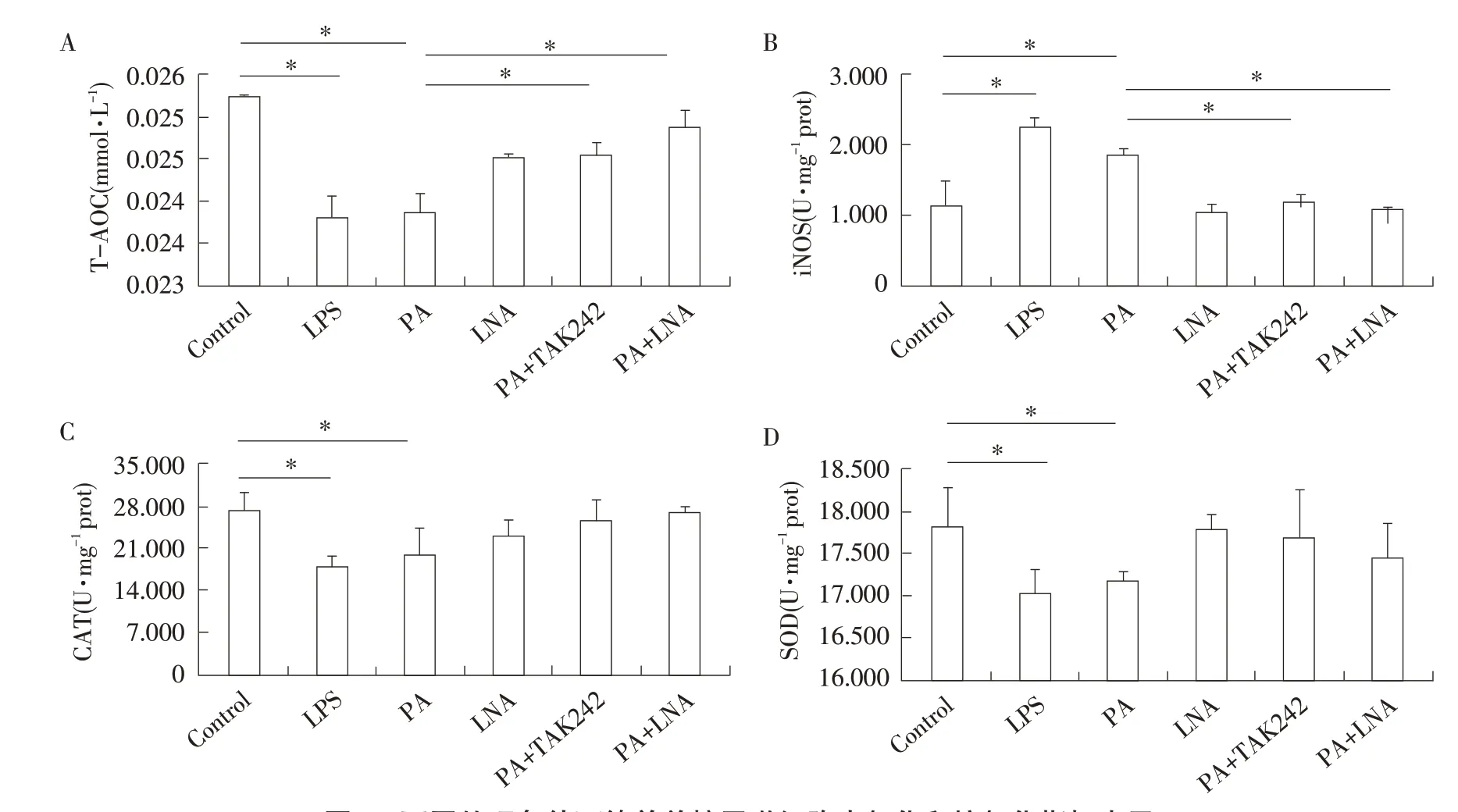
图4 不同处理条件下绵羊单核巨噬细胞中氧化和抗氧化指标水平Fig.4 Expression levels of oxidation and antioxidant indices in sheep mononuclear macrophages under different treatments
2.4 单核巨噬细胞中ROS水平变化
DCFH-DA染色结果表明见图5。在1 mmol·L-1PA处理4 h后,ROS的水平显著升高(P<0.05),与LPS刺激后趋势相似;利用TAK242抑制TLR4基因后,ROS水平显著下降(P<0.05),与对照组间差异不显著(P>0.05);PA与LNA共处理后,ROS水平也显著下降(P<0.05),与对照组间差异不显著(P>0.05);而LNA单独处理对ROS水平无显著影响(P>0.05)。

图5 不同处理条件下绵羊单核巨噬细胞中ROS水平Fig.5 ROS levels in sheep mononuclear macrophages under different treatments
3 讨论
脂肪酸对细胞代谢调控作用与其碳链长度、双键数量及位置密切相关。目前,研究表明长链饱和脂肪酸具有明显脂毒性,过量累积导致免疫细胞中炎症激活,促炎因子分泌增加[3]。饱和脂肪酸脂毒性与碳链长度呈正比,PA作为含有16个碳的长链饱和脂肪酸,可增加巨噬细胞中IL-1β和TNF-α分泌[18]。本研究结果表明,PA处理绵羊单核巨噬细胞后,IFN-γ、TNF-α、IL-1β、IL-6等炎性因子表达水平显著上调,与阳性对照LPS处理组表现相近趋势。除LPS以外,脂肪酸也可作为配体激活TLR4基因[13],其中,PA可被TLR4胞膜外区结构识别,并活化其下游信号通路[19]。Suganami等发现饱和脂肪酸处理TLR4基因突变的小鼠巨噬细胞后,TNF-α合成量显著减少[20]。Sunita等在神经细胞中研究结果也显示,PA可能通过TLR4引起TNF-α和IL-6释放,诱发炎症产生[21]。本研究结果表明,PA处理绵羊单核巨噬细胞后,导致TLR4基因表达上调,炎性因子表达水平升高,而抑制TLR4基因后炎性因子的表达水平显著下降,进一步证明TLR4基因在介导PA诱发的炎性反应过程中扮演重要角色。部分不饱和脂肪酸可起到一定抗炎作用,亚油酸可以在肝癌细胞系中逆转PA诱导的炎症反应,显著抑制IL-8产生[22];鼠单核细胞研究也表明,n-3类二十碳五烯酸和二十二碳六烯酸可降低IL-1、IL-2、TNF-α等炎性因子表达水平[23]。本研究表明,LNA作为一种n-3类多不饱和脂肪酸,对绵羊单核巨噬细胞中TLR4基因和炎性因子表达无显著影响,但可在一定程度上缓解PA促炎作用。
一般认为过度氧化应激状态导致免疫细胞中蛋白质翻译异常,影响细胞正常代谢过程。PA可通过损伤线粒体氧化呼吸链正常功能,诱导细胞发生氧化应激反应[24]。PA可在牛输卵管上皮细胞中诱导ROS水平升高[18]。Liu等在大鼠心脏细胞研究中发现PA可通过TLR4下游MAPK通路增强ROS产生,进一步说明ROS产生可能与TLR4激活有关[25]。本研究结果表明,PA处理绵羊单核巨噬细胞后,ROS水平显著升高,而抑制TLR4基因后ROS水平显著下降。PA刺激炎症并分泌产生ROS[26],ROS可通过TLR4信号通路激活iNOS,导致NO释放,NO通过产生过氧化物酶和超氧化物帮助消灭氧化应激源头[27]。Juntian等发现,PA可以显著提高iNOS表达,导致细胞氧化应激水平提高[28]。
本研究结果表明,PA处理绵羊单核巨噬细胞后,氧化指标水平提高、抗氧化指标水平降低,导致细胞中整体氧化应激水平提高。而抑制TLR4基因后,iNOS等细胞氧化指标显著下降,降低氧化应激水平。多不饱和脂肪酸可抑制饱和脂肪酸诱导的TLR4基因表达[29],缓解细胞内氧化应激水平。n-3类多不饱和脂肪酸可以抑制巨噬细胞中iNOS表达[30];摄入n-3类多不饱和脂肪酸后,血液中二十碳五烯酸和二十二碳六烯酸含量增加,诱发抗氧化指标SOD水平升高,缓解氧化应激状态[31]。本研究表明,LNA对绵羊单核巨噬细胞中TLR4基因表达和抗氧化指标无显著影响,但可在一定程度上通过降低氧化水平缓解PA诱发的氧化应激反应。
4 结论
PA处理后导致绵羊单核巨噬细胞炎性因子和氧化应激水平升高,TLR4基因在此过程中起重要介导作用,LNA可能在一定程度上缓解PA诱发的细胞炎症反应和氧化应激。
