不同光照强度和接种密度对葛仙米生长的影响
2021-09-09陈琳玲刘树文
孙 萍,李 露,陈琳玲,刘树文
(贵州师范学院生物科学学院,贵州贵阳 550018)
葛仙米(Nostoc sphaeroidesKützing)属于蓝藻门(Cyanophyta)念珠藻科(Nostoceae)念珠藻属(Nostoc)藻类植物[1]。其营养价值丰富,食用和药用历史悠久[2];含有丰富的蛋白质、氨基酸、多糖、不饱和脂肪酸、多种光合色素等营养物质,在食用、医疗保健、化工原料等领域都有重要的应用价值[3]。葛仙米主要分布在我国湖北省鹤峰县走马镇的水稻田中[4],生长期为11月到次年4 月,最佳采收期为3—4 月,5 月之后很难见到葛仙米的踪迹[5]。由于化肥、杀虫剂和除草剂的广泛应用,导致野生葛仙米资源减少[6]。
随着人们对葛仙米的认可及受到污染后葛仙米的数量不断减少,葛仙米的现有产品数量已经无法满足市场需求。因此,国内一些学者开展了葛仙米人工养殖研究,并取得了较大进展[7]。如,邓中洋等人研究了葛仙米在水稻田中的养殖技术,发现在水稻田中养殖的葛仙米生长发育周期较长,生产受到季节限制,产量低,且因含有较多的泥沙杂质而采集困难。目前葛仙米的商业化、规模化养殖主要是采取室内玻璃缸养殖或室外水池养殖[8]。野生葛仙米群体一般在11 月至次年5 月生长,生长期间平均气温为12.2 ℃左右,5 月后葛仙米群体消失[9]。在湖北武汉地区进行的室内和室外养殖葛仙米的研究表明,夏季的高温(培养液的温度为35~45 ℃)和较高的光照强度(50 000~100 000 lx)是室外培养葛仙米在5—10月易发生群体破裂的主要因素[10]。通常室内培养葛仙米在光照强度为500~10 000 lx 的光照范围内,葛仙米能够正常生长[8]。接种密度对葛仙米的生长和群体直径的增加速率、群体的破裂率等,均产生一定的影响[1]。
本研究通过测定不同光照强度和接种密度培养条件下葛仙米的各种光合色素和可溶性糖、可溶性蛋白含量变化,以及光合参数、鲜重、干重的变化,数量和重量的变化、颗粒大小的变化,探讨室内养殖葛仙米在不同光照强度和接种密度下的生长趋势。
1 材料与方法
1.1 材料
粒径为4~5 mm的葛仙米。
1.2 仪器设备
滤纸,移液管(1 mL、5 mL),量杯(100 mL),不锈钢分样筛(1 mm、4 mm、5 mm、6 mm、7 mm、8 mm),玻璃锥形瓶(500 mL、1 000 mL),塑料瓶(500 mL、1 000 mL、2 500 mL、5 000 mL),玻璃匀浆器(20 mL),培养皿,高压蒸汽灭菌锅,离心机,空气泵,LED灯,分光光度计。
1.3 药品及试剂
A 液(MgSO4·7H2O、Na2CO3、H2O),B 液(K2HPO4·3H2O、H2O),C 液(CaCl2、H2O),D 液(柠檬酸、柠檬酸铁铵、Na2-EDTA、H2O),E液[H2O、H3BO3、MnSO4·7H2O、ZnSO4·7H2O、(NH4)6Mo7O24·4H2O、CuSO4·5H2O、CoCl2·6H2O],95%乙醇,磷酸缓冲液,考马斯亮蓝溶液,牛清蛋白,蒽酮试剂,标准葡萄糖溶液。
1.4 藻种制备及培养
选取颗粒直径为0.5~1.0 cm、成色较好的新鲜葛仙米若干,用自来水和蒸馏水冲洗干净,然后在超净工作台内用无菌水冲洗数次,再将藻体放在75%的乙醇中浸泡30 s,倒干净乙醇后,再用无菌的BG-11 培养基冲洗数次,取出后用灭菌的玻璃匀浆器分散藻体,将分散后的藻体用无菌的BG-11 培养基稀释至合适浓度后,倒入无菌的玻璃锥形瓶中,在弱光下静置培养数天,每天定时摇动锥形瓶。然后将葛仙米置于26 ℃,1 000 lx 左右光强条件下进行扩大培养。经过扩大培养后得到的大量葛仙米藻种,用孔径4 mm 和孔径5 mm 的分样筛选取颗粒直径为4~5 mm 的葛仙米作为实验藻种。藻种以10 g·L-1和20 g·L-1的接种密度各接种到6 个2.5 L 的塑料瓶中,加入2.5 L BG-11培养基,置于26 ℃条件下培养。每个接种密度设置2 000 lx和4 000 lx两个光照强度,使用30 W LED灯提供光照,每组3个重复。
1.5 葛仙米的生理指标测定
1.5.1 各种主要光合色素含量
分别从高光强(4 000 lx)高接种密度(20 g·L-1)、高光强(4 000 lx)低接种密度(10 g·L-1)、低光强(2 000 lx)高接种密度(20 g·L-1)、低光强(2 000 lx)低接种密度(10 g·L-1)4 种不同培养条件的3 个重复组的塑料瓶中各取1.0 g 新鲜葛仙米,加入20 mL95%乙醇,震荡均匀后,置于4 ℃冰箱中24 h 后用20 mL玻璃匀浆器进行匀浆。4 000 r·min-1离心10 min后取上清液,用分光光度计分别测量波长为665 nm、649 nm、470 nm 处的吸光度,分别记为A665、A649、A470。叶绿素a(Chl a)和类胡萝卜素(Car)含量(单位均为mg·mL-1)的计算公式如下[11]:Chl a=13.95×A665-6.88×A649;Car=(1000×A470-2.05×Chl a)/245。
分别从高光强高接种密度、高光强低接种密度、低光强高接种密度、低光强低接种密度条件下培养的3 组重复的塑料瓶中各取出1.0 g 新鲜葛仙米,加入20 mL 磷酸缓冲液,置于-40 ℃的冰箱中冷冻24 h,取出后置于4 ℃冰箱中解冻,解冻后取出葛仙米,冰浴匀浆60 次,4 000 r·min-1离心10 min 后取上清液,用紫外分光光度计测量波长为562 nm、615 nm、652 nm的吸光度A,分别记为A562、A615、A652。藻蓝蛋白(PC)、别藻蓝蛋白(APC)、藻红蛋白(PE)的含量(单位均为mg·mL-1)根据Siegelman &Kycia[12]计算:PC=(A615-0.474×A652)/5.34;APC=(A652-0.208×A615)/5.09;PE=(A562-2.41×PC-0.849×APC)/9.62。
1.5.2 可溶性蛋白含量
分别从高光强高接种密度、高光强低接种密度、低光强高接种密度、低光强低接种密度条件下培养的3 组重复的塑料瓶中各取出1.0 g 新鲜葛仙米,加入20 mL 磷酸缓冲液,置于-40 ℃的冰箱中冷冻24 h,取出后置于4 ℃冰箱中解冻,解冻后取出葛仙米,用20 mL 的玻璃匀浆器冰浴匀浆60 次。4 000 r·min-1离心10 min 后取1 mL 上清液,分别加入到12 支试管中,再分别加入5 mL 考马斯亮蓝溶液,震荡后静置20 min。用分光光度计测量波长为595 nm的吸光度A。另取6 支试管,制作标准曲线。再根据标准曲线求出各样品中可溶性蛋白的含量[13]。
1.5.3 可溶性糖含量
分别从高光强高接种密度、高光强低接种密度、低光强高接种密度、低光强低接种密度条件下培养的3 组重复的塑料瓶中各取出1.0 g 新鲜葛仙米,加入20 mL 磷酸缓冲液,置于-40 ℃的冰箱中冷冻24 h,取出后置于4 ℃冰箱中解冻,解冻后取出葛仙米,用20 mL 的玻璃匀浆器冰浴匀浆60 次。4 000 r·min-1离心10 min 后取上清液,分别取1 mL 加入到12 支试管中,再分别加入2.5 mL 蒽酮试剂,摇匀后在沸水中水浴加热20 min,用分光光度计测量波长为625 nm 的吸光度A。另取6 支试管,制作标准曲线。再根据标准曲线求出各样品中可溶性糖的含量[11]。
1.5.4 快速光响应曲线及相关参数
分别从高光强高接种密度、高光强低接种密度、低光强高接种密度、低光强低接种密度条件下培养的3 组重复的塑料瓶中各取出100 mL 藻样,用20 mL 的玻璃匀浆器分5 次进行匀浆,将5 次匀浆的藻液混合均匀后倒出2 mL 藻液置于黑暗处20 min 进行暗处理,将经过暗处理的藻液用叶绿素荧光仪测定最大相对电子传递速率(rETR)、光合效率(α)、饱和光强(Ik)等光合作用相关参数。饱和光强的计算公式为:Ik=rETR/α[10]。
1.5.5 比生长速率
每隔一天从12 个培养瓶中各取100 mL 藻样,用孔径1 mm 的筛网过滤后放置于筛网上5 min,滤去水分,然后用滤纸吸干群体表面水分后称量其鲜重。比生长速率的计算公式为:μ=(lnX1-lnX2)/(T2-T1),其中X1、X2分别是T1(第0 天)、T2(第8 天)的鲜重(g/100 mL)。
1.5.6 葛仙米颗粒直径
培养8 d后,分别把12个培养瓶中的葛仙米倒出,用孔径为4 mm、5 mm、6 mm、7 mm、8 mm 的筛网将葛仙米分为颗粒直径为4~5 mm、5~6 mm、6~7 mm、7~8 mm四个等级,记录每个等级的颗粒数量。
1.5.7 葛仙米群体干重
培养8 d后,分别把12个培养瓶中的葛仙米倒出,用蒸馏水和超纯水各冲洗3次后放置于孔径1 mm 的筛网上1 h 滤去水分,然后用滤纸吸干群体表面水分,在分析天平上分别称取适量葛仙米鲜品(重量为m1),转移到烘成恒重的滤纸上(重量为m2),移入烘箱中于105 ℃烘12 h 至恒重(重量为m3),最后计算葛仙米群体每克鲜藻干重(单位为g),其计算公式为:每克鲜藻干重m=(m3-m2)/m1[10]。
1.6 数据处理
本文主要利用软件Origin 8.0,STATISTICA®7.0(StatSoft Inc,Tulsa,OK,USA)进行统计分析处理。单因素方差分析(ANOVA)和Tukey 显著性检验(HSD)用来检测不同处理间的显著性水平。
2 结果与分析
2.1 各种光合色素和光合产物的含量
由表1 可见,在接种密度相同时,高光强培养的葛仙米中叶绿素a、类胡萝卜素、藻蓝蛋白、别藻蓝蛋白、藻红蛋白等光合色素含量均高于低光强培养的葛仙米。高光强培养的每克新鲜葛仙米中叶绿素a 含量分别比低光强培养的葛仙米高63.31%(高接种密度)和47.62%(低接种密度);类胡萝卜素含量比低光强培养的葛仙米高57.23% 和56.54%(Tukey’s HSD,P<0.05);藻蓝蛋白含量比低光强培养的葛仙米高46.78%和22.73%;别藻蓝蛋白含量比低光强培养的葛仙米高84.12%和20.91%;藻红蛋白含量比低光强培养的葛仙米高43.06%和11.72%。

表1 不同培养条件下葛仙米的各种光合色素含量单位:mg·g-1(鲜重)
在光强相同时,总体趋势为高接种密度培养的葛仙米中各种光合色素含量低于低接种密度培养的葛仙米。高接种密度培养的每克新鲜葛仙米中叶绿素a 含量比低接种密度培养的葛仙米低9.03%(高光强)和17.77%(低光强),类胡萝卜素含量低12.45% 和12.47%(Tukey’s HSD,P<0.05),藻蓝蛋白含量低13.92%和28.28%;藻红蛋白含量低5.48%和26.18%;高光强培养时,高接种密度培养的葛仙米中别藻蓝蛋白含量比低接种密度培养的葛仙米高3.93%,低光强培养时,高接种密度培养的葛仙米中别藻蓝蛋白含量比低接种密度培养的葛仙米低31.76%。
2.2 可溶性糖和可溶性蛋白含量的变化
图1 为可溶性糖含量标准曲线,其直线方程为y=256.61x(R2=0.98)。图2 为可溶性蛋白含量标准曲线,其直线方程为y=124.56x(R2=0.95)。

图1 可溶性糖标准曲线
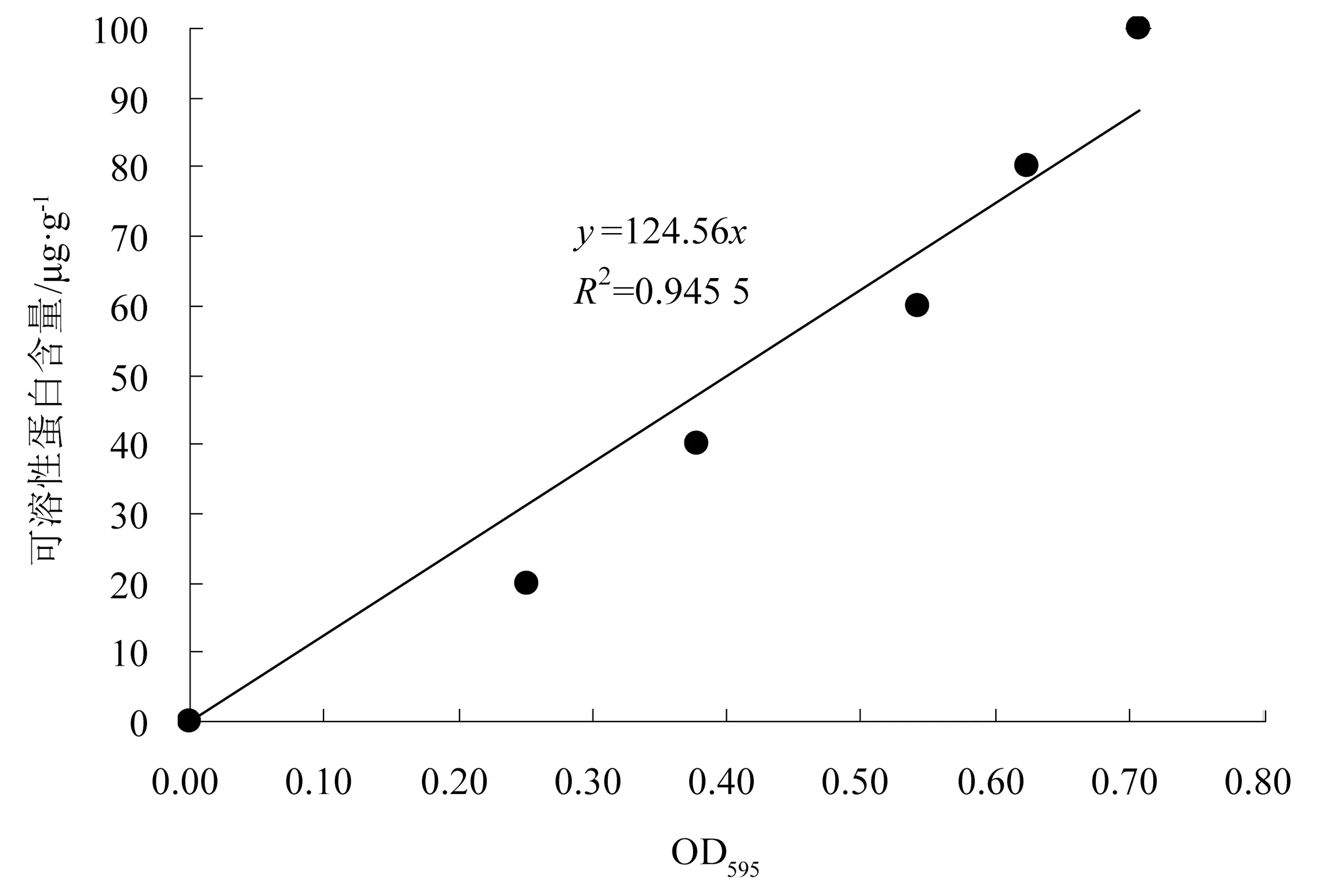
图2 可溶性蛋白标准曲线
根据直线方程计算得到不同光强和接种密度条件下培养的葛仙米可溶性糖含量和可溶性蛋白含量。由表2 可见,在接种密度相同时,高光强培养的每克新鲜葛仙米中可溶性糖含量比低光强培养的葛仙米高439.26%(高接种密度)和297.26%(低接种密度);可溶性蛋白含量高41.01%和19.61%(Tukey’s HSD,P<0.05)。在光强相同时,高接种密度培养的每克新鲜葛仙米中可溶性糖含量比低接种密度培养的葛仙米低25.53%(高光强)和45.14%(低光强);可溶性蛋白含量低18.16%和30.51%(Tukey’s HSD,P<0.05)。

表2 不同培养条件下葛仙米的可溶性糖和可溶性蛋白含量单位:μg·g-1(鲜重)
2.3 快速光响应曲线及相关参数
葛仙米的快速光响应曲线见图3,由光响应曲线计算得到的rETR(最大相对电子传递速率)、α(光合效率)、Ik(饱和光强)、QYmax(最大光化学效率)列于表3,可以看出,当光强相同时,高接种密度培养的葛仙米的α和rETR均显著低于(Tukey’s HSD,P<0.05)低接种密度培养的葛仙米,高光强条件下分别低20.31%和16.57%,低光强条件下分别低14.29%和21.26%。

图3 快速光响应曲线

表3 不同光强和接种密度培养条件下的rETR、α、IK值
当接种密度相同时,高光强培养的葛仙米的IK和QYmax均显著高于低光强培养的葛仙米(Tukey’s HSD,P<0.05),高接种密度条件下分别高1.57%和8.69%,低接种密度条件下分别高13.27%和14.29%。
2.4 葛仙米生长、粒径变化
不同光强和接种密度培养条件下的葛仙米鲜重和颗粒数量变化列于表4,可以看出,培养8 d后,接种密度相同条件下,高光强培养的葛仙米鲜重和颗粒数量增长分别比低光强培养的葛仙米高35.67%(高接种密度)、50.49%(低接种密度)和279.84%、174.97%;光强相同条件下,高接种密度培养的葛仙米鲜重和颗粒数量增长分别比低接种密度培养的葛仙米低22.23%(高光强)、13.75%(低光强)和32.26%、50.97%。

表4 不同培养条件下葛仙米的数量和重量变化
培养8 d 后,在接种密度相同时,高光强培养的葛仙米比生长速率略高于低光强培养的葛仙米,分别高了10.28%(高光强)和5.26%(低光强);在光强相同时,高接种密度条件培养的葛仙米的比生长速率略低于低接种密度培养的葛仙米,分别低了13.43%和17.36%。
不同光强和接种密度培养条件下的每克新鲜葛仙米干重统计结果:HH、HL、LH和LL分别为0.016 9 g、0.020 2 g、0.010 6 g和0.012 2 g,即接种密度相同条件下,高光强培养的葛仙米干重显著高于低光强培养的葛仙米(Tukey’s HSD,P<0.05),分别高了59.33%(高光强)和65.29%(低光强);光强相同条件下,高接种密度培养的葛仙米干重低于低接种密度培养的葛仙米,分别低了16.72%和13.61%。
不同光强和接种密度培养条件下葛仙米不同粒径分布统计结果列于表5,可以看出,接种密度相同时,在高接种密度条件下,高光强培养的葛仙米群体大小以6~7 mm为主,占56%,其次是7~8 mm的藻群体,占26%,4~5 mm 的藻体减少至无;低光强培养的葛仙米群体大小以6~7 mm 和7~8 mm 为主,分别占36%和47%,有少量4~5 mm的藻体,占3%。在低接种密度条件下,高光强和低光强培养的葛仙米群体大小均以6~7 mm 和7~8 mm 为主,分别占62%、27%(高光强)和49%、38%(低光强),均有少量4~5 mm的藻体,分别占1%和2%。光强相同时,在高光强条件下,高接种密度培养的葛仙米群体大小以6~7 mm为主,低接种密度培养的葛仙米群体大小以6~7 mm和7~8 mm 为主;在低光强条件下,高接种密度和低接种密度培养的葛仙米群体大小均以7~8 mm为主。
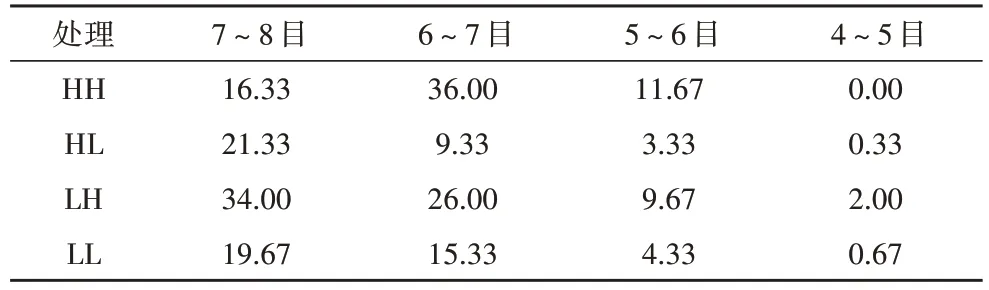
表5 不同培养条件下葛仙米的粒径分布单位:粒/200 mL
3 讨论与结论
本研究结果表明,不同的光照强度和接种密度对葛仙米的光合色素及可溶性糖和可溶性蛋白的含量、光合作用参数有显著影响。光照影响藻类的光合作用效率,从而影响糖类等光合产物的合成,继而影响到蛋白及光合色素等其他有机物的合成[14]。当接种密度相同时,高光强(4 000 lx)培养的葛仙米藻细胞内叶绿素a、类胡萝卜素、藻蓝蛋白、别藻蓝蛋白、藻红蛋白、可溶性糖及可溶性蛋白含量、饱和光强(IK)及最大光化学效率(QYmax)、每克鲜藻干重均比低光强(2 000 lx)培养的葛仙米更高,比生长速率也更高。这是因为光是藻类进行光合作用的主要能量来源,在低光强下,光合作用受到一定限制,光合效率较低,产生的光合色素较少,藻体细胞内积累的物质较少;而在4 000 lx 条件下,葛仙米吸收利用更多的光能,光合效率较高,葛仙米的生长速度较快,藻体细胞内积累的物质较多,大颗粒群体所占比例也较高。因此,4 000 lx光强较适合葛仙米生长。
当光强相同时,高接种密度(20 g·L-1)培养的葛仙米藻细胞内叶绿素a、类胡萝卜素、藻蓝蛋白、别藻蓝蛋白、藻红蛋白、可溶性糖及可溶性蛋白含量、光合效率(α)及最大相对电子传递速率(rETR)、每克鲜藻干重总体趋势均比低接种密度(10 g·L-1)培养的葛仙米更低,比生长速率也更低。这是因为在较高的种群密度下,种内竞争是剧烈的,理论上可以认为,植物种群能够通过种内竞争而降低生长速率。据推测,在高密度的单一种群中,较小的群体更容易受到生长抑制甚至死亡。通常光照和营养是限制种群生长最主要的限制因子[8]。在高接种密度下,葛仙米群体会产生遮光效应,光合作用会受到限制,光合效率较低,葛仙米生长速度较慢,藻体细胞内积累的物质少;低接种密度下,产生的遮光效应较低,光合作用受限少,光合效率较高,葛仙米生长速度较快,大颗粒群体所占比例较高。除此之外,培养瓶的承载量有限,高接种密度下,葛仙米对钙、磷、钠、镁等元素和CO2的吸收会受到抑制,葛仙米的生长受到抑制;低接种密度下,葛仙米对钙、磷、钠、镁等元素和CO2的吸收不会受到抑制或受限较少,葛仙米生长速度较快。在本研究中,高光强低接种密度培养的葛仙米产量最高。因此,在葛仙米的人工养殖过程中,采用4 000 lx 左右光强、10 g·L-1接种密度较为合适,有利于提高葛仙米的产量和降低成本。
