免疫组化标志物在鉴别浆膜腔积液恶性肿瘤细胞中的应用价值
2021-09-09苏梅芬
苏梅芬
(广西钦州市第二人民医院病理科,广西 钦州 535000)
浆膜腔积液中恶性肿瘤属于临床中较为复杂的类型之一,浆膜腔积液内肿瘤细胞的检测在临床病理送检中属于较为常见的现象[1]。在诊断过程中受到传统细胞学涂片判读的限制,很难为临床提供肿瘤的来源与分类,加上晚期肿瘤患者难以耐受手术和极易出血,不易获取原发部位肿瘤的组织学标本[2]。而浆膜腔积液经常被临床中当作首发症状,较为容易获取,因此在临床病理工作中利用浆膜腔积液的样本进行制作蜡块加做免疫组化检测来诊断具有较为积极的作用,能为临床治疗恶性肿瘤提供个性化的帮助和参考[3]。因此,有效的免疫组化标志物的检测手段显得尤为重要,为了分析免疫组化标志物在鉴别浆膜腔积液恶性肿瘤细胞中的应用有效性,我院针对收治的60 例浆膜腔积液恶性肿瘤患者展开了观察及诊断分析。
1 资料与方法
1.1 临床资料
选择我院2019年1月至2020年12月收治的由细胞学筛选的浆膜腔积液恶性肿瘤患者60 例作为本次观察对象,采用数字随机分组的方式将其分成三组,A 组20 例患者中男性患者11 例,女性9 例,最大年龄为81 岁,最小年龄为39岁,年龄均值为(62.56±5.69)岁,其中心包积液患者3 例,腹水患者7 例,胸水患者10 例;B 组20 例患者中男性患者12例,女性8 例,最大年龄为82 岁,最小年龄为40 岁,年龄均值为(62.57±5.72)岁,其中心包积液患者4 例,腹水患者7 例,胸水患者9 例;C 组20 例患者中男性患者10 例,女性10 例,最大年龄为80 岁,最小年龄为41 岁,年龄均值为(62.62±5.70)岁,其中心包积液患者3 例,腹水患者8 例,胸水患者9 例。
对三组浆膜腔积液恶性肿瘤患者的一般资料进行统计分析,结果显示组间差异小且可比性高。本研究观察之前,60例患者经临床病理学诊断后均确诊为浆膜腔积液恶性肿瘤患者;本观察开展前,60 例患者及其家属均对本次观察的目的、内容、形式和结果等展开了详细的了解且均已签署知情同意协议;本次观察均在我院伦理委员会审批下通过。
1.2 方法
本次观察中使用的4 种检测手段中涉及到的仪器设备包括切片机、离心机及脱水机、包埋机等等;使用的试剂包括免疫组化染色采用的EnVision 法,抗体包括CEA、CK20、TTF-1、CK7、CK8、CK、EMA、CA125、PAX-5、CDX-2、Villin、NapsinA、CR、MC、D2 -40、WT -1、PR、ER、HER -2、CD15、MUM1、CD20、CD3、vimentin、Ki-67、P53 等等。将60 例患者的浆膜腔积液标本编号后分成2 份,一份80ml,将其分别放置在2 个离心管中,通过3000r/min 转速的速度实施离心操作5 分钟,两管将上清液去除后保留沉淀物等待检测。
针对A 组20 例患者实施常规细胞学涂片检查,针对B组20 例患者实施薄层液基细胞技术制片检查,选择1 管沉淀物给予2 张常规涂片的检测,将湿片固定在95%的乙醇溶液中给予HE 的染色处理;再将剩下的沉淀物全部转入薄层液基细胞保存瓶内,选择由手工型制片对液基薄层细胞技术的处理。检测后呈巢团、弥漫或散在的分布显著异型细胞,明确为免疫组化染色的基本条件。
针对C 组20 例患者实施细胞蜡块切片结合免疫组化检测的联合诊断,利用一管沉淀物注入40ml 的福建泰普生物有限公司生产的细胞提取液,给予3000r/min 的低速离心操作,连续离心操作5 分钟后将上清液去除,再加入10%的50ml 中性福尔马林,重复进行5 分钟的离心操作,将上清液去除后沉淀物能凝固成块,后将固块包在滤纸内放置如包埋盒中,采用全自动脱水机进行固定、脱水处理,然后实施包埋、切片及HE 染色的处理,将细胞蜡块切片后实施免疫组化染色的检测。检测完成后参照组织学的原则,细胞核、细胞膜及细胞质出现定位较为清晰的棕黄色或黄色颗粒的患者,且量在10%以上的异型细胞则属于阳性,完全不着色则属于阴性。各类抗体阳性的结果可靠,染色定位较为准确。
1.3 观察指标
对比观察三组浆膜腔积液恶性肿瘤患者检测诊断之后对比检出率及鉴别浆膜腔积液中恶性肿瘤的来源和分类的阳性率等指标的差异。
1.4 统计学分析
采用spss27.0 软件对三种诊断技术下的诊断结果进行处理,检出率及鉴别浆膜腔积液中恶性肿瘤的来源和分类的阳性率为计数资料,采用x2 表示,当P 小于0.05 表示三种诊断技术下的诊断结果之间的差异有统计学意义。
2 结果
2.1 三种检测浆膜腔积液中恶性肿瘤细胞阳性检出率的对比
C 组浆膜腔积液中恶性肿瘤患者检测后的检出率显著高于A 组浆膜腔积液中恶性肿瘤患者及B 组浆膜腔积液中恶性肿瘤患者(P<0.05),差异具有统计学意义;见表1所示:
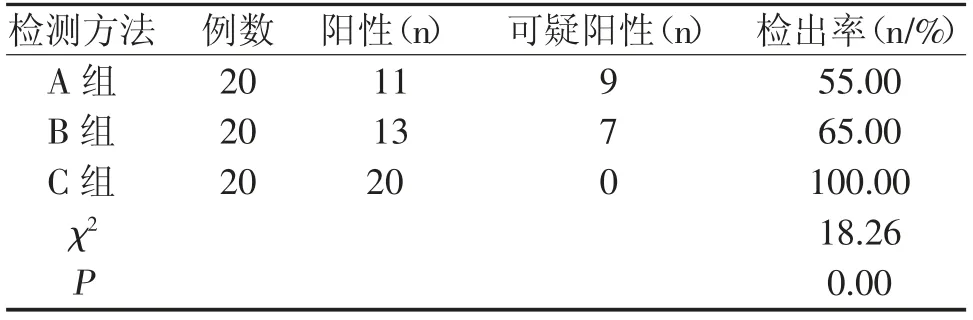
表1 三种检测浆膜腔积液中恶性肿瘤细胞阳性检出率
2.2 浆膜腔积液中恶性肿瘤的来源和分类
A 组恶性浆膜腔积液患者、B 组恶性浆膜腔积液患者及C 组恶性浆膜腔积液患者的临床资料、细胞学特点及免疫组化结果的分析下,对其组织来源和类型进行分析的具体结果见表2所示:
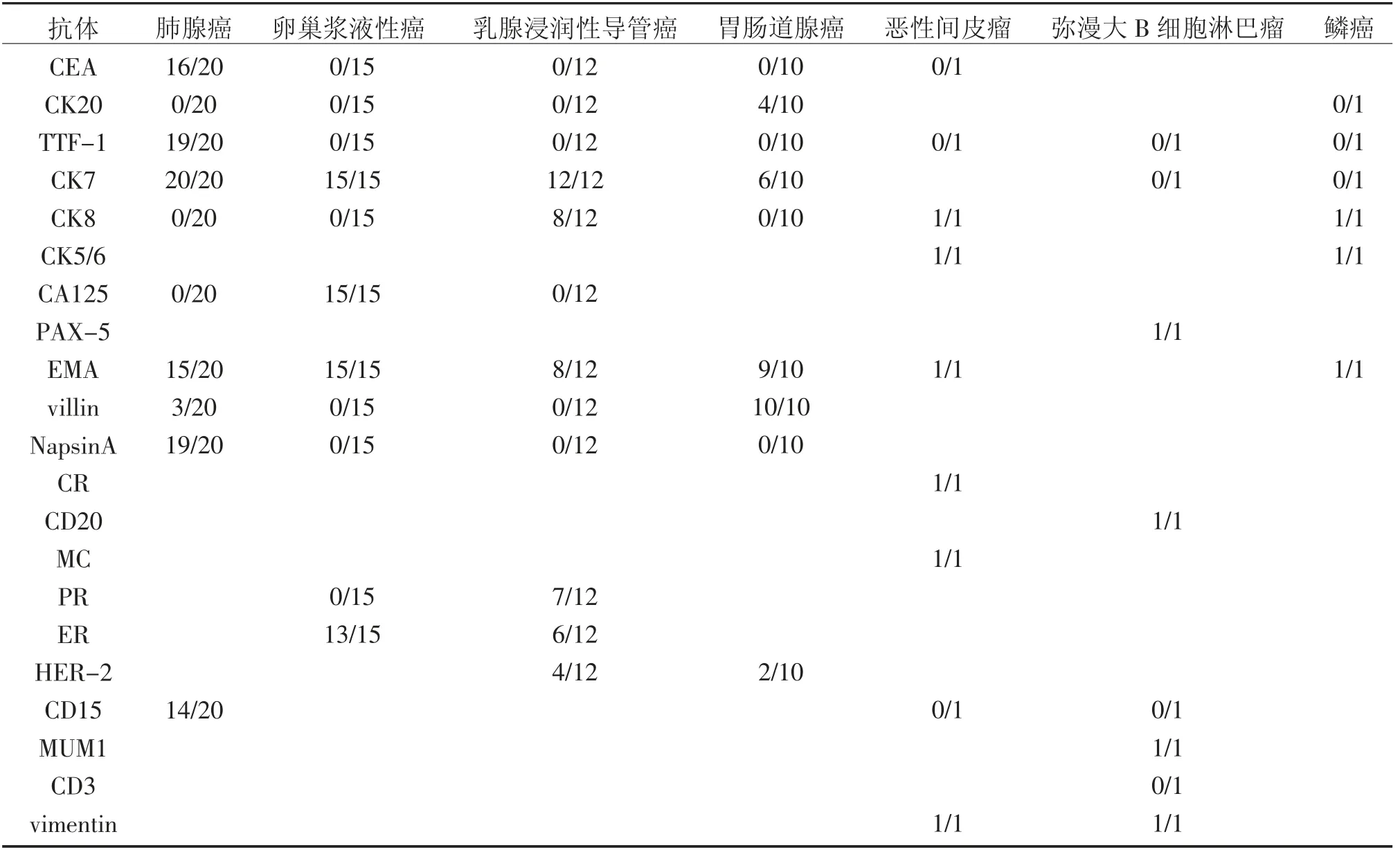
表2 三组患者的恶性肿瘤细胞免疫组化表达(阳性率/总数)
3 讨论
浆膜腔积液属于临床中较为多发的病症之一,有时甚至是唯一的临床症状。对于患者来说早期开展疾病良恶性的鉴别诊断对于预后及疾病的治疗具有较为积极的意义,准确而有效的鉴别诊断技术是提高患者生存质量、延长患者生存时间的重要保证。因此,在临床病理中针对恶性浆膜腔积液患者应给予相应的鉴别诊断操作[4]。
以往一般针对恶性浆膜腔积液患者实施常规细胞学涂片检测及薄层液基细胞技术制片的检测。在病理鉴别诊断的过程中由于常规细胞学涂片的检测过程中可能会由于细胞重叠、细胞排列分散、细胞结构不清晰及细胞数量少等等客观因素的影响增加诊断的难度[5]。而液基薄层细胞技术制片的检测中保存液虽然能很好的固定标本,还能让制作的液基薄片减少甚至消除影响因素,具有背景干净整洁、细胞量聚集、细胞退变较少及细胞平铺排列等等优点。但检测的过程中依旧存在着不确定的病例,具有一定的局限性[6]。相对于常规细胞学检测液基薄层细胞技术制片的检测来说,细胞蜡块切片收集的细胞量较大、分布较为均匀,且不存在重叠现象,结构较为清晰,在组织形态上和组织学切片较为类似,能减少漏诊及误诊现象的出现[7]。此外,细胞蜡块切片的检测还能更好的提高细胞的完整性及切片的数量,提高肿瘤细胞的检出率,还能对其进行免疫组化染色的检测,联合抗体检测能更好的判断肿瘤的来源与分类,并能进行基因检测。免疫组化标志物属于外科组织病理学中最常见的诊断技术之一,能帮助病理诊断中对肿瘤的良恶性、组织的来源及亚型等进行确诊[8]。如在不明来源腺癌的鉴别诊断中可以通过NapsinA、Tg、CK7、TTF-1、villin、CDX-2、ER 、PR、WT-1、CK20、PAX-8、CA125 等等组合明确组织的来源;而对于鳞癌、恶性淋巴瘤等的分类诊断可以通过P63、P40、CK5/6、CD20、CD3、PAX-5、MUM1 等等抗体进行分类诊断[9]。
由此可见,临床病理工作中在对浆膜腔积液恶性肿瘤细胞的鉴别诊断中单独通过某一种检测手段(常规细胞学涂片检查或薄层液基细胞技术制片检查)很难鉴别浆膜腔积液恶性肿瘤的类型及来源,通过细胞蜡块切片结合免疫组化检测的免疫组化标志物的检测能很好的提高恶性肿瘤细胞的检出率,并帮助临床中判断肿瘤细胞的来源和分类,为临床治疗提供参考依据。
