LncRNAMEG8影响结肠癌细胞恶性进展
2021-09-08徐王彦刘忠臣
徐王彦 刘忠臣


摘 要:目的 探究lncRNA MEG8对结肠癌细胞增殖、侵袭和凋亡的作用,阐明其作用机制。方法 利用实时荧光定量PCR(Real Time-Quantitative PCR,RT-qPCR)检测MEG8和miR-1827表达;Western blotting和CCK-8检测蛋白表达和细胞增殖;Transwell和流式细胞术检测细胞侵袭和凋亡;双荧光素酶报告基因试验和RNA免疫沉淀反应(RNA Immunoprecipitation,RIP)验证MEG8与miR-1827结合。结果 MEG8通过结合miR-1827负调控miR-1827表达。与人正常结肠上皮细胞相比,MEG8在结肠癌细胞中表达下调,而miR-1827表达上调。过表达MEG8或干扰miR-1827抑制HT29细胞增殖和侵袭,促进凋亡。沉默miR-1827逆转干扰MEG8诱导的细胞增殖和侵袭上升,凋亡和细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)/ c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)通路活性下降。结论 LncRNA MEG8通过下调miR-1827,促进ERK/JNK通路活性,阻碍结肠癌细胞HT29增殖和侵袭,促进凋亡。
关键词:结肠癌;lncRNA MEG8;miR-1827;增殖;凋亡;侵袭
Abstract:Objective To explore the role of lncRNA MEG8 in the proliferation, invasion and apoptosis of colon cancer cells and the possible molecular mechanisms involved. Methods Real Time-Quantitative PCR (RT-qPCR)was used to detect the expression of MEG8 and miR-1827. Western blotting and CCK-8 assays were used to detect protein levels and cell proliferation. Transwell assay and flow cytometry were performed to measure cell invasion and apoptosis. Dual luciferase reporter gene and RNA Immunoprecipitation (RIP)assays were used to verify the relationship between MEG8 and miR-1827. Results MEG8 negatively regulated miR-1827 expression by binding with miR-1827. MEG8 was down-regulated in colon cancer cells, while miR-1827 was up-regulated, compared with their expression in normal human colon epithelial cells. The overexpression of MEG8 or interference to miR-1827 inhibited HT29 cells proliferation and invasion and promoted their apoptosis,while the silence of miR-1827 would reverse such MEG8-induced effects and decrease the pathway activity of ERK (extracellular regulated protein kinases)/JNK (c-Jun N-terminal kinase). Conclusion LncRNA MEG8 will increase the activity of ERK/JNK pathway with miR-1827 down-regulaed, thereby inhibiting the proliferation and invasion of the HT29 colon cancer cells, and promoting their apoptosis.
Key words:colon cancer; LncRNA MEG8; miR-1827; proliferation; apoptosis; invasion
結直肠癌是世界上第三种最常见的癌症,占人类癌症相关死亡人数的1/10。由于其发展迅速且隐蔽,每年新增结肠癌人数超过12万,死亡率超过33%[1-2]。尽管诊断和治疗策略不断进步,但结肠癌患者的预后在过去十年间未发生显著变化[3]。目前只有少数生物标记物可用于结肠癌的预防,因此,鉴定早期诊断结肠癌的分子标志物具有重要意义。
长非编码RNA(LncRNA)是长度超过200nt但没有蛋白质编码能力的RNA分子。LncRNA可以作为肿瘤中的癌基因或抑癌基因,参与肿瘤增殖、转移、自噬和凋亡等调控[4]5 752。多种lncRNA异常与结肠癌进展密切相关。据报道,与正常结肠组织相比,母系表达基因8(matemally expressed gene 8,MEG8)在结肠癌组织中表达下调,但其参与结肠癌发病的潜在机制尚不清楚[5]。MicroRNA(miRNAs)是一类约22个核苷酸的非编码小RNA,其失调与多种生物学过程,包括细胞增殖,分化和凋亡相关。前人研究表明,miR-1827在结肠癌组织中上调[6]5 107,但其对结肠癌细胞增殖、侵袭及凋亡的作用还有待探究。
本研究主要探讨lncRNA MEG8对结肠癌细胞增殖、侵袭和凋亡的影响,并阐明其涉及的主要分子机制。
1 材料方法
(1)细胞与试剂 NCM460、HT29、CACO2、SW480、HCT116、HEK293T細胞均购自上海生命科学研究院;Magna RIP试剂盒购自美国Millipore公司;NC siRNA、MEG8 siRNA、miR-1827mimic、NC mimic、miR-1827 inhibitor、NC inhibitor均由上海吉玛公司合成;细胞凋亡试剂盒购自中国上海联科生物公司;CCK-8试剂盒购自美国Abcam公司;TRIzol试剂盒购自美国Invitrogen公司;反转录和RT-qPCR试剂盒购自中国大连Takara公司; 总的和磷酸化的细胞外调节蛋白激酶1/2(t-ERK1/2 和p-ERK1/2)、 总的和磷酸化的c-Jun氨基末端激酶(t-JNK和p-JNK)抗体购自美国CST公司;流式细胞仪和酶标仪购自德国Thermo Fisher和美国Bio-Rad公司;凝胶成像仪和CO2细胞恒温培养箱购自美国CARESTREAM Gel Logic和德国Thermo scientific公司。
(2)细胞培养和转染 将NCM460、HT29、CACO2、SW480、HCT116、HEK293T细胞置于含10% 胎牛血清的DMEM培养基中,并于37℃,含5% CO2的恒温培养箱中培养。将细胞接种于6孔板,待密度达到60%,使用LipofectamineTM3000转染试剂按照说明书进行转染。
(3)RNA免疫沉淀反应(RNA Immunoprecipitation,RIP)将HT29细胞裂解液与包含磁珠(磁珠与anti-Ago2或IgG的抗体偶联)的RIP缓冲液在4℃下孵育过夜。用蛋白酶K消化免疫沉淀物以纯化沉淀的RNA,再用qPCR分析免疫沉淀的RNA。
(4)双荧光素酶报告基因试验 使用StarBase v2.0预测MEG8与miR-1827的结合位点。使用psiCHECK-2载体构建野生型和突变型psiCHECK-2-MEG8(MEG8-Wt、MEG8-Mut)载体。将HEK293T细胞接种于24孔板,并将MEG8-Wt(或MEG8-Mut)分别与miR-1827mimic或NC mimic共转染。24h后,按照说明书的操作检测荧光素酶活性。
(5)细胞凋亡 使用Annexin V-FITC /碘化丙啶(PI)凋亡检测试剂盒进行凋亡分析。简言之,细胞处理完成后收集细胞,用PBS洗涤并重悬细胞,随后依次添加5μLAnnexin V-FITC和5μLPI。使用流式细胞仪检测细胞凋亡。
(6)细胞增殖 将处理后的细胞接种于96孔板,并分别培养24、48或72h。在每个时间点添加10μL CCK-8溶液,并将细胞继续孵育2h。使用酶标仪测量450nm处的吸光度值。
(7)细胞侵袭 将人工基底膜涂于Transwell室底膜上腔表面,并置于37℃放置30min。将细胞(2×105个)悬浮于500μL无血清培养基中,并添加到上腔室中。在下腔室中添加含10%胎牛血清的RPMI-1640培养基。温育36h后,将下腔室中的细胞用4%多聚甲醛固定并用结晶紫染色。选择5个随机区域计算侵袭细胞数量并计算平均值。
(8)Western blotting 使用RIPA裂解液提取细胞总蛋白质,使用BCA试剂盒测量蛋白质浓度。通过10%SDS-PAGE分离蛋白质样品,然后电转至PVDF膜。将膜在室温用5%脱脂奶粉封闭
2h后,与稀释后的一抗在4℃孵育过夜。随后将膜与辣根过氧化物酶标记的二抗在室温孵育1h。在ChemiDoc XRS成像系统中检测蛋白质条带。使用Image J软件进行条带灰度分析。
(9)实时荧光定量PCR(Real Time-Quantitative PCR,RT-qPCR)采用TRIzol提取细胞总RNA,进行反转录。使用SYBR PrimeScript RT-PCR试剂盒检测mRNA表达。反应条件设计如下:95℃,3min,进行35个循环,94℃,15s;55℃,25s;72℃,30s。mRNA相对表达通过2-ΔΔCT方法计算。
(10)统计学分析 采用SPSS 22.0软件进行统计分析。测量的数据表示为均数±标准差,组间数据比较采用学生t检验和双向方差分析。P<0.05视为差异有统计学意义。
2 结果
(1)过表达MEG8抑制HT29细胞恶性进展。如图1所示。与人正常肠上皮细胞(NCM460)相比,结肠癌细胞系(HT29,CACO2,SW480,HCT116)中MEG8表达显著下调(P<0.05),如图1(a)所示。与转染Vector相比,在HT29细胞中转染Ad-MEG8后,MEG8的表达显著上调(P<0.01),如图1(b)所示,显示过表达效率较高。与Vector组相比,过表达MEG8后细胞增殖和侵袭显著下降(P<0.05), 如图1(c)~(e)所示,而细胞凋亡显著上升(P<0.05), 如图1(f)~(g)所示。
(2)MEG8与miR-1827结合并下调其表达如图2所示。 与转染NC mimic相比,转染miR- 1827mimic后,MEG8-Wt报告载体荧光素酶活性显著下降(P<0.05),如图1(b)所示,而MEG8-Mut报告载体荧光素酶活性无显著变化。RIP实验结果显示,分别过表达miR-1827和MEG8后,与IgG抗体组相比,Ago2抗体组的MEG8和miR-1827显著富集(P<0.05),如图1(c)所示。与转染Vector相比,在HT29细胞中转染Ad-MEG8显著抑制miR-1827表达(P<0.05),如图1(d)所示。而与转染NC siRNA相比,转染MEG8 siRNA显著促进miR-1827表达(P<0.05),如图1(d)所示。
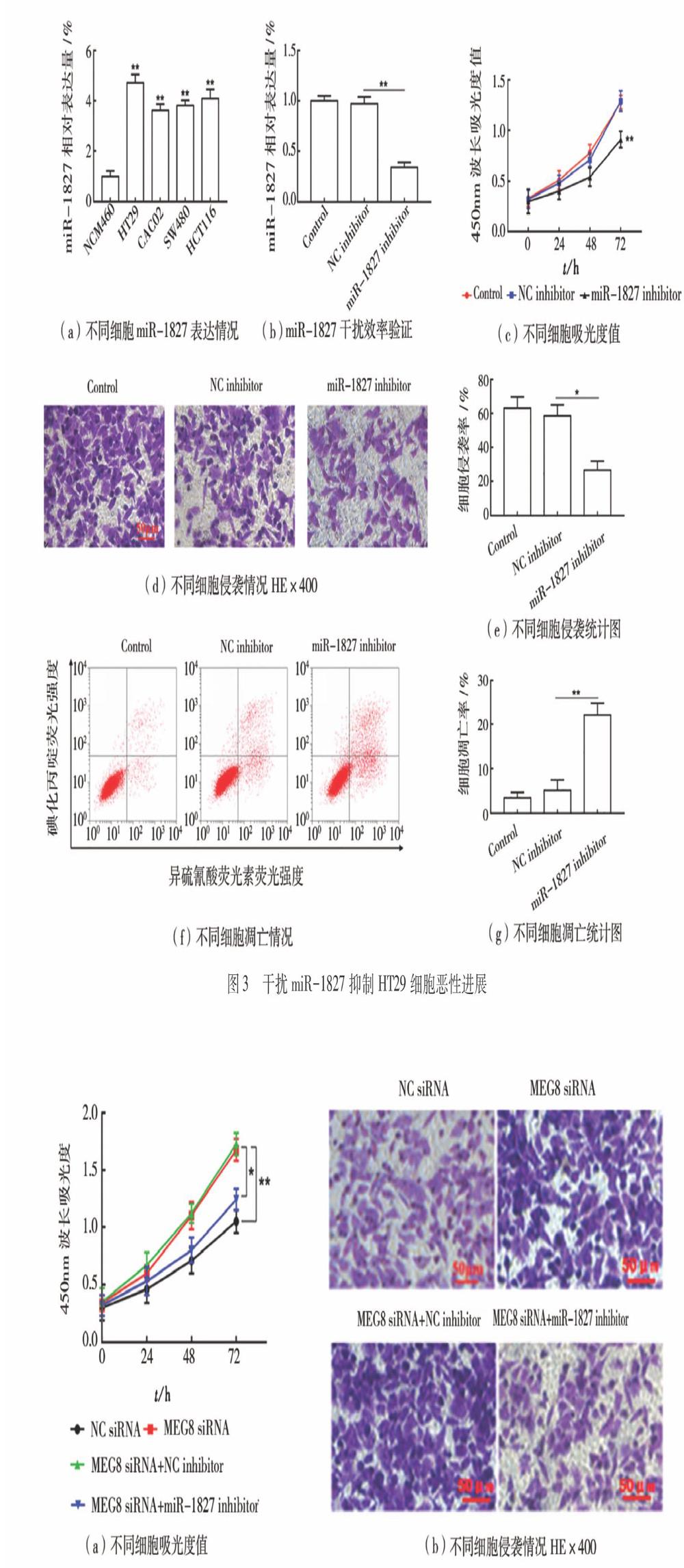
(3)干扰miR-1827抑制HT29细胞恶性进展如图3所示。与人正常肠上皮细胞(NCM460)相比,结肠癌细胞系(HT29,CACO2,SW480,HCT116)中miR-1827表达显著上调(P<0.05),如图3(a)所示。与轉染NC inhibitor相比,在HT29细胞中转染miR-1827 inhibitor显著抑制miR-1827表达(P<0.05),如图3(b)所示,显示干扰效率较高。与NC inhibitor组相比,干扰miR-1827组的细胞增殖和侵袭显著下降(P<0.05),如图3(c)~(e)所示,而细胞凋亡显著上升(P<0.05),如图3(f)~(g)所示。
(4)MEG8通过抑制miR-1827调控HT29细胞进展如图4所示。与转染NC siRNA相比,在HT29细胞中转染MEG8 siRNA显著促进细胞增殖和侵袭(P<0.05),如图4(a)~(c)所示,抑制凋亡(P<0.05),如图4(d)~(e)所示。而与转染MEG8 siRNA+NC inhibitor相比,共转染MEG8 siRNA和miR-1827 inhibitor,细胞增殖和侵袭显著下降(P<0.05),如图4(a)~(c)所示,而凋亡显著上升(P<0.05),如图4(d)~(e)所示。
(5)MEG8通过抑制miR-1827调节ERK/JNK通路活性如图5所示。与转染NC siRNA相比,在HT29细胞中转染MEG8 siRNA显著抑制p-ERK1/2和p-JNK的蛋白质表达(P<0.05),如图5(a)~(c)所示,而t-ERK1/2和t-JNK的蛋白质表达不变。与转染MEG8 siRNA+NC inhibitor相比,共转染MEG8 siRNA和miR1827 inhibitor,p-ERK1/2和p-JNK蛋白质表达显著上升(P<0.05),如图5(a)~(c)所示,而t-ERK1/2和t-JNK的蛋白质表达不变。
3 讨论
结肠癌是一种常见的消化系统癌症,在全球与癌症相关死亡中排名第四[7]。癌细胞的无限增殖和高转移特性导致结肠癌的高死亡率。在2014a和2015a,结肠癌导致约70万人死亡[8]2 007。结肠癌的早期治疗结果通常令人满意,并且大于95%的患者在积极治疗后生存率超过5a[8]2 007。然而,由于其隐蔽和发展迅速的特征,大多数患者在首次诊断时就处于晚期[4]5 752,导致多数患者生存结果较差。结肠癌发生是一个复杂过程,包括遗传和表观遗传学变化。因此,阐明肿瘤发生的分子机制,为早期诊断,预后和治疗评估寻找新的分子标志物意义重大[9]。
LncRNA通过多种机制介导基因表达,包括lncRNA-miRNA相互作用,lncRNA-蛋白质相互作用和lncRNA-mRNA相互作用。前人研究表明,lncRNAs参与各种生物过程调控,包括细胞增殖、侵袭、转移、癌变和癌症进展[10]。多种lncRNA失调与结肠癌进展相关。LncRNA BCAR4通过激活Wnt/β-catenin信号传导途径促进结肠癌肿瘤生长和转移[11]。LncRNA HOTAIR在结肠癌中表达上调,与结肠癌远端转移和不良预后有关[4]5 754。LncRNA MALAT1通过海绵miR-129-5p调控HMGB1促进结肠癌发展[12]。本研究表明,与人正常肠上皮细胞相比,MEG8在结肠癌细胞中表达下调,与文献报道一致。过表达MEG8显著抑制结肠癌细胞系HT29增殖和侵袭,促进凋亡,显示MEG8在结肠癌中作为肿瘤抑制基因,可能作为结肠癌的预测指标。研究还发现,MEG8与miR-1827直接结合,负调控miR-1827的表达,表明MEG8可能通过抑制miR-1827发挥肿瘤抑制作用。
MiRNA通过与mRNAs的3非翻译区结合,在基因表达中发挥转录后调控作用,导致翻译抑制或基因沉默。MiRNA基因只代表人类基因组一小部分,但它们调控几乎1/3的人类基因。研究表明,miRNAs与多种生理病理过程相关, 包括细胞分化、 凋亡、 增殖、 胰岛素分泌、 胆固醇合成和肿瘤生成。MiRNAs与结肠癌进展紧密相关。MiR-144通过下调SMAD4抑制结肠癌生长和转移[13];MiR-192在结肠癌中发挥抑癌作用,辛伐他汀通过激活miR-192抑制癌细胞生长[14];MiR-215抑制低氧诱导的结肠癌干细胞活性[15]。文献[16]报道,MiR-1827通过靶向MYC在肺腺癌中发挥抑癌作用。文献[6]5 108报道,miR-1827通过调控Wnt信号通路,在结肠癌中发挥致癌作用。本研究结果显示,与人正常肠上皮细胞相比,miR-1827在结肠癌细胞中表达上调,与前人研究结果吻合。在HT29细胞中干扰miR-1827,细胞增殖和侵袭下降,而凋亡上升。此外,转染miR-1827 inhibitor逆转沉默MEG8诱导的细胞增殖和侵袭上调,凋亡下降。
越来越多证据表明,ERK/JNK信号通路在结肠癌细胞进展中发挥重要作用。据报道,ERK-JNK信号通路上调通过CC趋化因子配体7和CC趋化因子受体3之间的串扰促进结肠癌细胞转移。衣霉素通过下调ERK-JNK信号通路抑制结肠癌细胞生长和转移[17]。Mahalingam等人证明,在结肠癌中,舒尼替尼通过增强JNK活性,降低凋亡抑制蛋白质水平,促进TRAIL介导的凋亡[18]。本研究数据显示,干扰MEG8显著抑制HT29细胞中p-ERK1/2、p-JNK蛋白质水平。而干扰miR-1827反转MEG8对ERK/JNK通路的作用,表明MEG8和miR-1827对HT29细胞增殖和凋亡的影响很可能通过调控ERK/JNK通路实现。
综上所述,与正常肠上皮细胞相比,MEG8在结肠癌细胞中表达下调,过表达 MEG8抑制HT29细胞增殖和侵袭,促进凋亡。机制研究显示,MEG8可能通过负调控miR-1827,激活ERK/JNK通路,进而调控HT29结肠癌细胞增殖、侵袭和凋亡。此项研究,一定程度上补充了影响结肠癌细胞增殖、侵袭和凋亡的免疫学理论,也为结肠癌免疫治疗方面提供一条潜在的方法。
参考文献:
[1] PASCHKE S,JAFAROV S,STAIB L,et al.Are colon and rectal cancer two different tumor entities? A proposal to abandon the term colorectal cancer[J].Int J Mol Sci,2018,19(9):2 577.
[2] HURTADO CG,WAN F,HOUSSEAU F,et al.Roles for interleukin 17 and adaptive immunity in pathogenesis of colorectal cancer[J].Gastroenterology,2018,155(6):1 706-1 715.
[3] LIU J,DU W.LncRNA FENDRR attenuates colon cancer progression by repression of SOX4 protein[J].OncoTargets Ther,2019,12(1):4 287.
[4] PENG C,ZHAO X,WEI C,et al.LncRNA HOTAIR promotes colon cancer development by down-regulating miRNA-34a[J].Eur Rev Med Pharmacol Sci,2019,23(13):5 752-5 761.
[5] KALMR A,NAGY ZB,GALAMB O,et al.Genome-wide expression profiling in colorectal cancer focusing on lncRNAs in the adenoma-carcinoma transition[J].BMC Cancer,2019,19(1):1 059.
[6] FASIHI A,M.SOLTANI B,ATASHI A,et al.Introduction of hsa-miR-103a and hsa-miR-1827 and hsa-miR-137 as new regulators of Wnt signaling pathway and their relation to colorectal carcinoma[J].J Cell Biochem,2018,119(7):5 104-5 117.
[7] WEI F,WU Y,TANG L,et al.Trend analysis of cancer incidence and mortality in China[J].Sci China Life Sci,2017,60(11):1 271-1 275.
[8] BAI J,XU J,ZHAO J,et al.Downregulation of lncRNA AWPPH inhibits colon cancer cell proliferation by downregulating GLUT-1[J].Oncol Lett,2019,18(2):2 007-2 012.
[9] LEE JJ,CHU E.The adjuvant treatment of stage III colon cancer:might less be more?[J].Oncology,2018,32:437-422.
[10] CUI M,CHEN M,SHEN Z,et al.LncRNA-UCA1 modulates progression of colon cancer through regulating the miR-28-5p/HOXB3 axis[J].J Cell Biochem,2019,120(5):6 926-6 936.
[11] BO H,FAN L,LI J,et al.High expression of lncRNA AFAP1-AS1 promotes the progression of colon cancer and predicts poor prognosis[J].J Cancer,2018,9(24):4 677.
[12] WU Q,MENG WY,JIE Y,et al.LncRNA MALAT1 induces colon cancer development by regulating miR-129-5p/HMGB1 axis[J].J Cell Physiol,2018,233(9):6 750-6 757.
[13] SHENG S,XIE L,WU Y,et al.MiR-144 inhibits growth and metastasis in colon cancer by down-regulating SMAD4[J].Bioscience reports,2019,39(3):1-8.
[14] ZHENG XF,LIU KX,WANG XM,et al.MicroRNA-192 acts as a tumor suppressor in colon cancer and simvastatin activates miR-192 to inhibit cancer cell growth[J].Mol Med Rep,2019,19(3):1 753-1 760.
[15] ULLMANN P,NURMIK M,SCHMITZ M,et al.Tumor suppressor miR-215 counteracts hypoxia-induced colon cancer stem cell activity[J].Cancer Lett,2019,450(1):32-41.
[16] FAN G,XU P,TU P.MiR-1827 functions as a tumor suppressor in lung adenocarcinoma by targeting MYC and FAM83F[J].J Cell Biochem, 2020, 121(2):1 675-1 689.
[17] YOU S,LI W,GUAN Y.Tunicamycin inhibits colon carcinoma growth and aggressiveness via modulation of the ERK-JNK-mediated AKT/mTOR signaling pathway[J].Mol Med Rep,2018,17(3):4 203-4 212.
[18] MAHALINGAM D,CAREW JS,ESPITIA CM,et al.Heightened JNK Activation and Reduced XIAP Levels Promote TRAIL and Sunitinib-Mediated Apoptosis in Colon Cancer Models[J].Cancers,2019,11(7):895.
(責任编辑:丁 寒)
