贵州芸薹黄化病毒的分子检测及基因型鉴定
2021-09-08王莉爽李淳陈小均何海永陈文黄露刘学辉
王莉爽 李淳 陈小均 何海永 陈文 黄露 刘学辉
王莉爽(1985-),副研究員,主要从事植物病害防治研究工作。主持国家自然科学基金地区科学基金项目“辣椒脉黄病毒P0蛋白调控寄主超敏反应介导的细胞死亡分子机制”、贵州省科技支撑计划项目“十字花科蔬菜病毒病发生特点及控制技术研究与示范”、贵州省基础研究计划项目“辣椒新病毒(PeVYV)致病因子筛选及致病性评价”等8项科研项目;作为主要成员参与贵州省重大专项子项目、公益性行业(农业)科研专项及贵州省农业科学院自主创新科研专项等科研项目。在《Plant Disease》《南方农业学报》《园艺学报》等期刊上发表学术论文10余篇;编制2个贵州省地方标准《农作物抗病性鉴定技术规范》第16部分“白菜抗TuMV病毒病”(DB52/T 1501.16─2020)和第17部分“大豆抗病毒病”(DB52/T 1501.17─2020)。
摘要:【目的】对贵州省白菜、萝卜和甘蓝感染芸薹黄化病毒(Brassica yellows virus,BrYV)进行分子检测及基因型鉴定,为马铃薯卷叶病毒属病毒的防治提供理论参考。【方法】在贵州省遵义市、威宁县、关岭县、平坝县等县(市)共采集284份蔬菜(白菜、萝卜和甘蓝)疑似病毒病样品,利用马铃薯卷叶病毒属的通用引物进行RT-PCR分子检测,并对检测出的16个BrYV分离物进行P0和CP基因序列扩增,再与已报道的BrYV基因序列进行比对,从而构建系统发育进化树,鉴定其基因型。【结果】284份疑似病毒病样品中,有43份样品检测出BrYV,检出率为15.14%,其中,感染BrYV白菜样品12份,占白菜总样品数的12.77%;感染BrYV萝卜样品14份,占萝卜总样品数的20.29%;感染BrYV甘蓝样品17份,占甘蓝总样品数的14.05%。贵州16个BrYV分离物P0基因核苷酸序列的相似性为89.9%~100.0%,CP基因核苷酸序列的相似性为93.5%~100.0%,二者编码的氨基酸序列相似性均为100.0%。基于P0基因构建的系统发育进化树可知,BrYV-Pingba-BC-2、BrYV-Zunyi-LB-1和BrYV-Zhijing-BC-1均与BrYV-BJS和BrYV-BBJ聚为一类,其余13个分离物均与BrYV-ABJ和BrYV-AJS聚为一类。基于CP基因构建的系统发育进化树可知,贵州不同地区不同蔬菜作物的16个BrYV分离与BrYV-A和BrYV-B基因型无明显分界,亲缘关系均较近。BrYV P0基因检测到5个重组事件,BrYV CP基因未检测到潜在重组事件。【结论】BrYV在贵州白菜、萝卜和甘蓝上普遍发生,但对萝卜的危害最重,主要存在BrYV-A和BrYV-B 2种基因型。
关键词: 芸薹黄化病毒(BrYV);十字花科蔬菜;基因型鉴定;分子检测;系统进化
中图分类号: S436.3 文献标志码: A 文章编号:2095-1191(2021)05-1149-09
Abstract:【Objective】Molecular detection and genotype identification of Brassica yellows virus (BrYV) infection in Chinese cabbage,radish and cabbage in Guizhou were conducted to provide reference for control of potato leaf curl virus. 【Method】284 samples of vegetable(Chinese cabbage,radish and cabbage) virus diseases were collected in Zunyi,Wei-ning, Guanling, Pingba and other cities(counties) in Guizhou. RT-PCR molecular detection using the common primers of potato leaf curl virus was conducted and P0 and CP gene sequences amplification was conducted with the 16 BrYV isolates detected, then compared to the reported BrYV gene sequences. Phylogenetic tree was constructed and its genotype was identified. 【Result】BrYV was detected in 43 suspected samples out of 284 virus disease samples,and the positive rate was 15.14%. Among them,there were 12 BrYV infected samples in cabbage samples,accounting for 12.77% of the total number of cabbage samples; 14 BrYV infected samples in radish samples,accounting for 20.29% of the total number of radish samples; 17 BrYV infected samples in cabbage samples,accounting for 14.05% of the total number of cabbage samples. The nucleotide similarity of P0 gene and CP gene of 16 BrYV isolates were 89.9%-100.0% and 93.5%-100.0%,respectively. The consistency of amino acids sequence was 100.0%. Phylogenetic tree based on P0 gene showed that,BrYV-Pingba-BC-2,BrYV-Zunyi-LB-1,BrYV-Zhijing-BC-1,BrYV-BJS and BrYV-BBJ were clustered into one branch,and the other 13 isolates were clustered into one branch with BrYV-ABJ and BrYV-AJS. There was no obvious boundary between 16 BrYV isolates and BrYV-A and BrYV-B genotypes from different vegetable crops in different areas of Guizhou according to Phylogenetic tree based on CP gene, and the genetic relationships were all relatively close. Five recombination events were detected in BrYV P0 gene and no potential recombination events were detected in BrYV CP gene. 【Conclusion】 BrYV is prevalent in Chinese cabbage,radish and cabbage in Guizhou,but the damage radish is the most serious, there are two genotypes of BrYV-A and BrYV-B.
Key words:Brassica yellows virus;Cruciferous vegetables;genotype identification; molecular detection; phyletic evolution
Foundation item:Guizhou Science and Technology Support Plan Project(QKHZC〔2017〕2576); Guizhou Basic Research Plan Project(QKHJC〔2017〕1183); Youth Science and Technology Project of Guizhou Academy of Agricultural Sciences(〔2020〕01)
0 引言
【研究意义】白菜、萝卜和甘蓝属于十字花科蔬菜,是贵州常年广泛种植的蔬菜作物,种植面积较大。贵州地处云贵高原,具有低纬度、高海拔、强日照、温差大等多样化的区域气候,但由于近年来十字花科蔬菜品种的引进和栽培管理方式的变更,致使十字花科蔬菜病毒病的发生危害日益严重。十字花科蔬菜感染病毒后主要表现为黄化,叶片畸形或斑驳症状,严重影响蔬菜作物的品质和产量。目前,我国十字花科蔬菜作物上检测出的病毒有芜菁花叶病毒(Turnip mosaic virus,TuMV)、黄瓜花叶病毒(Cucumber mosaic virus,CMV)、芸薹黄化病毒(Brassica yellows virus,BrYV)等14种病毒(吴斌等,2018;刘勇等,2019)。在我国34个省(自治区、直辖市)中,有21个地区种植的十字花科蔬菜作物上均检测出BrYV,表明该病毒在我国的发生分布十分广泛(彭艳梅等,2015)。BrYV属于黄症病毒科(Luteoviridea)马铃薯卷叶病毒属(Polerovirus)的一种新发现病毒,在中国、韩国和日本均有报道,主要侵染十字花科植物,包括卷心菜、芥菜、大白菜、花椰菜、萝卜、油菜、芜菁甘蓝、烟草等作物,其在自然条件下由蚜虫以持久循回非增殖的方式传播,仅限于感染韧皮部(Xiang et al.,2011;Lim et al.,2015;Wang et al.,2015,2019)。因此,开展BrYV分子检测及基因型鉴定对了解该病毒病的发生危害情况和遗传变异特点具有重要意义。【前人研究进展】BrYV最早在我国北京地区具有黄化症状的白菜和甘蓝上检测鉴定出(Xiang et al.,2011)。据研究报道,BrYV基因组包含6个开放阅读框(ORF),分别编码P0、P1、P1-P2、P3、P4和P5等6个蛋白(Zhang et al.,2014),其中,P0蛋白是病毒的致病因子和沉默抑制子(Pfeffer et al.,2002),ORF1和ORF2通过移码产生P1-P2融合蛋白,携带病毒RNA依赖性RNA聚合酶(RNA-dependent RNA-polymerase,RdRp)结构域;P3是外壳蛋白(Coat protein,CP);P4是运动蛋白(Movement protein,MP);P5蛋白与病毒载体传播和韧皮部限制有关(Peter et al.,2009)。通过构建BrYV和其他马铃薯卷叶病毒属病毒的各基因系统发育进化树发现,BrYV的P0和P1-P2基因与TuYV的P0和P1-P2基因聚为一类,BrYV的P3和P5基因与马铃薯卷叶病毒属其他所有病毒的P3和P5基因聚为一大类,但与TuYV分支较近。因此,BrYV与TuYV的亲缘关系较近,但也存在明显差异(Xiang et al.,2011)。BrYV和马铃薯卷叶病毒属其他病毒的外壳蛋白氨基酸序列差异为7.9%~9.4%,与P0、P1、P1-P2、P4和P5的氨基酸序列差异均大于10.0%,且根据BrYV基因组长度和序列差异,该病毒为一个独特的物种,含有2种基因型(BrYV-A和BrYV-B),尤其是基因组的5'末端有差异(Xiang et al.,2011)。随后在甘蓝和萝卜上又鉴定获得一种新的基因型BrYV-C,2个BrYV-C分离物的基因组全长序列与BrYV-A和BrYV-B的同源性为93.4%~94.8%,其系统进化分析结果显示,BrYV-C分离物中除P5蛋白以外的其他蛋白形成了一个不同于BrYV-A和BrYV-B分离物的新亚群(Zhang et al.,2014)。为快速鉴定出BrYV 3种基因型,建立了能同时检测和鉴别BrYV 3种基因型的方法——多重逆转录聚合酶链反应(mRT-PCR)(Zhang et al.,2016)。前人除鉴定BrYV基因型外,还利用侵染性cDNA克隆侵染植物进行反向遗传研究,结果发现在花椰菜花叶病毒35S启动子的控制下,构建了BrYV-A、BrYV5B3A和BrYV-C的全长cDNA的侵染性克隆,并利用这些cDNA侵染性克隆建立烟草农杆菌接种体系(Zhang et al.,2015)。病毒基因组的重组现象较常见,从韩国大白菜上鉴定获得重组BrYV基因组序列(BrYV-Cheongsong),其编码的氨基酸序列与中国BrYV-A(HQ388350)基因组编码的氨基酸同源性为94%(Lim et al.,2015)。为了解BrYV的致病性及其与寄主之间的相互作用,将BrYV的基因组序列转入拟南芥中,并对转基因植株和野生型植株进行全基因转录组分析,结果发现BrYV可诱导拟南芥产生紫叶症状,该症状的产生与花青素生物合成激活密切相关(Chen et al.,2018)。本氏煙中Rubisco组装因子2(NbRAF2)对BrYV-A感染具有抗病毒活性,BrYV-A P0BrA与NbRAF2相互作用,改变其定位模式,促进病毒感染(Sun et al.,2018)。BrYV的P0是抑制局部和系统RNA沉默的强病毒沉默抑制子,P0通过与植物的SKP1相互作用抵抗蛋白酶体和自噬途径的降解,从而促进植物体内P0的稳定性(刘勇等,2019)。【本研究切入点】BrYV已成为危害十字花科蔬菜的主要病毒之一,虽然BrYV在病毒基因型分类和基因功能等方面有研究报道,但对不同地区不同作物上BrYV遗传变异分析的相关研究较少。本研究前期调查发现BrYV已成为侵染危害贵州白菜、萝卜和甘蓝的主要病毒之一,但目前对贵州BrYV的分子检测及基因型鉴定的研究鲜见报道。【拟解决的关键问题】采用RT-PCR方法对疑似病毒病的十字花科样品进行分子鉴定,明确BrYV在贵州的发生,并对白菜、萝卜和甘蓝BrYV分离物的P0和CP基因序列进行分析,探明BrYV的遗传变异,为抗BrYV的十字花科蔬菜品种选育和制定BrYV防控措施提供科学的理论基础。
1 材料与方法
1. 1 试验材料
采集贵州省遵义市、威宁县和关岭县等不同县(市)的具有病毒病症状如花叶、黄化等的萝卜叶片样品。用锡箔纸包裹后液氮速冻,置于-80 ℃超低温冰箱中保存备用。主要试剂:TransZol Up Plus RNA Kit、TransScript? II All-in-One First-Strand cDNA Synthesis SuperMix for PCR试剂盒、EasyPure Quick Gel Extraction Kit和pEASY1-Blunt Simple Cloning Kit购自北京全式金生物技术有限公司。PCR产物送至重庆擎科兴业生物技术有限公司进行测序。主要仪器设备:PCR仪(Bio-Rad,美国)、iBrightTM 1000系列成像系统(Invitrogen,美国)、2010 Geno/Grinder高通量动植物组研磨机(SPEX,美国)。
1. 2 试验方法
1. 2. 1 总RNA提取及cDNA合成 参照TransZol Up Plus RNA Kit說明书提取总RNA,并置于-80 ℃保存。以提取的RNA为模板,用TransScript? II All-in-One First-Strand cDNA Synthesis SuperMix for PCR反转录合成cDNA第一链,反应体系20.0 μL:5×TransScript? II All-in-One SuperMix for PCR 4.0 μL,总RNA模板2.0 μL,RNase-free Water 14.0 μL。轻轻混匀,25 ℃孵育10 min后,50 ℃孵育30 min,85 ℃加热5 s失活。然后以cDNA为模板进行PCR扩增。反应体系50.0 μL:10×EasyTaq? Buffer 5.0 μL,正、反向引物(10 μmol/L)1.0 μL,2.5 mmol/L dNTPs 4.0 μL,EasyTaq? DNA聚合酶1.0 μL,Nuclease-free Water 38.0 μL。扩增程序:94 ℃预变性5 min,94 ℃ 30 s,52 ℃ 30 s,72 ℃ 40 s,进行35个循环,72 ℃延伸5 min,4 ℃保存。
1. 2. 2 十字花科蔬菜病毒病检测 利用马铃薯卷叶病毒属的通用引物PoconF和PocoCPR(PoconF:5'-GAYTGYTCYGGTTTTGACTGG-3';PocoCPR:5'-CGTCTACCTATTTSGGRTTN-3')(Xiang et al.,2011),疑似病毒病样品进行RT-PCR检测,有目的条带样品测序,获得序列在NCBI数据库上进行比对分析。
1. 2. 3 基因克隆及分析 利用已检测出的阳性材料对BrYV的P0和CP基因全长进行克隆,PCR扩增引物为BrYV-P0-F:5'-ATGCAATTTGTAGCTCACG AC-3';BrYV-P0-R:5'-TCATACAAACATTTCGGTG TAGACC-3'。BrYV-CP-F:5'-ATGAATACGGTCGT GGGTAGGAGAAC-3';BrYV-CP-R:5'-CTATTTGG GATTATGGAATTGACAC-3'。将PCR产物进行1%琼脂糖凝胶电泳后,切割下目的片段进行回收、连接并转化至大肠杆菌DH5a感受态细胞,选取阳性克隆送至重庆擎科兴业生物技术有限公司测序。利用BioEdit 5.0和DNAMAN 6.0对测序所得序列进行亲缘关系比较分析;采用MEGA 7.0以邻接法构建系统发育进化树,以Bootstrap(1000次重复)检验各分支置信度;运用RDP4进行序列重组分析。
2 结果与分析
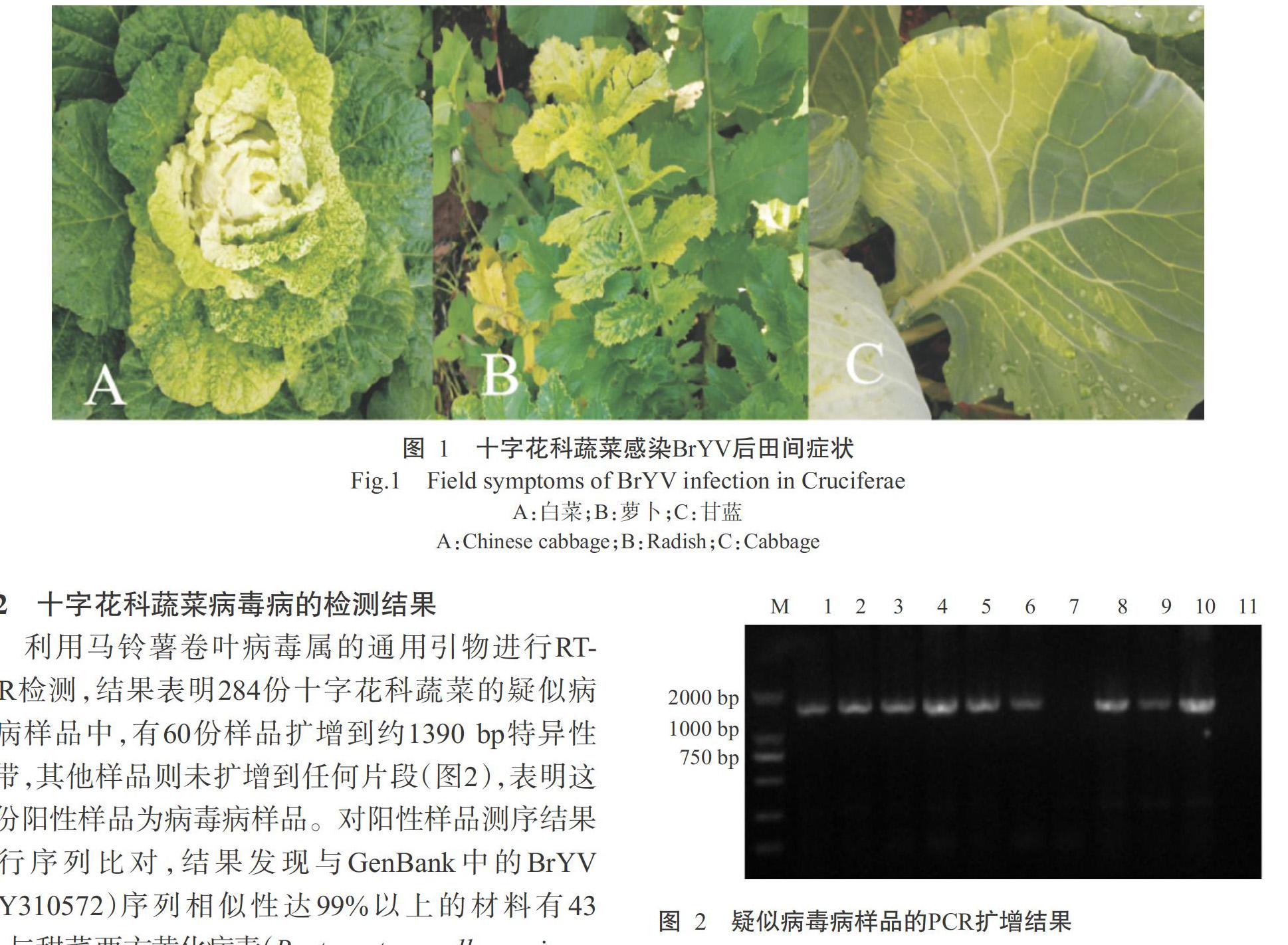
2. 1 BrYV感染田间症状观察
白菜、萝卜和甘蓝感染BrYV后,叶片出现褪绿斑,黄绿相间不均,或外围叶片沿叶脉逐渐变黄,心叶出现花叶症状(图1)。
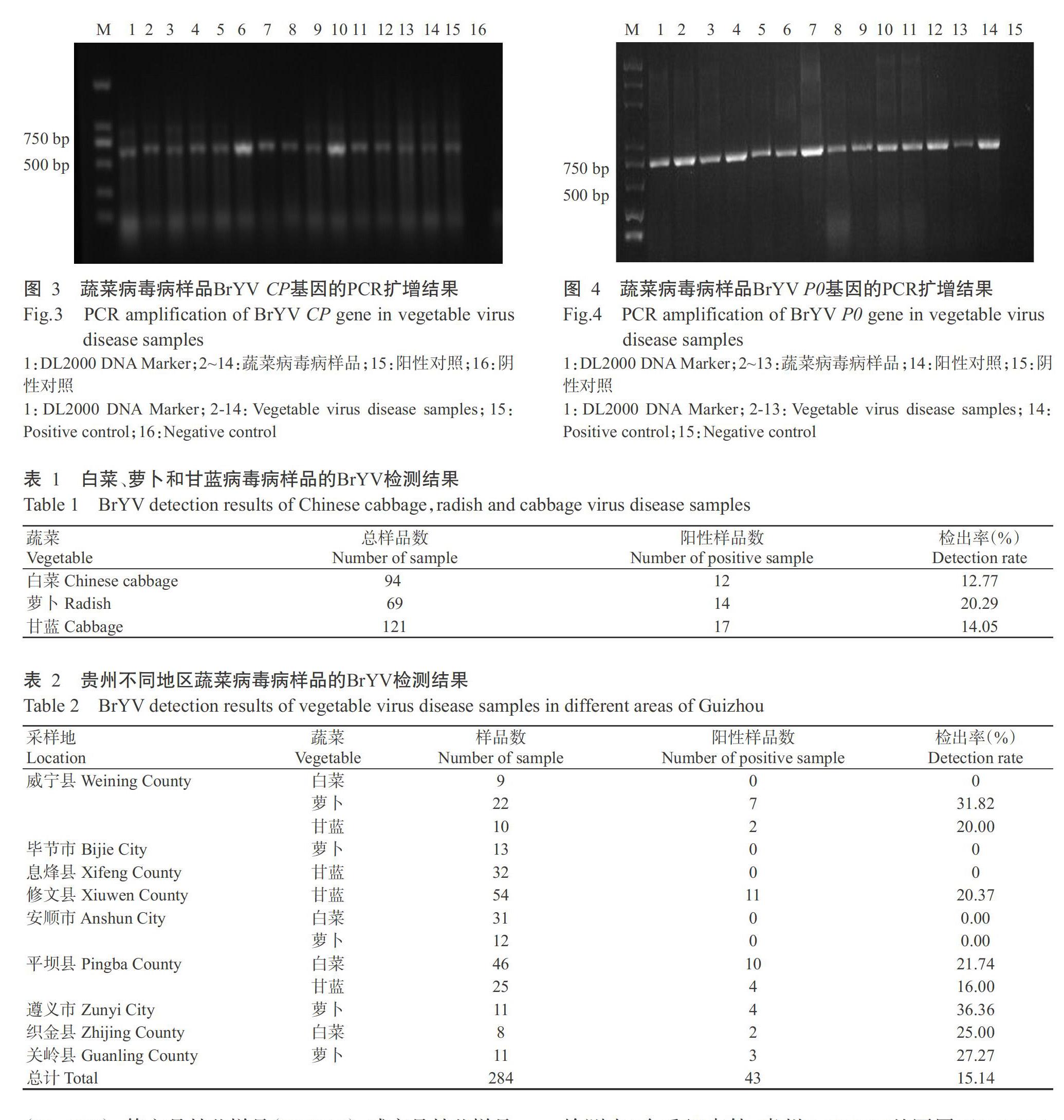
2. 2 十字花科蔬菜病毒病的检测结果
利用马铃薯卷叶病毒属的通用引物进行RT-PCR检测,结果表明284份十字花科蔬菜的疑似病毒病样品中,有60份样品扩增到约1390 bp特异性条带,其他样品则未扩增到任何片段(图2),表明这60份阳性样品为病毒病样品。对阳性样品测序结果进行序列比对,结果发现与GenBank中的BrYV(KY310572)序列相似性达99%以上的材料有43份,与甜菜西方黄化病毒(Beet western yellows virus,BWYV)(HM804471)序列相似性达98%以上的材料有17份,表明扩增获得的片段为马铃薯卷叶病毒属病毒特异基因片段。由此推测侵染贵州十字花科蔬菜的病毒主要为BrYV和BWYV。
2. 3 BrYV P0和CP基因克隆及样品检测结果
采用RT-PCR扩增BrYV P0和CP基因全长,经回收、连接和转化,测序结果显示P0基因长度为750 bp,CP基因长度为609 bp。由图3和图4可知,上述鉴定为蔬菜病毒病的样品均扩增出P0和CP基因,未检测出病毒的样品则未扩增出任何条带。284份疑似病毒病样品(白菜94份、萝卜69份和甘蓝121份)中,共有43份样品感染BrYV,占总样品数的15.14%,其中感染BrYV的白菜样品12份,占白菜总样品数的12.77%;感染BrYV的萝卜样品14份,占萝卜总样品数的20.29%;感染BrYV的甘蓝样品17份,占甘蓝总样品数的14.05%(表1)。按采集蔬菜样品地区BrYV的检出率由高到低分别是遵义市萝卜病毒病样品(36.36%)>威宁县萝卜样品(31.82%)>关岭县萝卜样品(27.27%)>织金县白菜样品(25.00%)>平坝县白菜样品(21.74%)>修文县甘蓝样品(20.37%)>威宁县甘蓝样品(20.00%)>平坝县甘蓝样品(16.00%)(表2)。综上可知,BrYV对萝卜的危害最重,其次是白菜,对甘蓝的危害最轻。
2. 4 BrYV P0和CP基因序列比较结果
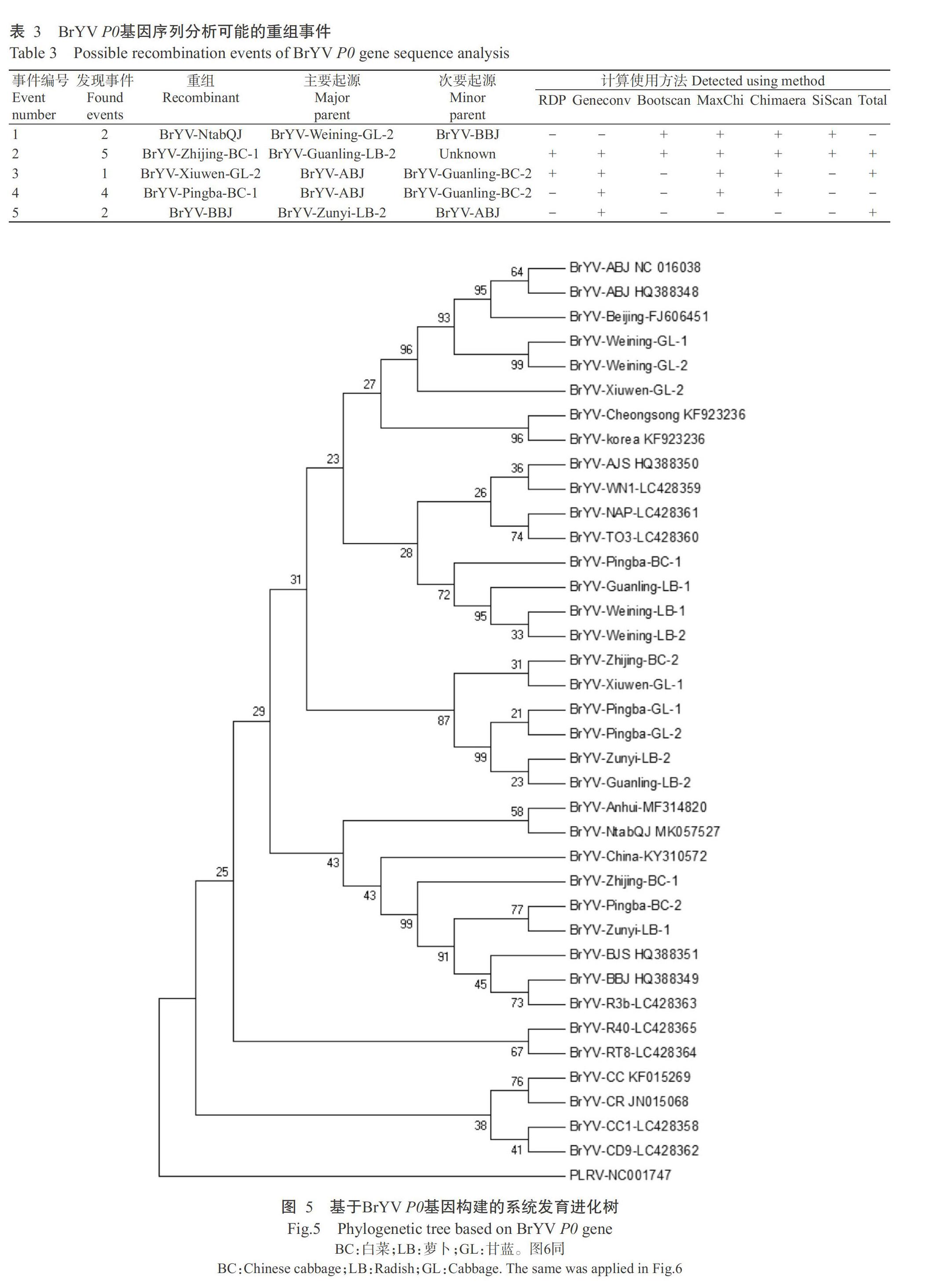
从不同采集地的白菜、萝卜和甘蓝病毒病样品中,选取16个BrYV贵州分離物与已报道的BrYV的 3个基因型的P0和CP基因序列进行比对分析,结果显示P0基因核苷酸相似性为89.9%~100.0%,其编码的氨基酸相似性均为100.0%;CP基因核苷酸相似性为93.5%~100.0%,其编码的氨基酸相似性均为100.0%。从基因重组分析结果可知,BrYV P0基因共检测出5个重组事件,贵州BrYV P0基因属于BrYV-A和BrYV-B基因型;BrYV CP基因未检测到潜在重组事件。可见,贵州不同地区不同蔬菜作物BrYV的P0基因发生明显重组,CP基因无明显重组(表3)。
2. 5 BrYV P0和CP基因序列系统进化分析结果
由系统发育进化树(图5)可知,威宁县、关岭县和遵义县的6个BrYV萝卜分离物P0基因,威宁县、平坝县和修文县的6个BrYV甘蓝分离物P0基因,以及平坝县和织金县的4个BrYV白菜分离物P0基因,分别与已报道的BrYV分离物聚为一大类,其中,BrYV-Pingba-BC-2、BrYV-Zunyi-LB-1和BrYV-Zhijing-BC-1均与BrYV-BJS和BrYV-BBJ聚为一类;BrYV-Zhijing-BC-2、BrYV-Xiuwen-GL-1、BrYV-Xiuwen-GL-2,BrYV-Guanling-LB-2、BrYV-Pingba-GL-1、BrYV-Pingba-GL-2、BrYV-Zunyi-LB-2、BrYV-Weining-GL-1、BrYV-Weining-GL-2、BrYV-Weining-LB-1、BrYV-Weining-LB-2、BrYV-Guanling-LB-1和BrYV-Pingba-BC-1等13个分离物均与BrYV-ABJ和BrYV-AJS聚为一类。综上所述,贵州不同地区不同蔬菜作物上BrYV分离物属于BrYV-A和BrYV-B 2种基因型,侵染甘蓝的BrYV为BrYV-A基因型,侵染白菜和萝卜的BrYV为BrYV-A和BrYV-B基因型,以BrYV-A为优势株系。从地理分布来看,BrYV-A和BrYV-B的地域差异不明显。
由系统发育进化树(图6)可知,威宁县、关岭县和遵义市的6个BrYV萝卜分离物CP基因,威宁县、平坝县和修文县的6个BrYV甘蓝分离物CP基因,以及平坝县和织金县的4个BrYV白菜分离物CP基因,分别与已报道的BrYV分离物聚为一类,其中BrYV-Pingba-BC-2与BrYV-China(KY310572)的亲缘关系较近;BrYV-Weining-LB-1与BrYV-Cheongsong亲缘关系较近;BrYV-Pingba-BC-1、BrYV-Pingba-GL-1、BrYV-Zunyi-LB-1、BrYV-Zhijing-BC-1、BrYV-Zhijing-BC-2、BrYV-Weining-GL-1、BrYV-Weining-GL-2、BrYV-Weining-LB-2、BrYV-Xiuwen-GL-1等9个分离物聚为一类,该类与BrYV-ABJ(NC016038)、BrYV-ABJ(HQ388348)、BrYV-BBJ(HQ388349)和BrYV-SA(MH427277)亲缘关系较近;BrYV-Xiuwen-GL-2、BrYV-Pingba-GL-2、BrYV-Zunyi-LB-2、BrYV-Guanling-LB-1和BrYV-Guanling-LB-2等5个分离物聚为一类,该类与BrYV-BJS(HQ388351)亲缘关系较近。综上所述,贵州不同地区不同蔬菜作物的16个BrYV分离与BrYV-A和BrYV-B基因型无明显分界,亲缘关系均较近。
3 讨论
已有大量研究人员采用分子生物学方法对我国许多地区十字花科蔬菜的病毒种类进行鉴定,如袁伟玲等(2015)对湖北广水萝卜病毒病进行分子鉴定,结果发现其主要感染病毒为蚕豆萎蔫病毒(Broad bean wilt virus,BBWV)、TuMV和CMV,其中约25%的样本是由2种或2种以上的病毒复合侵染;刘欢等(2017)对我国西北地区陕西省和甘肃省大白菜病毒病进行分子鉴定,结果发现其主要感染病毒为烟草花叶病毒(Tobacco mosaic virus,TMV)、CMV和TuMV;叶艳英等(2012)研究的山东甘蓝、廖一鸣(2018)研究的沈阳萝卜及熊艳等(2018)研究的重庆萝卜主要感染病毒的优势毒源均为TuMV。但目前对BrYV基因组编码蛋白的序列分析鲜见报道。本课题组前期研究(王莉爽等,2015)发现,侵染贵州十字花科蔬菜的病毒仅为CMV和TuMV。由于蔬菜引进和气候环境的变化,蔬菜病毒病的种类发生了变化,因此本研究利用马铃薯卷叶病毒属的通用引物对贵州的白菜、萝卜和甘蓝疑似病毒病样品进行检测,共检测出BrYV和BWYV 2种病毒,但仅对检出率较高的BrYV P0和CP基因序列进行扩增研究,因此,病毒病症状明显的样品中是否还存在其他病毒种类有待鉴定。
本研究根据BrYV P0和CP基因序列比对及其系统进化分析结果,可将16个BrYV分离物P0基因分为BrYV-A和BrYV-B 2种基因型,表明贵州白菜、萝卜和甘蓝BrYV分离物可能来自于不同毒源的不同变异株;16个BrYV分离物CP基因与BrYV-A和BrYV-B基因型无明显分界,亲缘关系均较近。综上所述,贵州BrYV分离物的P0和CP基因均与BrYV-A和BrYV-B聚在一起,表明贵州不同地区的白菜、萝卜和甘蓝BrYV分离物存在BrYV-A和BrYV-B 2种基因型。基因重组是病毒变异的重要因素,本研究对16个BrYV分离物进行基因重组分析,结果发现P0基因检测出5个潜在重组事件,CP基因未检出重组事件;但其他区段是否存在基因重组事件,还需进行全基因组序列分析。
BrYV是近年来发现的侵染十字花科作物的一种新病毒,其基因型致病性、分布和寄主范围仍有待确定。根据BrYV基因组5'端序列的差异性,将其主要分为3种基因型,即BrYV-A、BrYV-B和BrYV-C(Xiang et al.,2011;Zhang et al.,2014)。本研究基于BrYV的P0和CP基因序列系统进化分析结果对贵州省6个县(市)白菜、萝卜和甘蓝BrYV分离物进行基因型鉴定,但由于受样品数量、地域及采集时间的限制,对于BrYV-A和BrYV-B基因型在贵州省是否存在其他寄主,有待进一步研究。为更好地了解BrYV的3种基因型的流行学信息,有必要对贵州不同地区不同蔬菜作物的3种BrYV基因型进行鉴定,为该病害的防控打下基础。
4 结论
BrYV在贵州白菜、萝卜和甘蓝上普遍发生,但对萝卜的危害最重,主要存在BrYV-A和BrYV-B 2种基因型。
参考文献:
廖一鸣. 2018. 沈阳和盖州地区萝卜病毒病的分子检测与鉴定[D]. 沈阳:沈阳大学. [Liao Y M. 2018. Detection and identification of radish virus disease in Shenyang and Gaizhou[D]. Shenyang:Shenyang University.]
刘欢,李春游,刘斐,郝兴安,吴云锋. 2017. 3种大白菜病毒多重RT-PCR检测技术的建立[J]. 西北农林科技大学学报(自然科学版),45(9):109-115. doi:10.13207/j.cnki.jnwafu.2017.09.015. [Liu H,Li C Y,Liu F,Hao X A,Wu Y F. 2017. Simultaneous detection of three viruses infec-ting Chinese cabbage by multiplex RT-PCR[J]. Journal of Northwest A & F University(Natural Science Edition),45(9):109-115.]
刘勇,李凡,李月月,张松柏,高希武,谢艳,燕飞,张安盛,戴良英,程兆榜,丁銘,牛颜冰,王升吉,车海彦,江彤,史晓斌,何自福,吴云锋,张德咏,青玲,严婉荣,杨学辉,汤亚飞,郑红英,唐前君,章松柏,章东方,蔡丽,陶小荣. 2019. 侵染我国主要蔬菜作物的病毒种类、分布与发生趋势[J]. 中国农业科学,52(2):239-261. doi:10.3864/j.issn.0578-1752.2019.02.005. [Liu Y,Li F,Li Y Y,Zhang S B,Gao X W,Xie Y,Yan F,Zhang A S,Dai L Y,Cheng Z B,Ding M,Niu Y B,Wang S J,Che H Y,Jiang T,Shi X B,He Z F,Wu Y F,Zhang D Y,Qing L,Yan W R,Yang X H,Tang Y F,Zheng H Y,Tang Q J,Zhang S B,Zhang D F,Cai L,Tao X R. 2019. Identification,di-stribution andoccurrence of viruses in the main vegetables of China[J]. Scientia Agricultura Sinica,52(2):239-261.]
彭艳梅,张晓艳,王颖,向海英,张宗英,李大伟,于嘉林,韩成贵. 2015. 芸薹黄化病毒三种基因型在我国的发生分布检测[C]//中国植物病理学会会议论文集. 海口:中国植物病理学会. [Peng Y M,Zhang X Y,Wang Y,Xiang H Y,Zhang Z Y,Li D W,Yu J L,Han C G. 2015. Detection of three genotypes of Brassica yellow virus in China [C]//Proceedings of the Conference of the Chinese Society of Plant Pathology. Haikou:The Chinese Society of Plant Pathology.]
王莉爽,陈小均,陈文,谭清群,杨学辉. 2015. 贵州蔬菜病毒病主要病毒种类检测[J]. 广东农业科学,42(20):63-67. doi:10.3969/j.issn.1004-874X.2015.20.012. [Wang L S,Chen X J,Chen W,Tan Q Q,Yang X H. 2015. Detection of main viral species of vegetable virus deseases in Guizhou[J]. Guangdong Agricultural Sciences,42(20):63-67.]
吴斌,张眉,姜珊珊,张安盛,崔汉青,辛志梅,马立平,王升吉. 2018. 大白菜、萝卜芜菁花叶病毒系统进化及CP序列分析[J]. 山东农业科学,50(8):100-105. doi:10.14083/j.issn.1001-4942.2018.08.021. [Wu B,Zhang M,Jiang S S,Zhang A S,Cui H Q,Xin Z M,Ma L P,Wang S J. 2018. Phylogenetic evolution and CP nucleotide sequence analysis of TuMV in Chinese cabbage and radish[J]. Shandong Agricultural Sciences,50(8):100-105.]
熊艳,孙淼,向华丰,王鹤冰,张洪成,青玲. 2018. 重庆市萝卜芜菁花叶病毒的检测与序列分析[J]. 植物保护学报,45(3):432-438. doi:10.13802/j.cnki.zwbhxb.2018.2016188. [Xiong Y,Sun M,Xiang H F,Wang H B,Zhang H C,Qing L. 2018. Detection and sequence analysis of CP gene of Turnip mosaic virus(TuMV) infecting radish plants in Chongqing City[J]. Journal of Plant Protection,45(3):432-438.]
叶艳英,曾钢,闫晓红,马荣才,吴才君,姚磊. 2012. 芜菁花叶病毒萝卜与甘蓝分离物P3基因的克隆与序列分析[J]. 江西农业大学学报,34(2):264-269. doi:10.3969/j.issn. 1000-2286.2012.02.012. [Ye Y Y,Zeng G,Yan X H,Ma R C,Wu C Q,Yao L. 2012. Cloning and sequence analysis of P3 gene of Turnip mosaic virus isolates from Brassica and Raphanus[J]. Acta Agriculturae Universitatis Jiangxiensis,34(2):264-269.]
袁偉玲,袁尚勇,甘彩霞,崔磊,邓晓辉. 2015. 湖北广水萝卜病毒病的分子鉴定与防治[J]. 长江蔬菜,(8):61-62. doi:10.3865/j.issn.1001-3547.2015.08.021. [Yuan W L,Yuan S Y,Gan C X,Cui L,Deng X H. 2015. Molecular identification and prevention of radish virus disease in Guangshui of Hubei Province[J]. Journal of Changjiang Vegetables,(8):61-62.]
Chen X R,Wang Y,Zhao H H,Zhang X Y,Wang X B,Li D W,Yu J L,Han C G. 2018. Brassica yellows virusmovement protein upregulates anthocyanin accumulation,lea-ding to the development of purple leaf symptoms,on Arabidopsis thaliana[J]. Scientific Reports,8(1):16273. doi:10.1038/s41598-018-34591-5.
Lim S,Yoo R H,Igori D,Zhao F,Kim K H,Moon J S. 2015. Genome sequence of a recombinant Brassica yellows virus infecting Chinese cabbage[J]. Archives of Virology,160(2):597-600. doi:10.1007/s00705-014-2258-1.
Peter K A,Gildow F,Palukaitis P,Gray S M. 2009. The C terminus of the polerovirus p5 readthrough domain limits virus infection to the phloem[J]. Journal of Virology,83(11):5419-5429. doi:10.1128/JVI.02312-08.
Pfeffer S,Dunoyer P,Heim F,Richards K E,Jonard G,Ziegler G V. 2002. P0 of beet western yellows virus is a suppressor of posttranscriptional gene silencing[J]. Journal of Virology,76(13):6815-6824. doi:10.1128/JVI.76.13. 6815-6824.2002.
Sun Q,Li Y Y,Wang Y,Zhao H H,Zhao T Y,Zhang Z Y,Li D W,Yu J L,Wang X B,Zhang Y L,Han C G. 2018. Brassica yellows virus P0 protein impairs the antiviral activity of NbRAF2 in Nicotiana benthamiana[J]. Journal of Experimental Botany,69(12):3127-3139. doi:10.1093/ jxb/ery131.
Wang Q,Mao J J,Xiang H Y,Dong L H,Sun Y H,Liu G S,Liu H B. 2015. First report of Brassica yellows virus on tobacco in China[J]. Plant Disease,99(8):1192. doi:10. 1094/PDIS-12-14-1348-PDN.
Wang Q,Xu F Z,An L L,Xiang H Y,Zhang W H,Liu G S,Liu H B. 2019. Molecular characterization of a new recombinant Brassica yellows virus infecting tobacco in China[J]. Virus Genes,55:253-256. doi:10.1007/s11262-019-01636-4.
Xiang H Y,Dong S W,Shang Q X,Zhou C J,Li D W,Yu J L,Han C G. 2011. Molecular characterization of two geno-types of a new polerovirus infecting brassicas in China[J]. Archives of Virology,156(12):2251-2255. doi:10. 1007/s00705-011-1091-z.
Zhang X Y,Dong S W,Xiang H Y,Chen X R,Li D W,Yu J L,Han C G. 2015. Development of three full-length infectious cDNA clones of distinct Brassica yellows virus genotypes for agrobacterium-mediated inoculation[J]. Virus Research,197:13-16. doi:10.1016/j.virusres.2014.12. 005.
Zhang X Y,Peng Y M,Wang Y,Zhang Z Y,Li D W,Yu J L,Han C G. 2016. Simultaneous detection and differentiation of three genotypes of Brassica yellows virus by multiplex reverse transcription-polymerase chain reaction[J]. Virology Journal,13(1):189. doi:10.1186/s12985-016-0647-7.
Zhang X Y,Xiang H Y,Zhou C J,Li D W,Yu J L,Han C G. 2014. Complete genome sequence analysis identifies a new genotype of Brassica yellows virus that infects cabbage and radish in China[J]. Archives of Virology,159(8):2177-2180. doi:10.1007/s00705-014-2027-1.
(責任编辑 陈 燕)
