丹酚酸B调节Bax/Bcl-2的表达对阿尔茨海默病小鼠认知功能的影响及机制
2021-09-07延沁儒
张 瑞,延沁儒
(1.西安国际医学中心医院神经康复科,陕西 西安 710000;2.空军军医大学第二附属医院康复理疗科,陕西 西安 710000)
阿尔茨海默病(Alzheimer’s disease,AD)是一种进行性神经功能障碍疾病,主要损害运动、记忆、言语和认知[1]。该病特征是在杏仁核、海马、大脑皮层和基底节中发现的胆碱能神经元变性,导致神经递质乙酰胆碱的合成和分泌减少及β 淀粉样蛋白(beta amyloid peptides,Aβ)沉积聚集。其中Aβ 诱导炎症反应、线粒体功能障碍和细胞凋亡可能在毒性循环中相互作用并相互扩增,阻断海马突触可塑性导致脑中神经细胞逐渐死亡,引发记忆障碍[2]。据报道,AD与氧化应激(oxidative stress,OS)密切相关,线粒体尤其是电子传输链复合物Ⅰ和Ⅲ是产生和积累活性氧(reactive oxygen species,ROS)的主要位点,氧化损伤神经元线粒体的直接结果是细胞凋亡,与AD 患者中神经元凋亡一致[3]。目前常用于治疗AD的5 种药物只能通过改善症状最大限度的提高患者生活质量[1]。AD 致病机制复杂、缺乏早期诊断和有效治疗药物等,给家庭和社会带来了沉重的经济和心理负担。因此,AD的防治仍是医学所面临的挑战之一。丹参是一种传统中草药,常用于治疗心脑血管相关疾病。丹酚酸B(salvianolic acid B,Sal B)是从丹参中提取的含量最丰富和活性最高水溶性成分[4]。近年来,研究表明Sal B 具有抗氧化、抗炎、抗凋亡、抗纤维化、调节自噬等作用,并且可以促进干细胞的增殖和分化,促进脑血管生成,改善脑微循环,对心脑血管疾病具有保护作用[4-6],但临床上有关Sal B 对AD的治疗及作用机制还甚少报道。本实验通过观察Sal B 对AD小鼠模型认知功能的影响,探究Sal B 对其凋亡的作用及机制,旨在为AD的治疗提供药理学依据。
1 材料与方法
1.1 实验动物及材料 选择6 月龄SPF 级昆明小鼠40 只,体重(40±3)g,购于广州医学动物实验中心(SCXK 粤2013-0002),Sal B 购于成都普菲德生物科技有限公司,D-半乳糖购于Sigma 公司,氯化铝(AlCl3)购于广州化学试剂场,STT-2 小鼠跳台仪购于北京科学院研究所,氧化指标试剂盒购于南京建成公司,半胱氨酸天冬氨酸蛋白酶-3(Cysteine-containing aspartate-specific protease-3,Caspase-3)抗体购于英国CST 公司,B 淋巴细胞瘤-2 基因(B-cell lymphoma-2,Bcl-2)、Bcl-2 相关X 蛋白(Bcl-2 Associated X Protein,Bax)抗体购于博士德公司。
1.2 方法
1.2.1 模型构建与分组干预 实验动物给予饲料和超纯水自由喂养,保持室温20 ℃~25 ℃、湿度55%~65%,适应性喂养1 周之后,按体重大小给动物编号,随后利用随机数字表连续获得40 个数字,除以组数求余数,余数1、2、3、4 分别将动物纳入:对照组,AD 模型组,Sal B 低剂量组(salvianolic acid B low dose group,Sal B-L)和Sal B 高剂量组(salvianolic acid B high dose group,Sal B-H);每组多于10 只的小鼠继续以上操作,按新余数纳入组别,直至每组10 只。AD 模型组给予腹腔注射浓度为120 mg/(kg·d)体积0.2 ml D-半乳糖;灌胃浓度10 mg/(kg·d)体积0.1 ml AlCl3;腹腔注射0.1 ml 生理盐水,连续8周。Sal B 组给予腹腔注射浓度120.0 mg(kg·d)体积0.2 ml D-半乳糖,灌胃浓度10 mg(kg·d),体积0.1 ml AlCl3,此基础上Sal B-L 组给予腹腔注射浓度30mg(kg·d)体积0.1 ml Sal B;Sal B-H 组给予腹腔注射浓度60 mg/(kg·d)体积0.1 ml Sal B。对照组给予等体积生理盐水。
1.2.2 跳台实验 最后1 次给药后第2 天开始跳台实验。STT-2 型小鼠跳台仪,通电0.2 mA。先让小鼠在跳台仪内适应5.0 min,随后给跳台仪通电。当其遭受电击,正常反应为避开电击跳上绝缘台。小鼠5.0 min内从绝缘台跳下次数,记做学习成绩。第2 天相同时间重复实验,其5.0 min 内第1 次从绝缘台跳下时间,记做潜伏期。同时记录小鼠5.0 min 内跳下绝缘台总次数,即错误次数。
1.2.3 取材和处理 跳台实验结束24 h 后称重小鼠,并在10%水合氯醛(4 ml/kg)腹腔注射彻底麻醉小鼠后摘眼球取血,储存至抗凝EP 管。于4 ℃冰箱静置血液4 h 后离心(3500 r/min,10 min),取上清备用。用于检测GSH-PX、SOD 及MDA 含量。采用颈椎离断法处理小鼠,提取脑组织。在冰冻台上沿小鼠大脑组织的矢状位将大脑均分为两半,提取海马。存放于-80 ℃冰箱,用于检测Western Bolt 目的蛋白及谷胱甘肽过氧化物酶(glutathione peroxidase,GSHPX)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)含量。
1.2.4 氧化应激指标检测 血清样品:取生理盐水稀释的血清做正式实验。大脑组织样品:将海马组织加入生理盐水置于匀浆器,于冰上手动匀浆1 h。随后4 ℃离心(12000 r/min,5 min),提取上清。严格按照试剂盒说明书进行操作,测定样品中SOD 活性,MDA 及GSH-PX 含量。
1.2.5 Western Blot 检测细胞中Caspase-3、Bcl-2、Bax 蛋白表达 冰上裂解海马组织,提取蛋白。BCA法蛋白定量,加入上样缓冲液,100 ℃加热导致蛋白变性,选取20 μg 上样量,电泳、电转,孵育Caspase-3、Bcl-2、Bax 抗体,4 ℃过夜;次日二抗孵育,显色,凝胶成像分析系统曝光,测定光密度。
1.3 统计学处理 数据采用SPSS 19.0 软件分析,先进行正态性检验,服从正态分布的数据以()表示,采取单因素方差分析,组间比较采用LSD-t检验,P≤0.05 表示差异有统计学意义。
2 结果
2.1 各组小鼠认知功能变化比较 与对照组比较,AD 组潜伏期降低、训练错误和记忆错误次数增加(P<0.05);与AD 模型组比较,Sal B 各组潜伏期延长、训练和记忆错误次数减少(P<0.05);与Sal B-L组比较,Sal B-H 组潜伏期延长(P<0.05)、训练错误和记忆错误次数未见明显差异(P>0.05),见图1、表1。
表1 小鼠跳台实验结果(n=10,)
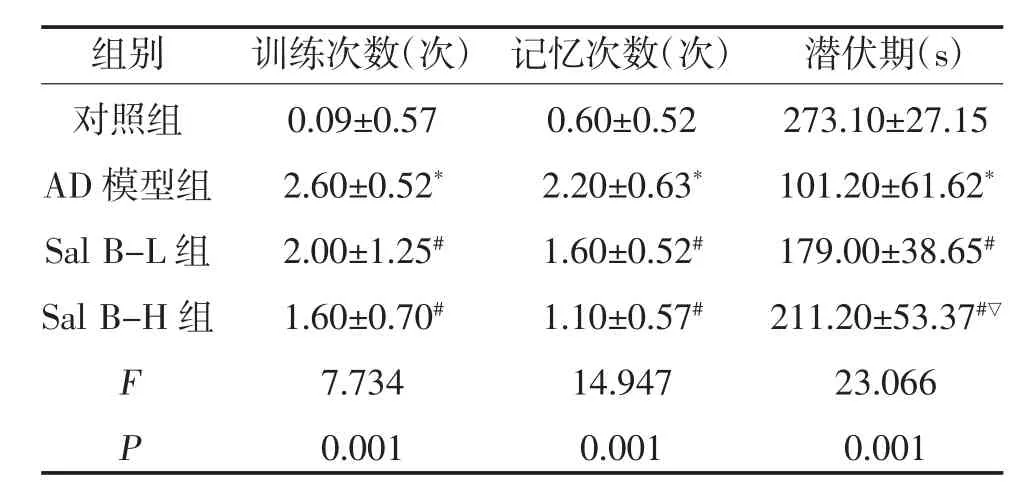
表1 小鼠跳台实验结果(n=10,)
注:与对照组比较,*P<0.05;与AD 模型组比较,#P<0.05;与Sal B-L 组比较,▽P<0.05
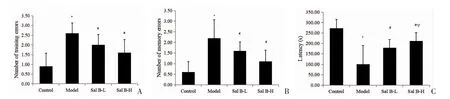
图1 小鼠跳台实验结果
2.2 各组小鼠SOD、GSH-PX 活性及MDA 含量比较与对照组比较,AD 模型组小鼠脑组织及血清中GSH-PX、SOD 活性减弱,MDA 含量上升(P<0.05);与AD 模型组相较,Sal B 各组小鼠脑组织及血清中GSH-PX、SOD 活性增强,MDA 含量降低(P<0.05);与Sal B-L 组比较,Sal B-H 组脑组织及血清中GSH-PX、SOD 活性增强,MDA 含量降低(P<0.05),见图2、表2、表3。
表2 小鼠血清MDA 含量及SOD、GSH 活性变化(n=10,)
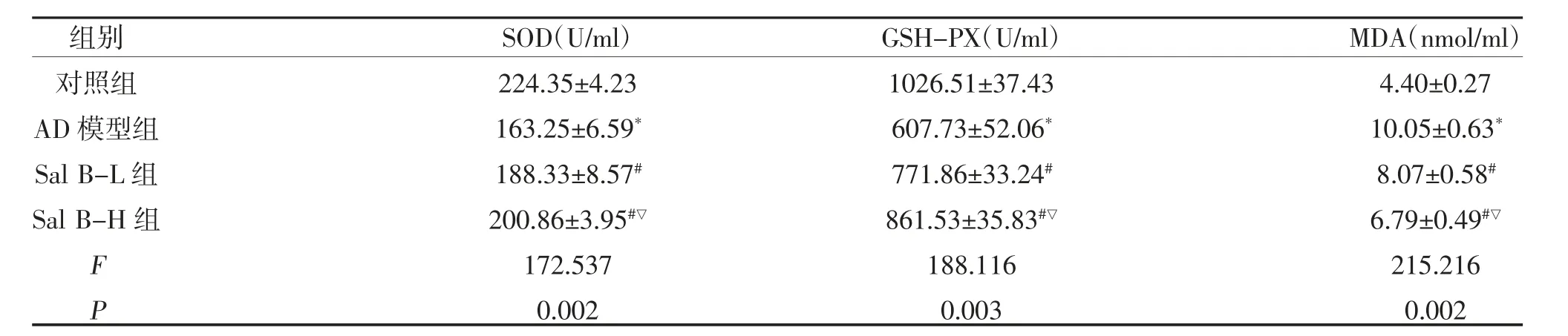
表2 小鼠血清MDA 含量及SOD、GSH 活性变化(n=10,)
注:与对照组比较,*P<0.05;与AD 模型组比较,#P<0.05;与Sal B-L 组比较,▽P<0.05
表3 小鼠脑组织MDA 含量及SOD、GSH 活性变化(n=10,)

表3 小鼠脑组织MDA 含量及SOD、GSH 活性变化(n=10,)
注:与对照组比较,*P<0.05;与AD 模型组比较#P<0.05;与Sal B-L 组比较,▽P<0.05
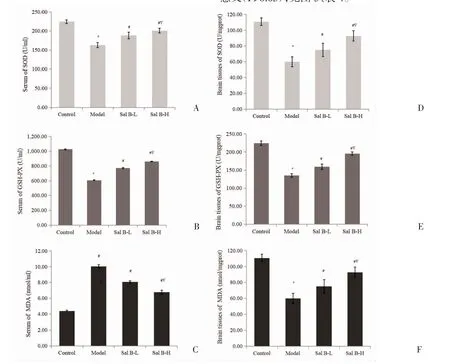
图2 小鼠氧化指标
2.3 各组小鼠Caspase-3、Bcl-2、Bax 蛋白表达比较与对照组比较,AD 模型组小鼠海马中Bax/Bcl-2、Caspase-3 蛋白表达增高(P<0.05);与AD 模型组比较,Sal B 各组小鼠海马Bax/Bcl-2、Caspase-3 蛋白表达降低(P<0.05);Sal B-H 组Bax/Bcl-2 以及Caspase-3 蛋白表达与Sal B-L 组比较,差异无统计学意义(P>0.05),见图3、表4。
表4 小鼠海马Bcl-2、Bax、Caspase-3 蛋白表达(n=10,)
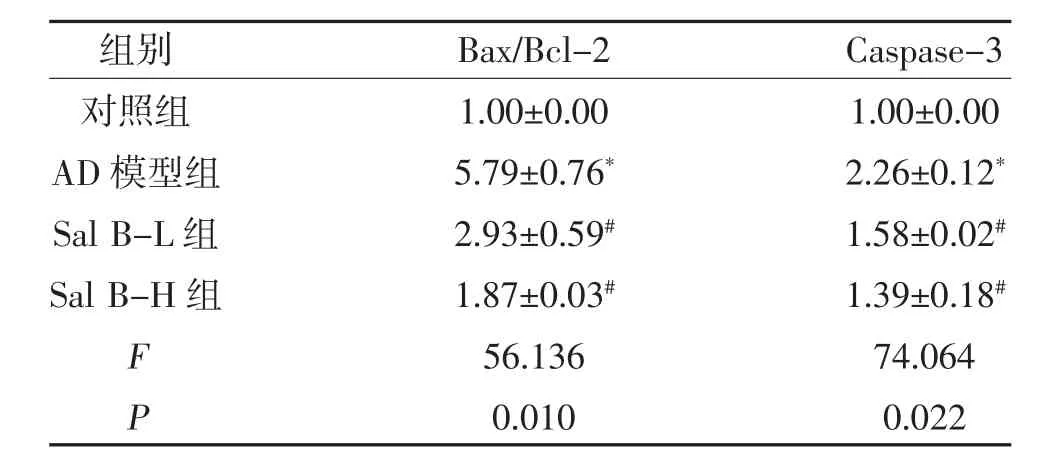
表4 小鼠海马Bcl-2、Bax、Caspase-3 蛋白表达(n=10,)
注:与对照组比较,*P<0.05;与AD 模型组比较,#P<0.05
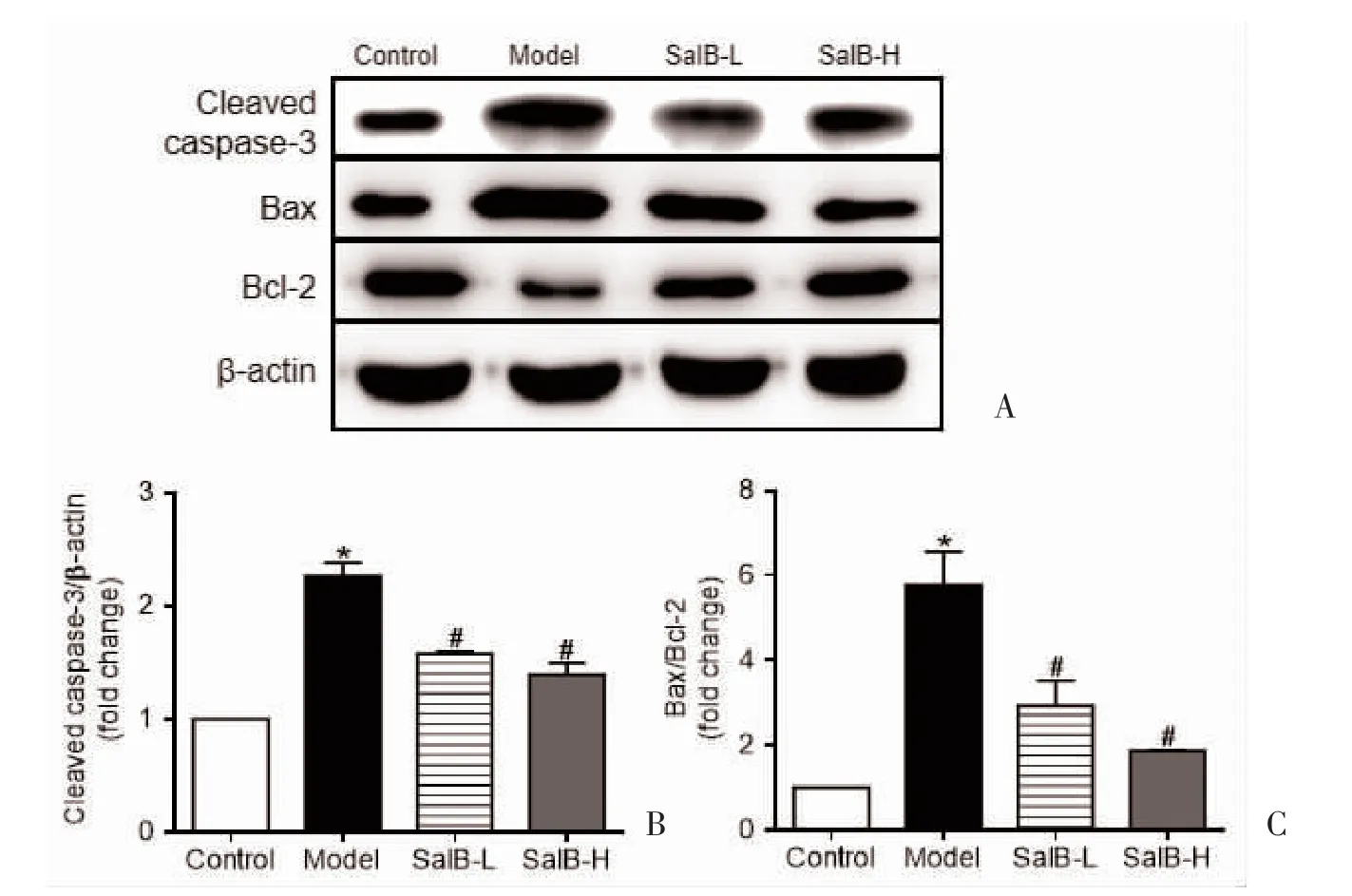
图3 小鼠海马Bcl-2、Bax、Caspase-3 蛋白表达情况
3 讨论
D-半乳糖堆积在细胞内,经醛糖还原酶及半乳糖合成酶作用,导致细胞肿胀、线粒体空泡样变性、功能障碍,最终引起衰老[7];而铝易透过血脑屏障,降低抗氧化酶水平、改变钙稳态、升高代谢性谷氨酸受体表达等,破坏突触可塑性、诱导神经元凋亡从而损害学习记忆水平[8]。本实验采用长期高浓度氯化铝灌胃联合腹腔注射D-半乳糖建立复合AD 小鼠模型[9],结果显示相较于正常对照组,AD 模型组小鼠出现脊柱前凸、脱毛、活动迟缓;行为学实验结果提示,AD 模型组小鼠发生学习记忆障碍。此模型取得的实验结果具有可信度。
线粒体功能障碍在Aβ 沉积聚集或记忆障碍的发展之前就发现了裂变、融合和功能异常,具体反映在ROS 水平升高,Ca2+稳态破坏,脂质过氧化以及细胞凋亡上[1,10]。抗氧化能力的降低直接影响神经元的突触活动和神经传递,从而导致认知功能障碍[10]。受ROS 影响的分子靶标包括核和线粒体DNA、脂质、蛋白质、钙稳态、细胞结构、受体运输和内吞作用以及能量稳态。反之,异常的细胞代谢会影响Aβ 和磷酸化tau 蛋白的产生和积累,从而独立加剧线粒体功能障碍和ROS的产生,形成恶性循环。在正常情况下,充当自由基清除剂的抗氧化剂酶介导ROS的水平,包括SOD 和GSH-PX;同时ROS 可将多不饱和脂肪酸氧化为过氧化脂肪酸,后者进行重排并进一步反应以形成多种次级氧化产物,如MDA,进而影响线粒体呼吸链中关键酶的活性,严重损伤细胞膜[4]。以上指标均用于评估氧化应激反应程度。线粒体在细胞中还具有调节程序性细胞死亡或凋亡作用。据报道[1],通过TUNEL 染色评估,与健康的大脑相比,AD 大脑中的神经元显示出凋亡的标志。Bcl-2家族的抗凋亡和促凋亡成员之间的均衡参与并维持线粒体完整性,Bcl-2 与Bax的比值对细胞存活和死亡至关重要。Bcl-2 在抑制凋亡、损伤后修复等方面有重要意义;Bax 可改变线粒体外膜通透性,促使细胞色素-C 从线粒体释放到胞质,产生细胞内源性凋亡。细胞凋亡遵循与肿瘤坏死因子受体家族成员相关的外源性途径,同样遵循与从线粒体中释放细胞色素C的内源性途径;两种途径最终在半胱氨酸天冬氨酸酶级联反应的末端部分合并。级联反应的最后一步是激活Caspase-3,促使细胞内蛋白水解,细胞骨架崩溃和DNA 片段化。因此,Caspase-3 被认为是凋亡细胞的通用指标[11]。
Sal B 是天然有效的抗氧化剂,含有9 个酚羟基,因此它可以提供许多氢原子以发挥强大的抗氧化作用,通过抑制聚(ADP-核酶)聚合酶1(PARP-1)活性以防止NAD+消耗、上调Grx1 表达,从而有效抑制ROS的产生并减少脂质过氧化产物如MDA的产生,以发挥抗氧化作用[4]。有研究表明[12],Sal B可显著改善过氧化氢诱导的神经干细胞体外损伤,并促进其向神经元分化;还能够改善小鼠暂时性脑缺血诱导的学习与记忆功能障碍。同时,Sal B 可以通过降低细胞线粒体内钙浓度来降低Caspase-3 活性,减少皮层神经元和肝细胞等细胞凋亡[13]。Yu X等[14]研究发现,SalB 治疗激活了AKT/CREB/BDNF信号通路,抑制神经元凋亡发挥抗惊厥作用。
本实验结果显示,与AD 模型组比较,Sal B 增加小鼠脑组织和血清中SOD、GSH-PX 含量,减少MDA 含量,增加小鼠海马Bcl-2 蛋白表达增加,减少Bax、Caspase-3 蛋白表达,表明Sal B 可能通过调节OS 反应中相关酶的活性改善氧化损伤,继而减轻线粒体损伤,进一步调节Bcl-2 与Bax 比值,抑制Caspase-3 凋亡蛋白表达,改善小鼠海马神经元凋亡。
综上所述,Sal B 对AD 小鼠的认知功能具有一定的保护作用,其作用机制可能与改善OS 损伤从而减少神经元凋亡有关。说明Sal B 可能是治疗神经退行性疾病的有效药物。在临床试验之前,仍需要进一步研究来验证Sal B 对抗其他AD 模型通过其他靶点的抗老年痴呆作用。
