三线定量胶体金免疫亲和试纸法定量中药饮片中黄曲霉毒素B1及B1、B2、G1、G2总量的研究
2021-09-06范妙璇傅欣彤陈奕菲陈思妮陈有根
范妙璇,傅欣彤,陈奕菲,陈思妮,陈 晶,张 婷,陈有根
·药材与资源·
三线定量胶体金免疫亲和试纸法定量中药饮片中黄曲霉毒素B1及B1、B2、G1、G2总量的研究
范妙璇,傅欣彤*,陈奕菲,陈思妮,陈 晶,张 婷,陈有根
北京市药品检验所,国家药品监督管理局中成药质量评价重点实验室,中药成分分析与生物评价北京市重点实验室,北京 102206
利用三线胶体金侧流向免疫色谱技术,针对中药特点对样品前处理和检测曲线进行研究,建立快速、准确的定量测定中药饮片中黄曲霉毒素B1、B2、G1和G2总量的方法,迅速检测中药饮片中黄曲霉毒素的污染程度。利用胶体金免疫亲和法建立《中国药典》2020年版规定限度的24种中药饮片中黄曲霉毒素测定方法,进行方法学验证,并对60种中药饮片,共计195批次样品进行分类测定。同时利用液质联用(三重四级杆质谱法)对上述样品进行定量检测,并比对2种检测方法。采用配对检验法比较2种方法的检测结果是否存在显著性差异;通过加入其他真菌毒素对试纸条的特异性进行考察。通过胶体金侧流向免疫色谱技术测定中药饮片中黄曲霉毒素含量,胶体金方法和液质联用方法检测结果一致,无显著性差异,加样回收率为80.3%~119.7%,与黄曲霉毒素M1和M2、赭曲霉毒素、脱氧雪腐镰刀菌烯醇和玉米赤霉烯酮等其他真菌毒素没有交叉反应。单独研究黄曲霉毒素B1与B1、B2、G1和G2总量之间无交叉干扰,且其含量测定符合《中国药典》2020年版规定的标准检验要求。胶体金检测方法可以准确、定量、快速检测中药饮片中黄曲霉毒素含量。该方法具有简单、快捷和低毒等优点。
黄曲霉毒素;三线胶体金侧流向免疫色谱技术;胶体金免疫亲和法;中药饮片;液质联用法;赭曲霉毒素;脱氧雪腐镰刀菌烯醇;玉米赤霉烯酮
真菌毒素污染被世界卫生组织列为食源性疾病的重要根源,其中黄曲霉毒素的危害最大[1-3]。黄曲霉毒素(aflatoxins,AFTs)是黄曲霉和寄生曲霉等菌种产生的次生代谢产物,是一类化学结构类似的化合物,均为二氢呋喃香豆素的衍生物,以黄曲霉毒素B1(aflatoxin B1,AFB1)、黄曲霉毒素B2(aflatoxin B2,AFB2)、黄曲霉毒素G1(aflatoxin G1,AFG1)、黄曲霉毒素G2(aflatoxin G2,AFG2)的危害和毒性最大[4-5]。1993年AFTs被世界卫生组织的癌症研究机构划定为I类致癌物[6]。AFTs是一类毒性极强的物质,其毒性相当于氰化钾的10倍、砒霜的68倍,可引起肝脏的急慢性损害,同时还对肾脏等其他多种组织器官造成严重损害,并具有致癌、致畸、致细胞突变的“三致”作用[7-10]。因此各国相继制定了食品中AFTs限量的法规,以保护健康[11-15]。
为了加强中药材的质量控制,国家食品药品监督管理局增加了中药材的安全性指标控制项目,尤其是加强对中药材中AFTs的控制,《中国药典》2020年版中增加了AFTs的检查方法,并针对24种中药材及饮片开展AFTs检查,并明确规定了AFB1的限量不得超过5 μg/kg、AFTs总量(以AFB1、AFB2、AFG1、AFG2总量计)的限量标准为10 μg/kg[16]。
目前,AFTs的检测方法有高效液相色谱法(HPLC)、薄层色谱法(TLC)[17-26]和酶联免疫吸附法(ELISA)[27]。液相色谱质谱联用法,尤其是三重四极杆质谱检测器具有灵敏度高、特异性强、选择性好、抗基质背景干扰能力强等特点,多用于复杂基质的检测[28-33],其目前也被《中国药典》2020年版四部AFTs检查法作为仲裁的验证法应用[16]。《中国药典》中规定的仪器检测方法虽然准确,但标准检验方法,前处理复杂,液相及质谱法检测仪器昂贵,饮片生产经营企业检测均有一定的困难,无法满足廉价、快速现场检测的要求。在检测黄曲霉菌技术的发展中还有胶体金免疫色谱法、毛细管电泳法、生物传感器法、荧光免疫分析荧光偏振免疫分析法、膜基质免疫分析法、免疫芯片检测法等[34-35]。胶体金技术检测AFTs的方法具有快速、简便、低毒等优势,近年来开始应用于粮食饲料领域[36-39],其不仅能够检测粮油、饲料、水稻以及玉米等谷物中AFB1、玉米赤霉烯酮、伏马毒素B1等微生物毒素,还检测牛奶中三聚氰胺、水产品中氯霉素和硝基呋喃代谢物等非法添加剂、食物中副溶血性弧菌、金黄色葡萄球菌以及农药重金属的残留[40-41]。但是中药中胶体金快速检测受到基质干扰问题非常大。根据研究发现不同的中药基质AFT污染差异性较大,中药材柏子仁与薏苡仁本身所含有的成分可以为霉菌的生长提供充足的养分,产毒真菌在这2种油脂与淀粉类基质中容易大量繁殖,导致AFT污染率高[42];大枣等提取液较黏的样品,存在糖、黏液质和大分子蛋白等基质的干扰;陈皮、使君子、槟榔、蜈蚣等色素干扰较大的样品都会产生假阳性。所以亟需建立适用于中药检测的特殊前处理方式及结果矫正曲线等新的胶体金AFTs检测方法研究。
胶体金技术又称侧流向免疫色谱技术,是以胶体金作为示踪标记物应用于样品中待测物检测的一种免疫检测技术,可用于样品中待测物质的快速定性或定量检测,是一种稳定、灵敏的检测方法[43-45]。其反应原理为试样提取液中的AFTs与检测条中的胶体金微粒发生反应,AFTs与胶体金微粒的结合物以及游离的胶体金微粒在侧流作用下移动,当到达检测线时,包被的抗原与游离胶体金微粒结合,胶体金微粒富集后呈现红色,其颜色深浅与试样中AFTs的含量相关。用配套读数仪测定检测条上检测线和质控线颜色深浅,根据颜色深浅和读数仪内置标准曲线计算出试样中AFTs的含量[46-47],通常只能进行定性检测,无法准确定量;而市场上少数可用于定量测定的二线试纸存在无法抗基质背景干扰而出现假阳性率高、定量曲线不稳定、且检测范围较窄,无法稀释后检测等问题。而本方法中使用的AFTs定量检测条,则针对这一情况在技术上做了改进,增加了一条检测线,形成三线定量检测条,即包括2条检测线和1条质控线,同时使用读数仪,实现待测样品的准确定量。三线定量检测条的意义在于可以增加定量结果的准确性和稳定性,同时能够增加定量检测的范围,检测范围较其他胶体金检测条更宽。
此外与传统食品检测不同,中药的基质背景复杂,色素黏液质及中药中不同有效成分(如黄酮类、蒽醌类、菲醌类化合物等)都会给胶体金检测带来不同程度的影响。根据此情况,研发出几种不同的前处理方法,分别解决此问题,以使胶体金可以作为一种中药AFTs通用的检测方法。并且针对中药基质背景干扰的问题,重新对内部工作曲线进行矫正,针对中药精确度要求高,含量范围大等特点本研究开发了3个读数曲线进行低、中、高3个质量浓度的检测。该研究利用竞争法原理,在传统免疫分析的基础上引入胶体金快速检测方法,发展出AFTs胶体金免疫快速定量检测技术。该方法实现了简单、灵敏、准确、快捷、低毒等优点,10~30 min完成前处理,10 min内可完成1~4个样品的定量检测,顺应了快速检测的发展方向。
1 仪器与材料
1.1 仪器与试剂
ROSA定量读数仪、ROSA 45 ℃恒温孵育器、黄曲霉毒素全封闭三线定量检测条、黄曲霉毒素B1全封闭三线定量检测条购自北京中检葆泰生物技术有限公司;IKA A11basic中药粉碎机、VORTEX 2涡旋振荡仪,购自德国IKA公司;XPE204千分之一分析天平,购自德国赛多利斯公司;DT5-2B离心机,购自北京时代北利离心机有限公司;实验用水为高纯水,甲醇、乙腈均为色谱纯。
赛默飞世尔超高效液相色谱-串联三重四极杆质谱仪(UHPLC-TSQ Quantum),美国赛默飞世尔公司,配有二极管阵列检测器(PDA)、电喷雾离子源(ESI)、Xcalibur工作站等。
1.2 样品与对照品
共收集河北、安徽、江苏、云南、天津、重庆、北京等省市的市售远志、大枣、使君子、麦芽、柏子仁、莲子、桃仁、酸枣仁、薏苡仁、槟榔、僵蚕、全蝎、水蛭、肉豆蔻、陈皮、地龙、胖大海、决明子、蜈蚣、蜂房、九香虫、延胡索、土鳖虫、马钱子等60种中药饮片样品,每个品种2个批次。共计120个批次。经北京市药检所杜小伟主管药师鉴定均为正品,具体信息见表1。
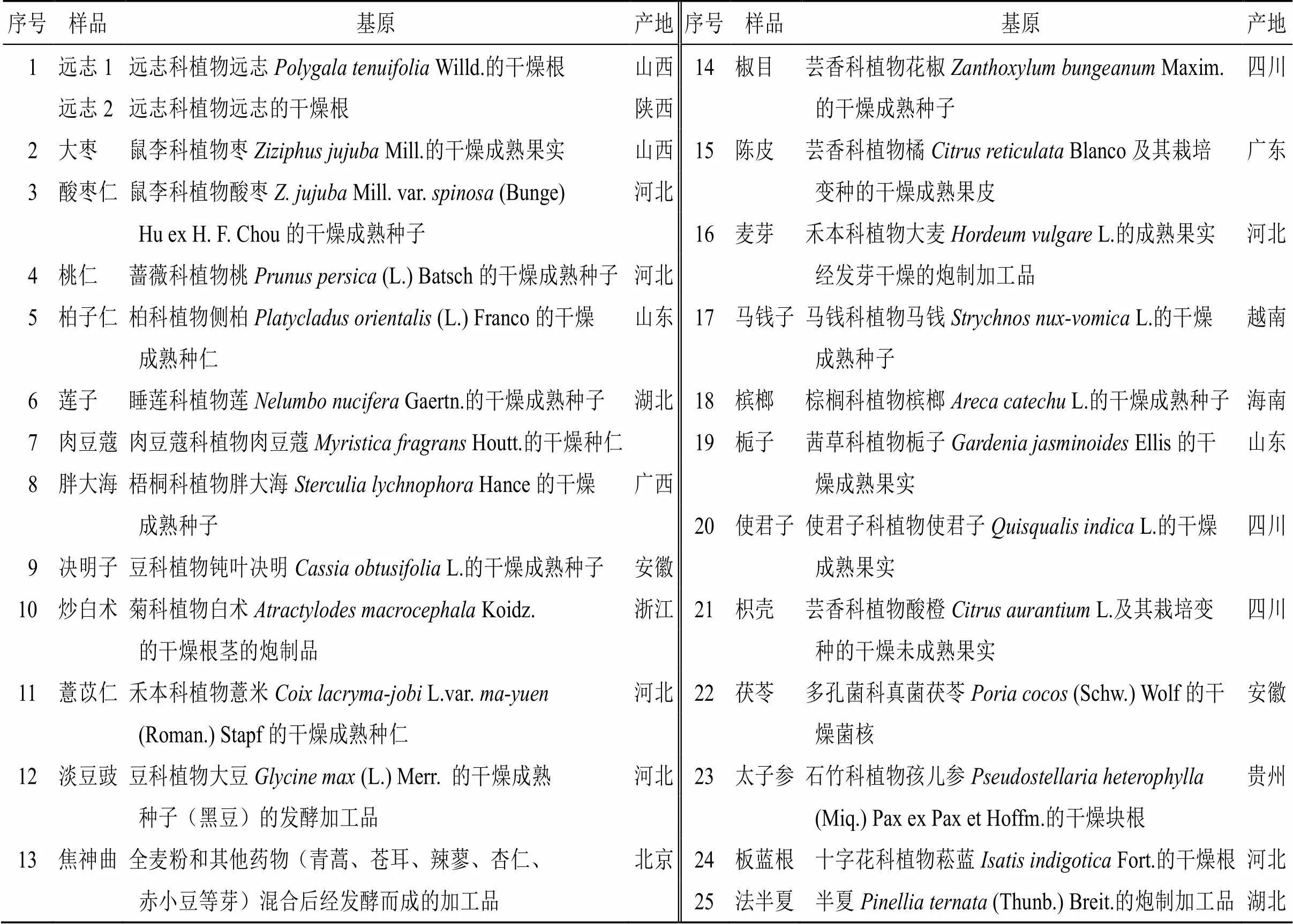
表1 样品信息
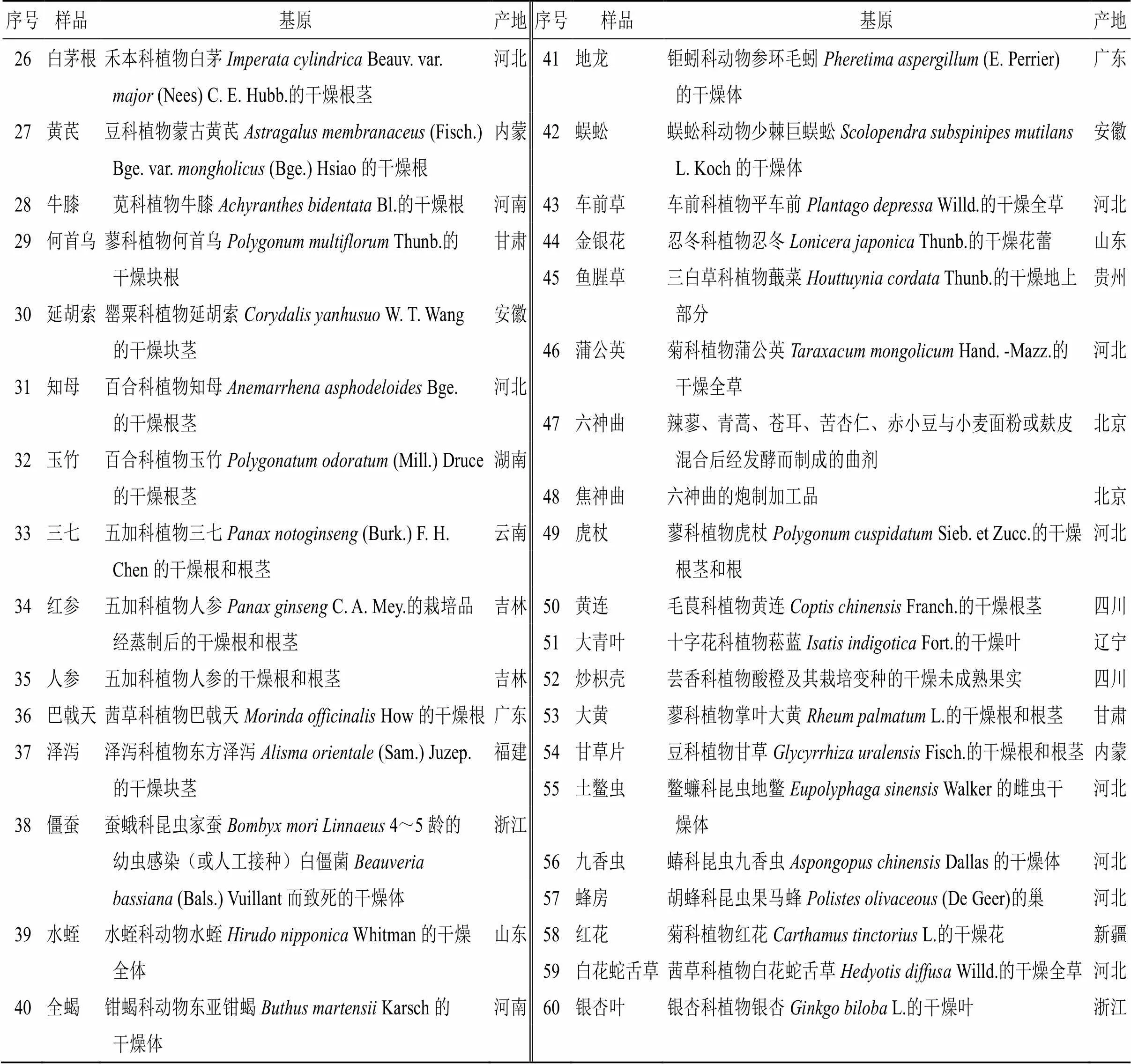
续表1
对照品AFTB1(批号L19044A)、AFTB2(批号L18323B)、AFTG1(批号L15331C)、AFTG2(批号L15391A)、AFTM1(批号L19082M)、AFTM2(批号1I00F12)、伏马毒素B1(批号L18183F)、赭曲霉毒素A(批号L19122A)、脱氧雪腐镰刀菌烯醇(批号1I00F04)、玉米赤霉烯酮(批号L18351Z),以上对照品质量分数均≥98%,均购自美国Supelco公司。
2 方法
2.1 样品准备
参照《中国药典》2020年版药材和样品取样法(通则0211)进行取样。取代表性的样品50 g,用粉碎机将样品粉碎至全部通过二号筛,充分混合均匀。
2.2 供试品溶液的制备
2.2.1 样品提取方法1 远志、大枣、使君子、麦芽、柏子仁、莲子、桃仁、酸枣仁、薏苡仁、僵蚕、水蛭、全蝎、巴戟天、人参、太子参、红参、红花、何首乌、蒲公英、甘草片、牛膝、板蓝根、黄芪、法半夏、泽泻、淡豆豉、延胡索、椒目、六神曲、神曲。
取代表性均匀粉末(过二号筛)样品,精密称取样品2 g至离心管中;加入4 mL(远志、大枣、使君子、麦芽、柏子仁、莲子、桃仁、酸枣仁、薏苡仁、僵蚕、水蛭、全蝎、巴戟天、人参、太子参、红参、红花、何首乌、牛膝、板蓝根、法半夏、泽泻、淡豆豉、延胡索、椒目、六神曲、神曲)或6 mL(蒲公英、甘草片、黄芪)70%甲醇,涡旋振荡2 min;4500 r/min离心10 min(离心后的样品在2 h内使用);精密量取100 μL离心后的上清液至含有1.0 mL黄曲霉稀释缓冲液的离心管中,作为供试品溶液(样品上清液加入稀释缓冲液中如果有沉淀,可充分混匀后进行离心,取离心后上清液检测)。
2.2.2 样品提取方法2 肉豆蔻、胖大海、地龙、栀子、三七、鱼腥草、车前草、焦神曲、金银花、炒白术、蜂房、土鳖虫、玉竹、九香虫、白茅根、知母、白花蛇舌草、茯苓、枳壳、马钱子、炒枳壳。
取代表性均匀粉末(过二号筛)样品,精密称取样品2 g至离心管中;加入4 mL(肉豆蔻、胖大海、栀子、三七、焦神曲、金银花、炒白术、蜂房、土鳖虫、玉竹、九香虫、白茅根、知母、白花蛇舌草、茯苓、枳壳、马钱子、炒枳壳)或6 mL(地龙、车前草)或8 mL(鱼腥草)甲醇(可根据样品特性加大提取液比例),涡旋振荡2 min;4500 r/min离心10 min(离心后的样品在2 h内使用);精密量取100 μL离心后的上清液至含有1.0 mL黄曲霉的稀释缓冲液(聚山梨酯20-磷酸盐缓冲液)的离心管中,充分混匀,10 000 r/min离心5 min,作为供试品溶液(样品上清液加入稀释缓冲液中如果有沉淀,可充分混匀后进行离心,取离心后上清液检测)。
2.2.3 样品提取方法3 决明子、蜈蚣、银杏叶、陈皮、虎杖、槟榔。
取代表性均匀粉末(过二号筛)样品,精密称取样品2 g至离心管中;加入4 mL甲醇溶液,涡旋振荡2 min;4500 r/min离心10 min;取上清液过NH2键合硅胶(500 mg/3 mL)萃取小柱,收集滤液;精密量取100 μL滤液至含有1.0 mL 黄曲霉稀释缓冲液的离心管中,充分混匀,作为供试品溶液(样品上清液加入稀释缓冲液中如果有沉淀,可充分混匀后进行离心,取离心后上清液检测)。
2.2.4 样品提取方法4 大黄、大青叶、黄连。
取代表性均匀粉末(过二号筛)样品,精密称取样品2 g至离心管中;加入10 mL 85%乙腈溶液,涡旋振荡2 min;4500 r/min离心10 min;取上清液过NH2键合硅胶固相萃取柱(500 mg/3 mL),收集滤液;精密量取2.5 mL滤液,用20 mL水进行稀释,混匀稀释液;移取醇活化C18固相萃取柱(500 mg/3 mL)(3 mL甲醇及3 mL水分别淋洗小柱使活化),把混匀后的稀释液全部过活化过的C18固相萃取柱,然后用5 mL水淋洗柱子;用1 mL甲醇洗脱C18固相萃取柱,收集洗脱液;精密量取100 μL洗脱液至含有1 mL黄曲霉稀释缓冲液的离心管中,充分混匀,此为一次稀释液,用于检测。
2.3 供试品溶液稀释液的制备
如果供试品溶液质量分数超过30 ng/g需要进行二次稀释:精密量吸取“2.2”项方法制备的供试品溶液300 μL至含有1.0 mL黄曲霉稀释缓冲液的离心管中,充分混匀,作为供试品溶液稀释液。
2.4 胶体金免疫色谱方法定量检测
取ROSA黄曲霉毒素定量检测条和AFTs稀释缓冲液,恢复至室温(20~25 ℃);孵育器温度 (45±1)℃。缓慢移取300 μL稀释的提取液检测条样品室中。孵育5 min,孵育结束后,取出检测试纸条放至室温下,水平放置10 min。将检测试纸条插入读数仪。选择对应频道,选择相应的AFTs读数,读取结果。该方法的检测范围为0~150 μg/kg,共3个读数频道。频道1读取质量分数低于10 ng/g的样品,灵敏度为0.01 ng/g;频道2读取质量分数10~30 ng/g的样品,灵敏度为1 ng/g;频道3读取质量分数为30~150 ng/g的样品,灵敏度为1 ng/g。
2.5 液质联用色谱仪(LC/MS-MS)比对检测实验方法
2.5.1 供试品溶液的制备 取供试品粉末约15 g(过二号筛),精密称定,置于均质瓶中,加入氯化钠3 g,精密加入70%甲醇溶液75 mL,高速搅拌2 min(搅拌速度大于11 000 r/min),离心5 min(离心转速2500 r/min),精密量取上清液15 mL,置50 mL量瓶中,用水稀释至刻度,摇匀,用微孔滤膜(0.45 μm)滤过,量取续滤液20.0 mL,通过免疫亲和柱,体积流量3 mL/min,用水20 mL洗脱,洗脱液弃去,使空气进入柱子,将水挤出柱子,再用适量甲醇洗脱,收集洗脱液,置2 mL量瓶中,并用甲醇稀释至刻度,摇匀,即得。
2.5.2 色谱、质谱条件与系统适用性试验 以十八烷基硅烷键合硅胶为填充剂;流动相为10 mmol/L醋酸铵水溶液-甲醇,梯度洗脱:0~4.5 min,35%~85%乙腈;4.5~6.0 min,85%~100%乙腈;6.0~6.5 min,100%~35%乙腈;6.5~10.0 min,35%乙腈;柱温25 ℃;体积流量0.3 mL/min。
以三重四极杆串联质谱仪检测;电喷雾离子源(ESI),釆集模式为正离子模式;各化合物监测离子对和碰撞电压(CE)见表2。
2.5.3 系列混合对照品溶液的制备 精密量取AFTs混合对照品溶液(AFB1、AFB2、AFG1、AFG2的标示质量浓度分别为1.0、0.3、1.0、0.3 μg/mL)适量,用70%甲醇稀释成含AFB2、AFG2质量浓度分别为0.03、0.06、0.12、0.24、0.48、0.96、1.92、2.88 ng/mL,含AFB1、AFG1质量浓度分别为0.1、0.2、0.4、0.8、1.2、3.2、6.4、9.6 ng/mL的系列对照品溶液,即得。参照《中国药典》2020年版四部通则2351 AFTs测定法第二法进行检测。
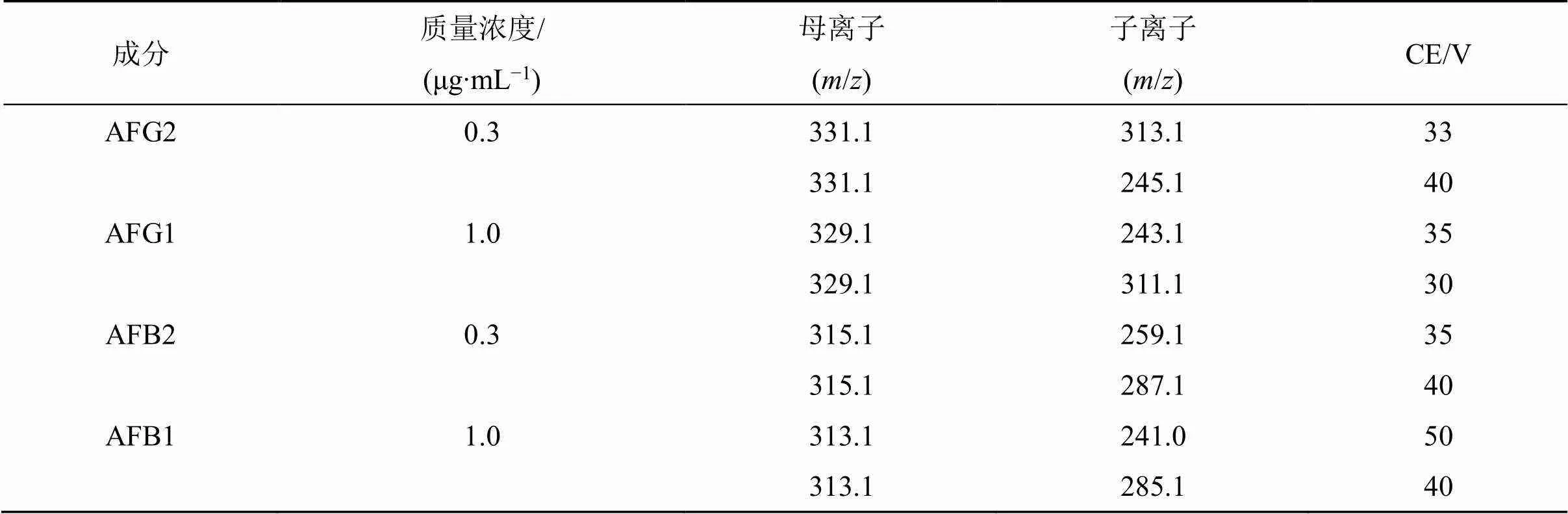
表2 AFB1、AFB2、AFG1、AFG2对照品监测离子对、碰撞电压参考值
3 结果与分析
3.1 方法专属性
胶体金侧流向免疫色谱快速定量检测方法特异性实验。
3.1.1 AFB1特异性验证实验 选取空白70%甲醇(平行6份),莲子、薏苡仁、地龙、酸枣仁阴性样品(平行2份),加入AFB1、AFB2、AFG1、AFG2混合对照品溶液(质量分数分别为5、20、50 μg/kg)、AFM1对照品溶液(质量分数为30 μg/kg)、AFM2对照品溶液(质量分数为30 μg/kg)、脱氧雪腐镰刀菌烯醇对照品溶液(质量分数为30 μg/kg)、玉米赤霉烯酮对照品溶液(质量分数为30 μg/kg)、伏马毒素B1对照品溶液(质量分数为30 μg/kg)、赭曲霉毒素A对照品溶液(质量分数为30 μg/kg),除添加AFTs对照品的样品可以检测出AFTs外,其余添加样品测定结果均为阴性,结果见表3。
3.1.2 AFTs总量特异性验证实验 选取空白70%甲醇(平行6份),莲子、薏苡仁、地龙、酸枣仁阴性样品(平行2份),加入AFB1对照品溶液(质量分数分别为5、20、50 μg/kg),AFB2、AFG1、AFG2混合对照品溶液(质量分数为30 μg/kg),AFM1对照品溶液(质量分数为30 μg/kg)、AFM2对照品溶液(质量分数为30 μg/kg)、脱氧雪腐镰刀菌烯醇对照品溶液(质量分数为30 μg/kg)、玉米赤霉烯酮对照品溶液(质量分数为30 μg/kg)、伏马毒素B1对照品溶液(质量分数为30 μg/kg),赭曲霉毒素A对照品溶液(质量分数为30 μg/kg),除添加AFTs对照品的样品可以检测出AFTs外,其余添加样品测定结果均为阴性,结果见表4。
3.2 胶体金侧流向免疫色谱快速定量检测方法稳定性实验
将空白样品进行加标,目标质量分数分别为2.5、5、8、10、50、80、130 μg/kg。分别做6个平行,置于室温下[48]进行样品检测。经系列数据分析发现,实验孵育结束后,将胶体金条水平放置10 min,可以观察到胶体金条的检测线和质控线显色清晰,且稳定性检测结果RSD<5%,说明放置10 min读数检测方法的稳定性良好。检测结果见表5。

表3 AFB1特异性验证实验结果(n = 6)
ND-未检测到
ND-not detected
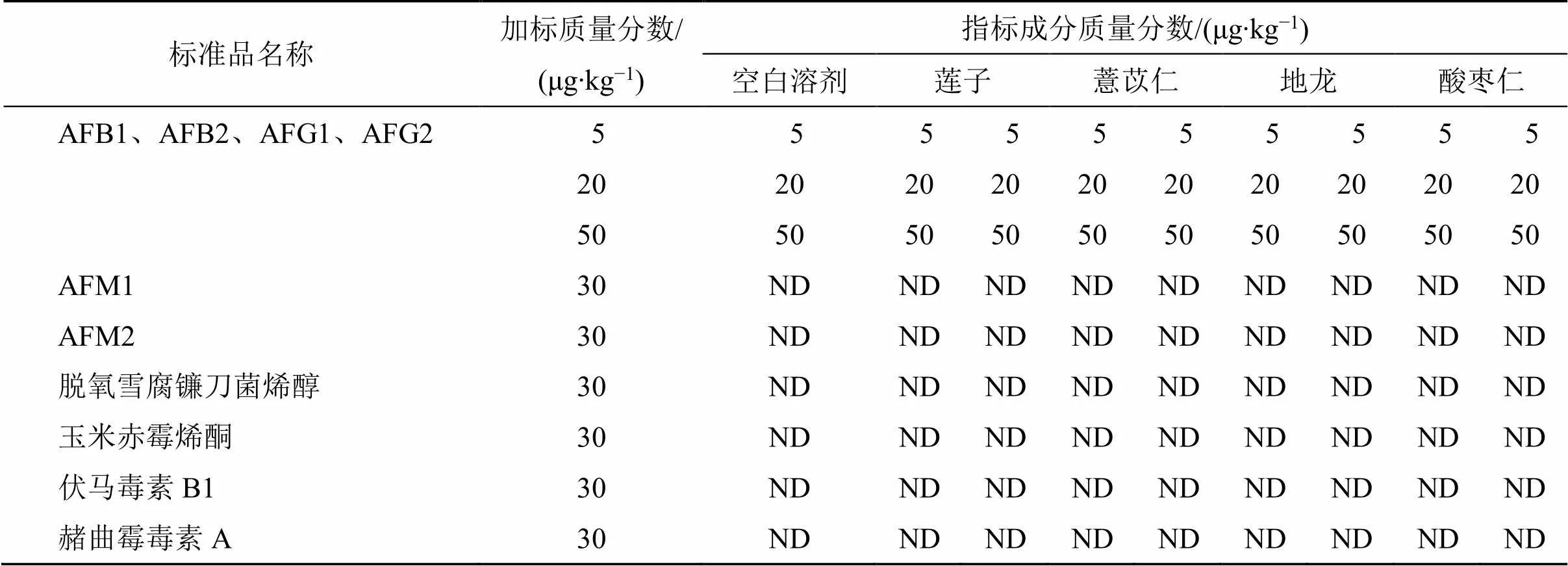
表4 AFTs总量特异性验证实验结果(n = 6)

表5 稳定性试验结果(n = 6)
3.3 加样回收率试验
3.3.1 AFB1 取样品2.0 g,共9份,根据不同样品本底的结果,选择低、中、高3水平分别添加对照品总质量分数为5、20、50 μg/kg的对照品,每个加标水平平行3份,按“2.2”项方法制备供试品溶液并测定,计算各加样水平样品的加样回收率和RSD,结果见表6。结果表明,加样回收率为80.3%~119.7%,RSD为0.1%~9.9%。
3.3.2 AFTs总量 取样品2.0 g,共9份,根据不同样品本底的结果,选择低、中、高3水平分别添加对照品AFB1质量浓度为5、10、50 μg/kg的对照品,每个加标水平平行3份,按“2.2”项方法制备供试品溶液并测定,计算各回收率和相对标准偏差,结果见表6。结果表明,加样回收率为80.6%~118.6%,RSD为0.4%~13.2%。
3.4 实际样品的检测
3.4.1 样品的AFB1检测 按照上述供试品溶液制备方法,进行实际样品检测。120批次样品中,AFB1的检出率为97.5%,但是检测结果都低于5 μg/kg的限度。结果见表7。
3.4.2 样品的黄曲霉总量的检测 检测按照上述供试品溶液制备方法,进行实际样品检测。120批次样品中,AFTs总量的检出率为90.8%。98.3%样品低于10 μg/kg的限度,有2个批次超出,为远志样品。结果见表7。
3.5 胶体金侧流向免疫色谱快速定量检测方法准确性实验
3.5.1 AFB1三线胶体金快速定量法与LC/MS-MS标准方法 分别对60种阳性样品进行检测,采用配对检验法比较2种方法的检测结果是否存在显著性差异。经计算,值为0.669,自由度为59,>0.05,说明胶体金快速定量检测方法与药典中LC/ MS-MS标准方法之间无显著性差异。结果见表7。
3.5.2 AFTs总量 三线胶体金快速定量法与LC/MS-MS标准方法分别对60种中药饮片的61批次样品(其中远志样品为2批次)进行平行比对检测,采用配对检验法比较2种方法的检测结果是否存在显著性差异。经计算值为−0.053,自由度为59,>0.05,说明三线胶体金快速定量检测方法与药典中LC/MS-MS标准方法之间无显著性差异。结果见表7。
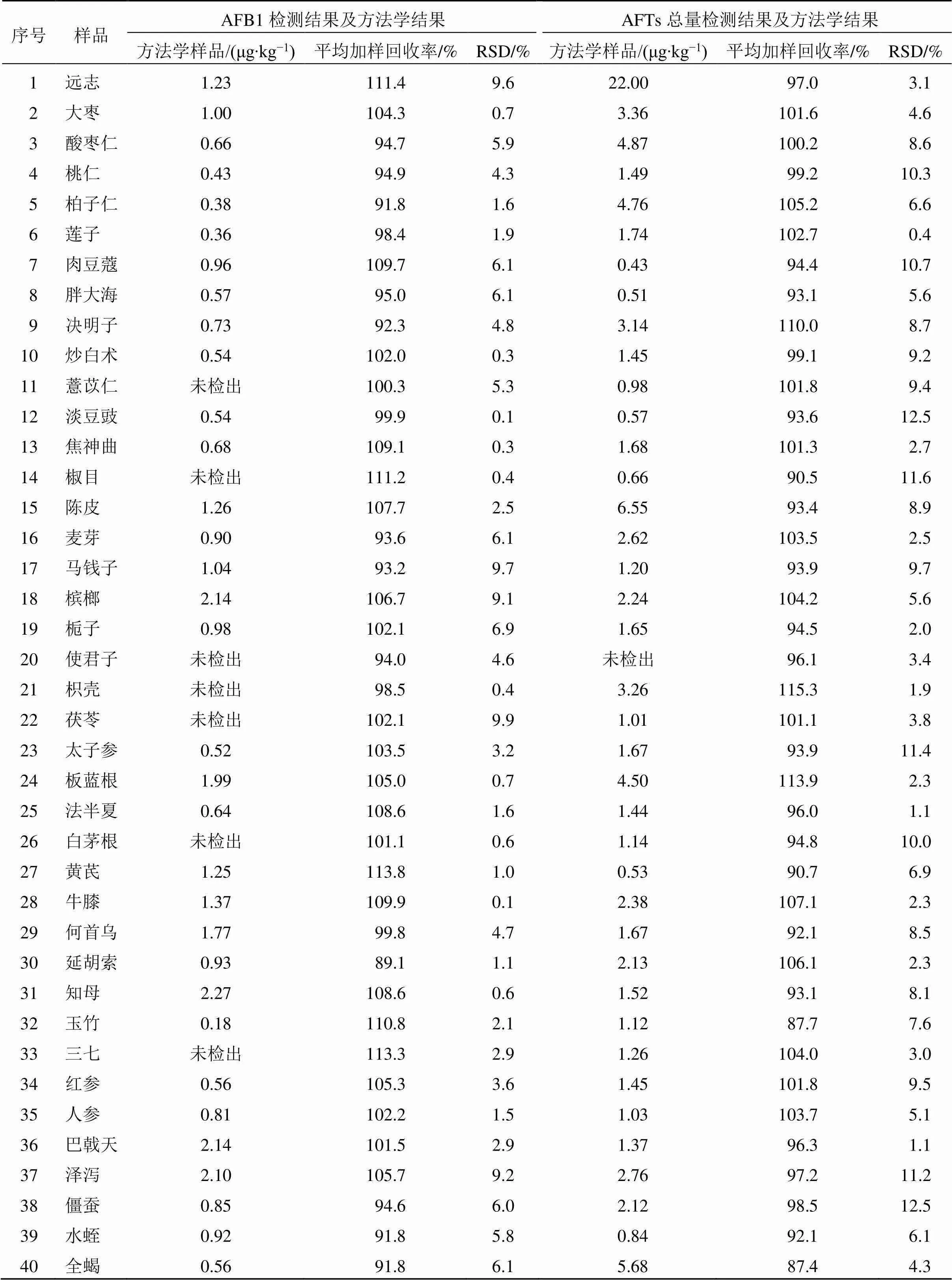
表6 60种中药样品三线胶体金AFTs检测及方法学验证(n = 3)

续表6

表7 60种中药饮片 (61批次)中AFB1及AFTs总量的胶体金法和LC/MS-MS法检测结果
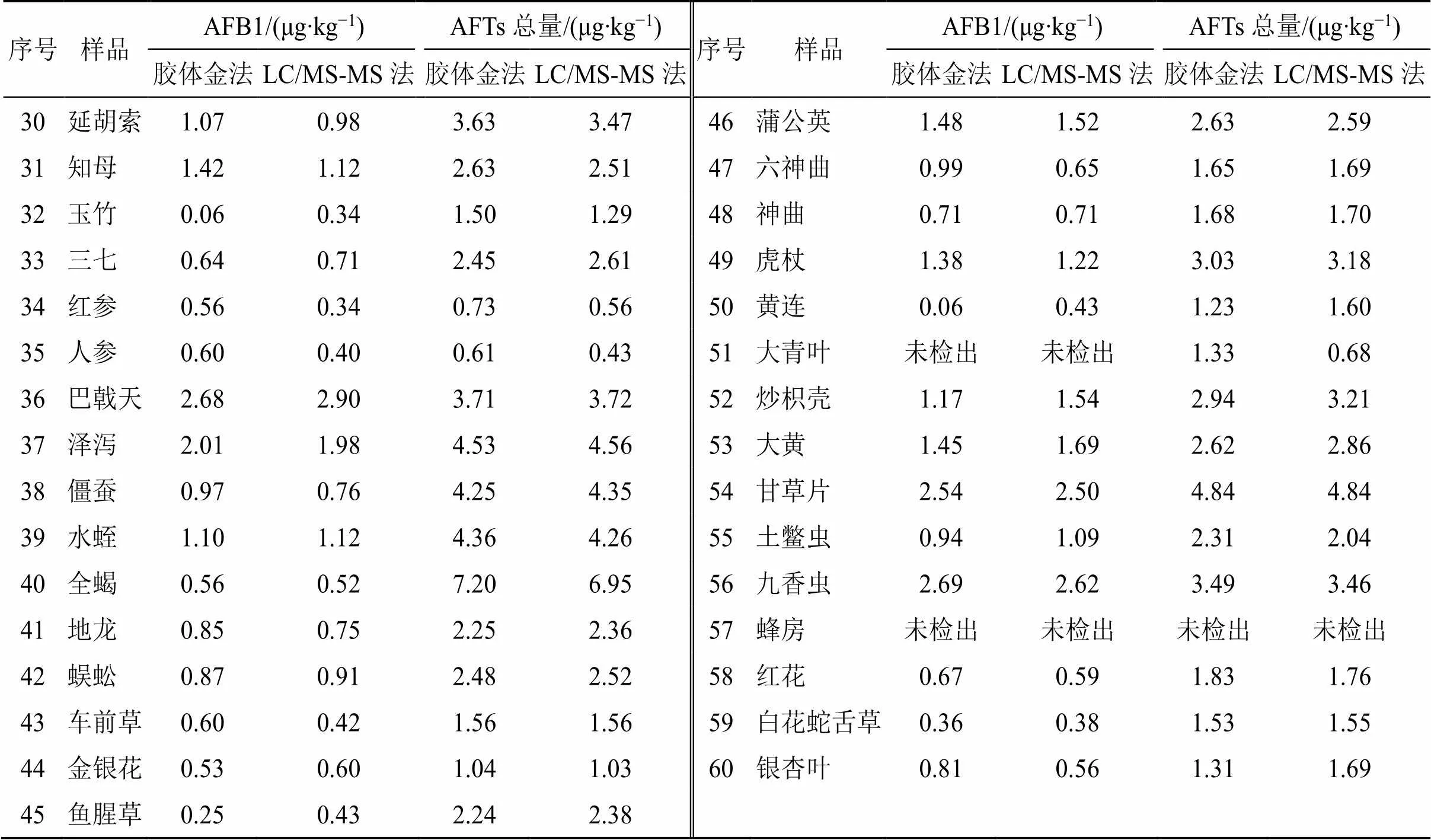
续表7
4 讨论
本研究对60种不同种类中药饮片建立了三线胶体金侧流向免疫色谱检测AFB1及AFB1、AFB2、AFG1、AFG2总量方法,同时进行分类测定方法,对该本方法的稳定性、特异性、准确度以及加标回收率进行评价,同时跟药典LC/MS-MS标准方法进行比对,差异较小。
经系列数据分析发现,实验孵育结束后将胶体金条水平放置10 min读数可以观察到胶体金条的检测线和质控线显色清晰,且稳定性检测结果良好。
试验样品中,多数检测出AFTs,AFB1的检出率为90.8%,AFTs总量的检出率为97.5%。样品中有2个批次AFTs总量超出10 μg/kg的限度,均为远志样品。除与储藏运输等条件有关,也与远志特殊的炮制方法以及非产地加工等原因有关,在外源性安全控制中应加以注意。
研究结果可以看出,本方法的检测结果和药典LC/MS-MS标准方法结果相吻合,AFB1和总量2种方法的线性关系值为0.999 5与0.999 2。配对检验法表明胶体金快速定量检测方法与药典中LC/MS-MS标准方法之间无显著性差异。加标呕吐毒素、玉米赤霉烯酮、伏马毒素和赭曲霉毒素,检测结果都显示未检出,特异性好,与其他真菌毒素没有交叉反应,加样回收率为80.3%~119.7%。
与LC/MS-MS方法相比,三线胶体金试剂条检测法单、快捷,10 min内可完成1~4个样品的定量检测,顺应了快速检测的发展方向。同时操作简单,无需专业人员培训,检测成本低,在医院、药店、中药材及饮片企业以及药材采购环节的实际工作中,无需特殊仪器设备和试剂,可以大批量检测中药材及中药饮片中AFTs,极大的提高工作效率,具有较高的应用价值[49]。并且操作过程无需使用毒素对照品溶液,满足各种检测的需求,整个操作过程对环境无污染,对于检测人员的健康起到最大程度的保护。
本研究建立适用于中药检测的特殊前处理方式、结果矫正曲线等新的方法研究,并为中药行业定量控制AFTs,制定一种低毒快速环保的测定方法及相关标准具有很大意义。
利益冲突 所有作者均声明不存在利益冲突
[1] 王晶. 食品安全快速检测技术 [M]. 北京: 化学工业出版社, 2002: 90.
[2] 李峻媛, 万丽, 杨美华. 真菌毒素限量标准及其在中药中的研究进展 [J]. 中草药, 2011, 42(3): 602-609.
[3] 赵飞, 焦彦朝, 连宾, 等. 黄曲霉毒素检测方法的研究进展 [J]. 贵州农业科学, 2006, 34(5): 123-126.
[4] Huertas-Pérez J F, Arroyo-Manzanares N, Hitzler D,. Simple determination of aflatoxins in rice by ultra-high performance liquid chromatography coupled to chemical post-column derivatization and fluorescence detection [J].2018, 245: 189-195.
[5] Choochuay S, Phakam J, Jala P,. Determination of aflatoxin B1 in feedstuffs without clean-up step by high-performance liquid chromatography [J].2018, 332(6): 1-8.
[6] 刘利晓, 张亮, 向艳娥, 等. 饲料中黄曲霉毒素检测方法研究进展 [J]. 畜牧与饲料科学, 2016, 37(3): 33-35.
[7] 李书国, 陈辉, 李雪梅, 等. 粮油食品中黄曲霉毒素检测方法综述 [J]. 粮油食品科技, 2009, 17(2): 62-65.
[8] 曹纪亮, 孔维军, 杨美华, 等. 真菌毒素快速检测方法研究进展 [J]. 药物分析杂志, 2013, 33(1): 159-164.
[9] 张奇, 李培武, 陈小媚, 等. 黄曲霉毒素免疫检测技术研究进展 [J]. 农产品质量与安全, 2013(3): 42-46.
[10] 胡振阳, 都立辉, 袁康, 等. 稻谷黄曲霉毒素的检测与污染控制研究进展 [J]. 中国粮油学报, 2020, 35(1): 175-185.
[11] 食品中黄曲霉毒素的测定[S]. GB/T5009.22-2016, 2016.
[12] 饲料中黄曲霉毒素B1的测定半定量薄层色谱法[S]. GB/T 8381—2008, 2009.
[13] 饲料中黄曲霉毒素B1、B2、G1、G2的测定免疫亲和柱净化-高效液相色谱法[S]. GB/T 30955—2014, 2015.
[14] 聂晶, 刘兴玠. 黄曲霉毒素M1研究进展 [J]. 国外医学: 卫生学分册, 1992(3): 159-161.
[15] 饲料中黄曲霉毒素B1的测定胶体金法 [S]. NY/T 2550—2014, 2014.
[16] 中国药典[S]. 一部. 2020: 80.
[17] 李佐卿. 免疫亲和柱HPLC快速测定蜂蜜中黄曲霉毒素B1、B2、G1、G2 [J]. 光谱实验室, 2001, 18(1): 28-311.
[18] 杨小丽, 韦日伟, 申红红, 等. 免疫亲和柱净化光化学衍生高效液相色谱-荧光检测法测定动物类药材中黄曲霉毒素 [J]. 中国药业, 2011, 20(15): 4-5.
[19] 郑荣, 毛丹, 王少敏, 等. 11种中药材中黄曲霉毒素G2、G1、B2、B1的HPLC法测定 [J]. 中国医药工业杂志, 2010, 41(5): 368-372.
[20] 徐一达, 袁晓, 王海鸣, 等. 色谱法检测真菌毒素的研究进展 [J]. 粮油食品科技, 2018, 26(6): 54-61.
[21] 张鹏, 张艺兵, 赵卫东. 花生中黄曲霉毒素B1、B2、G1、G2的多功能净化柱-高效薄层色谱分析 [J]. 分析测试学报, 1999, 18(6): 62-64.
[22] 涂文升. 高效液相色谱法同时检测食品中四种黄曲霉毒素 [J]. 中华预防医学杂志, 2002, 36(5): 343-345.
[23] 李海礁, 喻东威, 刘志楠, 等. 谷物中黄曲霉毒素B1检测方法的研究 [J]. 食品研究与开发, 2013, 34(21): 83-85.
[24] 高秀洁, 邓中平, 焦红, 等. 黄曲霉毒素B1快速检测方法的研究进展 [J]. 热带医学杂志, 2008, 8(12): 1297-1300.
[25] 杨小丽, 韦日伟, 申红红, 等. 免疫亲和柱净化光化学衍生高效液相色谱-荧光检测法测定动物类药材中黄曲霉毒素 [J]. 中国药业, 2011, 20(15): 4-5.
[26] 林维宣, 李继业, 田苗. 单克隆免疫亲和柱-高效液相色谱法测定牛乳中黄曲霉毒素M1[J]. 中国乳品工业, 2000(6): 24-26.
[27] 张爱婷, 石延榜, 张振凌, 等. ELISA法测定部分种子和果实类中药黄曲霉毒素B1含量 [J]. 医学研究杂志, 2008, 37(10): 48-49.
[28] 王少敏, 许勇, 毛丹, 等. HPLC-MS/MS法测定中药桃仁中黄曲霉毒素G2、G1、B2、B1[J]. 药物分析杂志, 2011, 31(5): 907-911.
[29] 林建忠, 邹伟, 张志刚, 等. LC/MS/MS测定食品中黄曲霉毒素B1的研究 [J]. 检验检疫科学, 2004(S1): 31-33.
[30] Jaimez J, Fente C A, Vazquez B I,. Application of the assay of aflatoxins by liquid chromatography with fluorescence detection in food analysis [J]., 2000, 882(1/2): 1-10.
[31] 刘笑笑, 丁辉, 吴福祥, 等. 杂质吸附固相萃取-液相色谱串联质谱法同时测定粮食中15种真菌毒素 [J]. 粮油食品科技, 2021, 29(1): 155-167.
[32] Urusov A E, Zherdev A V, Dzantiev B B. Use of gold nanoparticle-labeled secondary antibodies to improve the sensitivity of an immunochromatographic assay for aflatoxin B1 [J]., 2014, 181(15): 1939-1946.
[33] 王督, 张文, 李培武, 等. 胶体金免疫层析法快速定量分析粮油农产品中黄曲霉毒素B1[J]. 中国油料作物学报, 2014, 36(4): 529-532.
[34] 闵曼, 潘浣钰, 李丰. 中药中黄曲霉毒素检测技术的研究进展 [J]. 广东化工, 2021, 48(5): 223-224.
[35] 陈靖文. 黄曲霉素的检测方法及预防措施 [J]. 科学技术创新, 2019(20): 47-48.
[36] 徐振斌, 胡东青, 里南, 等. 胶体金免疫层析法快速定量检测玉米中黄曲霉毒素 [J]. 粮食科技与经济, 2013, 38(3): 24-26.
[37] 王桂芳, 刘美辰, 曹阳, 等. 胶体金测试条法对粮食中黄曲霉毒素B1快速定量测定的研究 [J]. 粮食科技与经济, 2013, 38(6): 17-18.
[38] 王海彬. 花生中黄曲霉毒素免疫层析快速定量技术研究 [D]. 北京: 中国农业科学院, 2012.
[39] 李耀磊, 刘丽娜, 姚云, 等. 基于胶体金免疫层析技术对中药材中黄曲霉毒素B1的定量检测研究 [J]. 中国药学杂志, 2019, 54(17): 1432-1437.
[40] 翟培, 韩晋辉. 胶体金免疫层析技术在食品安全现场快速检测中的应用 [J]. 现代农业科技, 2020(4): 225-227,229.
[41] 龚频, 王思远, 陈雪峰, 等. 胶体金免疫层析试纸条技术及其在食品安全检测中的应用研究进展 [J]. 食品工业科技, 2019, 40(13): 358-364.
[42] 单利楠, 王玉丹, 豆小文, 等. 四种大宗常用中药饮片中黄曲霉毒素污染状况分布比较研究 [J]. 世界科学技术—中医药现代化, 2020, 22(10): 3718-3725.
[43] Piermarini S, Volpe G, Micheli L,. An ELIME-array for detection of aflatoxin B1 in corn samples [J]., 2009, 20(4): 371-375.
[44] 左晓维. 粮食中真菌毒素的荧光定量免疫层析技术研究 [D]. 重庆: 西南大学, 2019.
[45] 杨杰, 李迎秋. 胶体金免疫层析技术在食品安全检测中的应用 [J]. 中国调味品, 2017, 42(10): 171-175.
[46] Masinde L A, Sheng W, Xu X,. Colloidal gold based immunochromatographic strip for the simple and sensitive determination of aflatoxin B1and B2in corn and rice [J]., 2013, 180(9/10): 921-928.
[47] 刘晓玥, 侯亚楠, 吕丽卿. 饲料中黄曲霉毒素B1快速筛查胶体金免疫层析检测方法应用研究 [J]. 吉林农业, 2017(18): 64-65.
[48] 孙夏荣, 葛晓明, 王建花. QuEChERS超高效液相色谱-串联质谱法检测中药饮片中黄曲霉毒素 [J]. 中国药业, 2020, 29(11): 44-47.
[49] 邵伟, 巴泽忠, 管树舫, 等. 赭曲霉毒素A胶体金快速检测试剂条的研制 [J]. 粮食与饲料工业, 2013(8): 58-62.
Quantitative study of total amount of aflatoxins B1 and B1, B2, G1 and G2 in Chinese herbal pieces by colloidal gold immunoaffinity method
FAN Miao-xuan,FU Xin-tong, CHEN Yi-fei, CHEN Si-ni, CHEN Jing, ZHANG Ting, CHEN You-gen
Beijing Key Laboratory of Analysis and Evaluation on Chinese Medicine, NMPA Key Laboratory for Quality Evaluation of Traditional Chinese Patent Medicine, Beijing Institute for Drug Control,Beijing 102206, China
A rapid and accurate method for quantitative determination of aflatoxins B1, B2, G1, and G2 in Chinese herbal pieces was established by using colloidal gold-side flow immunochromatography, and the pollution level of aflatoxins in prepared slices of Chinese herbal pieces was determined rapidly.The content of aflatoxin in 24 kinds of Chinese herbal pieces was determined by colloidal gold immunoaffinity method, and the results were compared by liquid mass spectrometry. The pairedtest was used to compare whether there was significant difference between the two methods. The specificity of the test strip was investigated by adding other fungal toxins. Tonga calculated the recovery rate.Theaflatoxin content in the Chinese herbal pieces were determined through side to immune colloidal gold chromatography technology. The test results of colloidal gold method and LC-MS/MS method were consistent. There was no significant difference, result in three levels in the low recovery rate was between 80.3% and 119.7%, and aflatoxin M1 and M2, ochre and aspergillus toxin, vomiting toxins and corn gibberellic ketene and other mycotoxins had no cross reaction, which met the requirements.Colloidal gold assay can be used for accurate, quantitative and rapid determination of aflatoxins in prepared slices. The method has the advantages of simplicity, rapidity and low toxicity.
total aflatoxins; immune colloidal gold lateral-flow technology; colloidal gold immune affinity method; Chinese herbal pieces; LC-MS method; ochratoxin; deoxynivalenol; zearalenone
R283.6
A
0253 - 2670(2021)17 - 5275 - 12
10.7501/j.issn.0253-2670.2021.17.020
2021-07-23
范妙璇,研究方向为中药质量分析。Tel: (010)52779500 E-mail: fmxzhy@126.com
傅欣彤,沈阳药科大学54期中药专业校友;北京市药品检验研究院中药室主任,主任药师;现为国家药典委员会第十一届药典委员;国家及北京市科技奖励办评审专家;北京市新药审评专家;北京中医药大学兼职专硕导师;参与国家科技部、国家中医药管理局、北京市科委等课题项目;曾获北京市科学技术二等奖1项,三等奖3项,北京市中医管理局科技成果二等奖2项;从事药品检验、药品标准研究工作30年;主要研究方向为中药质量控制。E-mail: fuxintong68@163.com
[责任编辑 郑礼胜]
